高血脂大鼠模型的建立*
李沁瑜,张甲名,孟祥玺,常 虹,张春红,张 娜
(包头医学院,内蒙古包头 014040)
近年来,随着经济发展和人们生活质量的提高,加上不规律饮食与作息,高脂血症的患者数量明显上升。高脂血症是指脂肪代谢或运转异常使人体血液中的血脂含量超过正常范围,表现为甘油三酯(triglyceride, TG)、总胆固醇(total cholesterol, TC)、低密度脂蛋白胆固醇(low-density lipoprotein cholesterol, LDL-C)水平的升高和高密度脂蛋白胆固醇(high-density lipoprotein cholesterol, HDL-C)水平的降低[1]。他汀类降脂药是降血脂的首选药物,作用明确且降脂作用强,但其不良反应也比较强[2]。因此,研发降脂药物具有很大的社会意义和广阔的前景。而高血脂动物模型的建立是降脂药物研究中不可或缺的一个重要环节,动物模型是否被成功复制,会直接影响实验的准确性以及结果的可靠性[3]。目前,国内的常用方法是用高脂饲料喂养动物来建立高血脂模型[4]。利用高脂饲料在饮食方面进行干预,虽然造模周期相对较长,但其形成的机制与大多数高脂血症患者的高血脂病因和发病机制相似,对于降脂药物的研究具有很高的应用价值。本实验采用高脂饮食诱导高脂血症动物模型,通过测定血清中各项指标及肝组织HE染色并造模成功。
1 对象与方法
1.1实验动物及分组 SPF级SD雄性大鼠18只,体重180~220 g,由斯贝福(北京)生物技术有限公司提供(许可证号:SCXK(京)2019-0010)。饲养温度在21~25 ℃,日温差±1 ℃;湿度在50 %~70 %。本实验由包头医学院医学伦理审查委员会批准(包医伦审动物2021第017号)。在适应性喂养1周后将大鼠进行随机分组,正常对照组10只,以正常饲料喂养;模型组8只,以高脂饲料喂养。每周称重记录体质量,喂养1周后测定血脂四项,检测前一天晚上禁食、不禁水,第2天对大鼠进行眼底静脉丛取血250 μL,测定血脂四项。继续喂养4周后再次检测血脂四项,检测前一天晚上禁食、不禁水。
1.2饲料 高脂饲料(基础饲料58.6 %,蔗糖20.0 %,猪油15.0 %,酪蛋白5.0 %,胆固醇1.2 %,胆酸钠0.2 %)由斯贝福(北京)生物技术有限公司提供。
1.3仪器与试剂 迈瑞-BS-240VET全自动生化分析仪,离心机,显微镜,3 %水合氯醛,福尔马林固定液,大鼠代谢笼,鼠板,注射器,采血针,采血管,手术剪,止血钳,血清采血管。
1.4观察指标 大鼠眼底静脉丛取血250 μL,离心,测定血清中TC、TG、HDL-C、LDL-C的含量。第8周取大鼠肝脏,称肝湿重,计算肝脏指数,于右肝边缘切一块肝脏用福尔马林进行固定,随后进行切片、HE染色法染色,观察大鼠肝脏组织的病理变化。
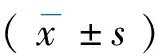
2 结果
2.1高脂饲料喂养1周和4周大鼠血脂指标变化 模型组大鼠用高脂饲料喂养后,测得第1周和第4周血脂指标的变化。两组第1周时血清TG升高较为明显,TC、LDL-C略有上升,HDL-C略有下降(P>0.05)。见表1。第4周与对照组相比,模型组大鼠血清中TC、TG、LDL-C水平显著上升,HDL-C水平显著下降(P<0.01)。见表2。

表1 大鼠第1周血脂指标的变化(SD)

表2 大鼠第4周血脂指标的变化(SD)
2.2大鼠脏器湿重及脏器比 第8周,模型组大鼠各脏器重量与对照组相比均有所增长,其中肝脏重量增长最为明显,肝脏和脾的脏器比大于对照组,心、肺、肾的脏器比小于对照组。见表3。

表3 大鼠脏器重及脏器比(SD)
2.3大鼠体重和肝脏指数、肝湿重变化 第8周,与对照组相比,模型组大鼠体重显著增长(P<0.05),肝湿重及肝脏指数均高于对照组。见表4。

表4 大鼠体重及肝脏指数、肝湿重的变化(SD)
2.4大鼠肝脏组织病理学变化 大鼠肝脏的HE染色病理切片结果显示,对照组肝细胞细胞核椭圆蓝染居细胞中间,肝细胞成列排列为肝细胞索,见图1-A;模型组大鼠肝细胞检查可见肝细胞质内大量空泡,肝细胞核被挤到旁边,肝细胞呈现弥漫性脂肪变性,大泡性与小泡性混合型脂肪变性,见图1-B。
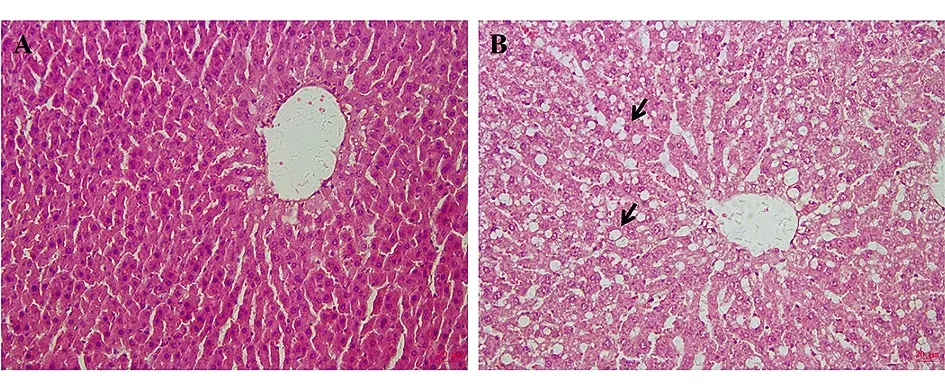
图1 A对照组大鼠肝脏病理学检查
3 讨论
在动物高脂模型建立的过程中,造模是否成功以及各项指标是否符合标准受到诸多因素的影响。其中,除了环境因素和造模时间外,实验动物的选择以及高脂饲料的配比对造模也有较大的影响,这直接关系到实验的成功与否以及模型的重现性。由于实验目的的不同,对于高脂模型的要求也有差别。家兔的脂蛋白代谢与人类较为相似,容易形成高胆固醇血症,但其造模周期相对较长,而且和人类的胆固醇代谢模式并不相似,且费用昂贵、难以灌胃,因此不利于开展大规模研究。猪对于高脂饲料较为敏感,易于诱发,且脂质代谢方式与人类较为相似,但猪长期饲养成本较高、个体差异较大。大鼠和小鼠的脂代谢途径与人类有所区别,但其来源较广,方法简单,成本适中,饲养成本较低,且大鼠较小鼠血量多,更重要的是大鼠的食性与人类相似,所形成的病变与人类早期病理改变相似,且适应性较强,是目前国内研究脂质代谢最多的实验动物[6]。高脂饲料的配比也会对高脂模型的各项指标造成影响[7]。因此,针对各种实验目的和实践的需要不同选择合适的造模动物以及高脂饲料配比对于建立高血脂动物模型,以及准确评估实验结果均具有重要意义。
在制作高脂饲料时会添加胆固醇、胆酸盐等物质,影响饲料的口味,造成动物厌食现象,具体表现为进食量减少甚至完全不进食。因此,除使用高脂饲料喂养诱导高脂血症模型外,建立高脂血症模型还可以使用脂肪乳剂灌胃法。此方法可以避免动物的厌食现象,造模周期较短,但也会导致动物摄食量减少,易发生死亡,其顺应性明显低于高脂饲料喂养[5,8]。因此,该实验选择大鼠作为模型动物,以高脂饲料进行一段时间的喂养,从而建立高血脂动物模型,是一种较为稳妥的办法。
本研究造模1周后对模型组大鼠血清进行检验,虽然TC、TG、LDL-C水平较对照组大鼠有所升高,但变化并不显著,结果不具有统计学意义(P>0.05)。说明建模未成功,证明用高脂饲料喂养1周的时间尚短,但其结果在研究中仍具有一定意义,证明了方法的可行性。通过增加造模时间和实验动物数量等方法可以解决造模时的重量差异等问题,提高数据的准确性。造模4周后,对大鼠血清中血脂指标进行检测,结果显示,与对照组相比,模型组大鼠血清TC、TG、LDL-C水平均显著上升,HDL-C水平出现较为显著的下降(P<0.01),实验结果与陈育尧等[9]所得出的结果基本相符,形成了比较稳定的混合型高脂血症模型。
在建模第8周时,模型组大鼠的各脏器明显比对照组重(P<0.05),但是从脏器比来看,模型组大鼠除肝脏和脾脏,其他脏器的脏器比均小于对照组,这可能会导致心脏等循环器官的负荷加重,引起其他方面如循环或代谢系统的疾病和损伤。大鼠肝脏比重的过度增加以及肝脏组织病理切片的脂肪样变性说明大鼠在第8周后形成了脂肪肝。当脂肪代谢紊乱时,可使脂肪堆积于肝脏内形成脂肪肝。由此可以看出,通过不同实验对于模型指标要求的不同,需要对高脂饲料的配比、投喂量、投喂频率以及造模时间等进行调控,来辅助建造符合实验要求的动物模型如高血脂合并脂肪肝模型、高血脂合并高血压模型、冠心病合并高血脂模型等[9-11]。
本实验采用高脂饲料持续喂养SD大鼠4周来诱导高血脂模型,具有操作简单、造模时间短、造模指标稳定、重现性好的优点,可广泛用于医疗保健产品及降脂药物的研究与开发,也可为与本实验相似的研究提供依据和参考。

