白介素-28A增加顺铂对卵巢癌细胞毒性的作用及机制研究
朱 琳,潘孝华,孙 磊,何 静,3,肖 兰,颜士杰
(1.安徽医科大学第二附属医院妇产科,合肥 230601;2.安徽医科大学第一附属医院妇产科,合肥230020;3.安庆市立医院妇产科,安庆 246003)
近期研究证实,卵巢癌的发生、发展与机体免疫系统失衡密不可分,免疫疗法在卵巢癌中展示了良好的临床应用前景[1-2]。大量实验和临床报道均证实,干扰素具有抗肿瘤作用,可明显延长肿瘤患者无进展生存期,而单一免疫疗法不能彻底抑制肿瘤生长。免疫疗法联合化疗药物可实现对肿瘤的协同抑制,推进其在肿瘤治疗中的应用。Ⅲ型干扰素(IFN-γ)是一组新型干扰素,主要包括IL-29、IL-28A及IL-28B,其可通过激活细胞信号通路发挥抗病毒、抗增殖、抗肿瘤和免疫调节作用[3]。Ⅲ型干扰素结构与Ⅰ型干扰素相似,功能却较Ⅰ型干扰素强,且需与受体结合才能起效,这一特点可减少常用白介素导致的发热、疲劳不适等不良反应[4]。研究证实,IL-28B可增强顺铂对头颈部肿瘤细胞的毒性作用[5],目前关于IL-28A与卵巢癌发生及IL-28A联合化疗抗肿瘤的研究均未见报道。本研究拟探讨IL-28A增加顺铂对卵巢癌细胞毒性作用及可能机制,为研发基于IL-28A的卵巢癌免疫化疗疗法提供基础理论支持。
1 材料与方法
1.1 材料
1.1.1 主要试剂 顺铂(山东齐鲁制药),重组人IL-28A(rhIL-28A)、IL-28A及IL-10R2兔多克隆抗体(美国Abcam),MICA(H-300)兔多克隆抗体(美国Santa Cruz);Annexin V-FITC试剂盒(南京凯基),Trizol试剂(美国Invitrogen),逆转录试剂盒、SYBR Green Master Mix(日本TaKaRa),CCK-8及LDH检测试剂盒(上海碧云天),抗PE免疫磁珠(德国美天妮),IL-28A ELISA试剂盒(美国R&D)。
1.1.2 组织样本 选取2017年1月至2018年9月就诊于安徽医科大学第一附属医院妇产科且均经病理学诊断为卵巢癌的患者53例,FIGO分期:I、II期20例,III、IV期33例。同期因子宫肌瘤需手术患者28例(留取正常卵巢上皮)。卵巢癌组患者的平均年龄(49.1±10.2)岁,对照组平均年龄(46.5±9.6)岁。排除自身免疫病及其他系统肿瘤,术前均未接受新辅助化疗、免疫及靶向治疗。研究对象均签署知情同意书,并通过医院伦理委员会审查。
1.1.3 细胞株 卵巢癌顺铂耐药细胞株C13K为本室保存,HOSEPIC购自武汉大学生物保藏中心。
1.2 方法
1.2.1 细胞培养 C13K和HOSEPIC细胞于含15%小牛血清1640培养液,置37℃、5% CO2培养箱培养。细胞融合度达70%~80%时,0.25%胰蛋白酶消化传代,取对数生长期细胞进行实验。
1.2.2 IL-28A预处理及顺铂干预实验分组 阴性对照组、PBS组及rhIL-28A(100ng/ml)组,各组均顺铂(60μmol/L)干预24h。
1.2.3 CCK-8检测顺铂IC50及细胞存活率 将各组细胞按1×104细胞/孔接种至96孔板,继续培养24h。IC50检测:顺铂(0~200μmol/L)培养24h,更换新鲜培养基,加10μl CCK-8,继续培养4h,570nm波长各孔细胞OD值。IC50=(1-实验组OD值/对照组OD值)×100%。细胞增殖:DDP(60μmol/L)培养24h,加10μl CCK-8,继续培养4h,450nm波长处各孔吸光度OD值。实验均重复3次,取平均值。
1.2.4 流式细胞术检测细胞凋亡 0.25%胰酶消化细胞,0.01mol/L冰PBS 0.5ml重悬细胞,1000r/min离心5min,去除培养基,PBS洗涤1次,弃上清,收集细胞。200μl Binding Buffer重悬细胞,加10μl Annexin V-FITC和5μl PI,室温避光孵育30min,加300μl Binding Buffer,1h内流式细胞仪检测细胞凋亡,Cell Quest软件分析,实验重复3次。
1.2.5 NK细胞分离与纯度检测 将健康志愿者外周静脉血沿管壁加至淋巴细胞分离液离心管,3000r/min离心20min,得到外周血单个核细胞;1×107细胞加80μl PBS缓冲液和20μl抗CD56免疫磁珠,4℃孵育15min;1×107细胞加1ml缓冲液,1000r/min离心10min,去上清;1×108细胞加500μl缓冲液,混匀加至MiniMACS磁场分离,无菌试管收集阴性细胞,500μl缓冲液冲洗3次;取下柱子,加1ml培养基,将分选阳性细胞推入无菌试管,流式检测CD3-CD16+CD56+细胞即NK-细胞纯度。
1.2.6 LDH释放法检测细胞杀伤活性 按5×103细胞/孔加至培养孔,设3个复孔。以新鲜分离NK细胞为效应细胞,按效靶比(10∶1)加NK细胞50μl。常规培养条件下孵育6h,吸取上清50μl,加至96孔酶标板,加LDH底物反应液和终止液。检测LDH值,根据LDH检测试剂盒中公式计算NK细胞杀伤活性。
1.2.7 酶联免疫吸附试验(ELISA)检测细胞中IL-28水平 收集细胞培养上清,按试剂盒说明书步骤进行检测,重复2次。读取450nm处吸光度值,根据阳性蛋白对照绘制标准曲线,计算各样品IL-28A浓度。
1.2.8 Real Time-PCR检测IL-28A、IL-10R2和MICA mRNA水平 收集组织标本及顺铂作用各组细胞,将组织样本置液氮中研磨成匀浆,Trizol法提取组织和细胞RNA,反转录合成cDNA。PCR引物序列:IL-28A上游5'-GCCCAGTTCAAGTCCCGT-3',下游5'-GGTCATGTTCTCCCACACCT-3';IL-10R2上游5'-TGGATGACACCATTATTGGACCC-3,下游5'-TTTGCTCACAGACAGGCTCACTC-3';MICA上游5'-AACCCTGACTGCACAGATCC-3',下游5'-ATCTTCCCTTTTGCACCTCC-3';β-actin上游5'-AGAAGGCTGGGGCTCATTTG-3',下游5'-AGGGGCCATCCACAGTCTTC-3'。2△△Ct法计算各组细胞中不同基因mRNA相对表达量,实验重复3次。
1.2.9 免疫荧光染色 将各组细胞按2.5×104细胞/孔接种于6孔培养板,放入盖玻片,细胞贴壁后加顺铂继续培养24h。预冷100%甲醇,-20℃固定细胞5min;0.5%Triton-PBS破膜5~10min。0.2% Triton-PBS漂洗3次,5% BSA封闭1h,MICA抗体(1∶200)4℃孵育过夜;0.2% Triton-PBS漂洗3×10min;羊抗兔IgG-FITC(1∶500)37℃孵育1h;0.2% Triton-PBS漂洗3×10min,PI复染核5~7min,封片,激光共聚焦显微镜下观察照相。胞质中FITC标记MICA蛋白表达绿色荧光为表达阳性。
1.2.10 Western blot法检测IL-28A及IL-10R2蛋白水平 50μg蛋白质样品行SDS-PAGE电泳,湿转至硝酸纤维膜;5% BSA室温封闭2h,0.05% Tween20的TBS缓冲液(TBST)漂洗,10min×3次;加IL-28A(1∶1000)及IL-10R2(1∶1000)一抗,GAPDH一抗(1∶5000),4℃过夜,1×TBST漂洗3遍,对应辣根过氧化物酶标记二抗(1∶5000),37℃摇床温育2h,ECL显色曝光,采集照片。
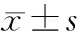
2 结 果
2.1 卵巢癌组织及细胞中IL-28A基因表达 Real time-PCR证实,正常卵巢上皮组织及细胞中IL-28A表达水平分别为4.78±1.24和13.63±4.32,均显著高于卵巢癌组织和细胞(1.24±0.71和1.37±0.93),差异均有统计学意义(P=0.000)。
2.2 细胞IC50、细胞存活率及凋亡率比较 顺铂作用24h,IL-28A组C13K细胞对顺铂的IC50由(95.37±1.20)μmol/L降至(51.72±1.07)μmol/L(P=0.000)。单独rhIL-28A预处理对C13K细胞活性无显著影响,但与顺铂共用时IL-28A组细胞存活率显著降低(P=0.000)(表1)。rhIL-28A对C13K细胞凋亡无直接影响,与顺铂共用时C13K细胞凋亡率显著增加(P=0.000)(表1)。

表1 细胞存活及凋亡率比较
2.3 IL-28A提高NK细胞对C13K细胞杀伤活力 NK细胞效靶比10:1共培养6h,IL-28A组NK细胞对C13K细胞杀伤活性显著增加,NK细胞对C13K细胞的杀伤活性由IL-28A预处理前(25.87±0.95)%升至(39.26±1.95)%,与阴性对照组和PBS组比较,差异均有统计学意义(P=0.000)。
2.4 ELISA检测上清液中IL-28A表达 ELISA检测结果显示,顺铂作用24h,IL-28A组上清液中IL-28A水平较阴性对照组及PBS组明显升高(P=0.000)(图1)。
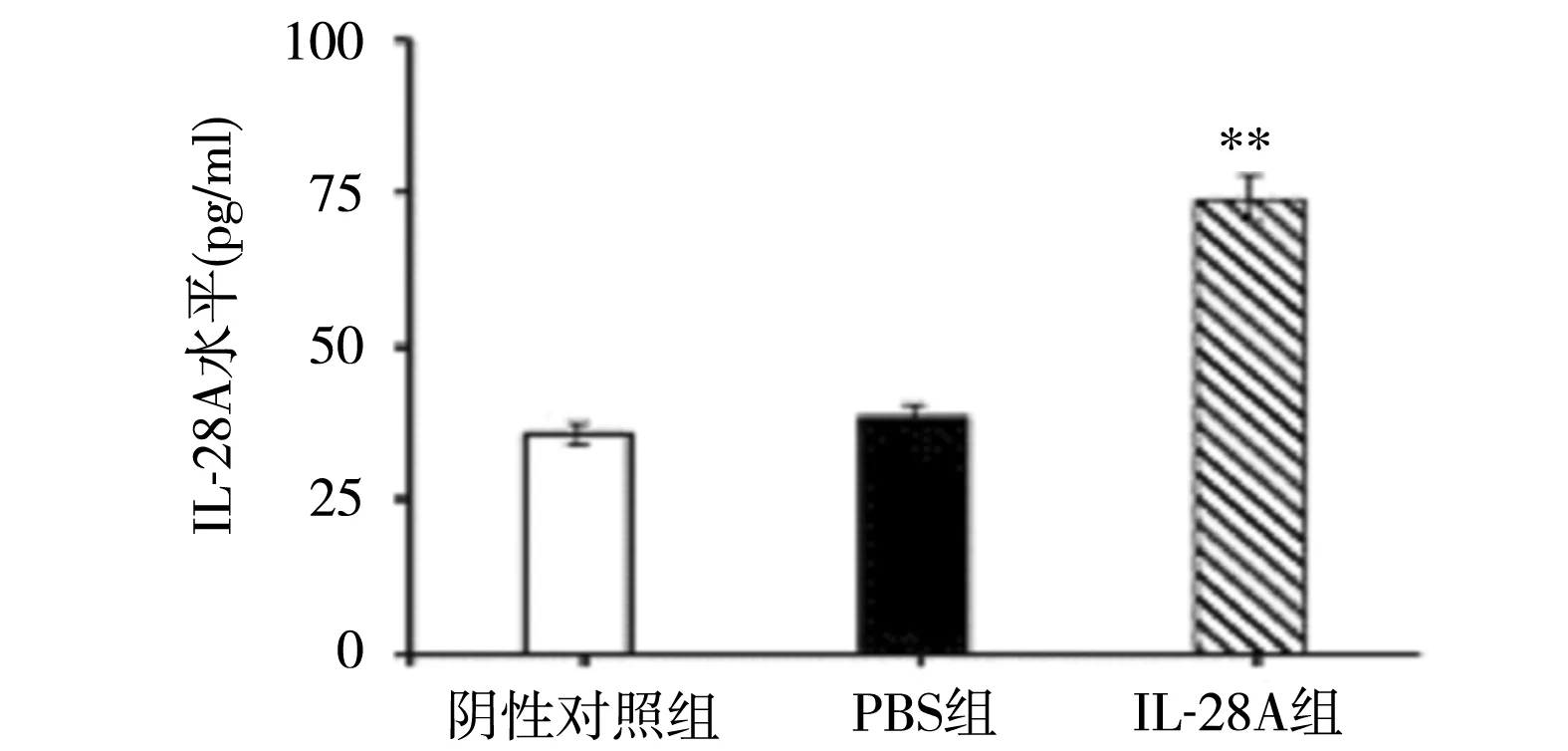
图1 上清液中IL-28A表达水平比较**P<0.01 vs 阴性对照组、PBS组
2.5 IL-28A、IL-10R2和NKG2D配体MICA mRNA水平 顺铂作用24h,IL-28A组C13K细胞中IL-28A、IL-10R2及MICA mRNA表达均显著升高,与阴性对照组和PBS组比较,差异均有统计学意义(P=0.000)(表2)。

表2 IL-28A、IL-10R2和MICA mRNA表达
2.6 MICA蛋白表达 激光共聚焦显微镜显示,MICA蛋白主要表达于细胞质,顺铂作用24h,与阴性对照组及PBS组比较,IL-28A组C13K细胞中MICA蛋白表达明显升高(图2)。

图2 细胞中MICA蛋白表达比较(×600)A:阴性对照组;B:PBS组;C:IL-28A组;蓝色荧光:DAPI染色细胞核;绿色荧光:FITC荧光二抗标记MICA表达
2.7 IL-28A及IL-10R2蛋白表达 Western blot法结果显示,顺铂作用24h,与阴性对照组及PBS组比较,IL-28A组C13K细胞中IL-28A及IL-10R2蛋白表达均明显上升(图3)。

图3 细胞中IL-28A及IL-10R2蛋白表达比较
3 讨 论
目前IFN-γ的研究已进入II期临床试验。尽管IFN-γ的抗肿瘤效果不如IFNα/β,但IFN-γ与化疗药物联用可达到协同抗肿瘤作用,如IFN-γ联合化疗在治疗舌鳞癌中具有协同效果[6]。目前已证实IL-28A有抗增殖、抗肿瘤、免疫调节及评估化疗疗效作用[7]。IL-28受体IL-10R2是一种异二聚体型Ⅱ类细胞因子受体,IL-28A与IL-10R2结合后形成异源二聚体,从而激活下游信号转导通路。但是,在卵巢癌细胞中,IL-28A与化疗药物是否有协同作用未见报道。
本研究结果首次发现,卵巢癌组织和细胞中IL-28A mRNA表达显著低于正常卵巢上皮组织及细胞,表明IL-28A低表达与卵巢癌发生发展相关。本研究结果亦显示,rhIL-28A与顺铂联合后,细胞存活率显著下降,细胞凋亡率明显增加,顺铂对C13K细胞IC50值显著降低,而rhIL-28A单独干预对卵巢癌细胞却无此效果,提示IL-28A联合顺铂对C13K细胞具有协同效果。
NK细胞是机体防御肿瘤的重要效应细胞,NK细胞数量改变和功能缺陷与晚期卵巢癌腹腔内肿瘤细胞增殖和转移相关[8]。IFN-γ对NK细胞发挥效应功能具有重要调节作用[9]。另有研究证实,IL-28A诱导的免疫应答依赖于NK细胞的产生[10]。NK细胞表面NKG2D(自然杀伤细胞2族成员D)受体及其配体MICA在活化NK细胞过程中起到十分关键的作用。晚期肿瘤患者体内淋巴细胞表面NKG2D表达明显降低,其介导的NK细胞免疫监视作用减弱[11]。NKG2D配体广泛表达于肿瘤细胞中,各种形式刺激如热休克、DNA损伤等均可诱导NKG2D配体表达[12]。顺铂可上调MHC I类链相关分子A/B表达,并与非小细胞肺癌患者预后良好有关[13]。本研究发现,IL-28A预处理可增加NK细胞对C13K细胞杀伤力,顺铂作用后,随着IL-28A水平升高,C13K细胞中IL-10R2及MICA mRNA及蛋白水平均明显升高,IL-28A可诱导C13K细胞表达MICA蛋白。
综上所述,卵巢癌组织中IL-28A水平较正常卵巢上皮显著降低,提示IL-28A与卵巢癌相关;IL-28A可协同增强顺铂对卵巢癌细胞的毒性作用,其机制可能与IL-28A阻断C13K细胞增殖信号通路,诱导细胞凋亡;另一方面,IL-28A通过与IL-10R2结合,可能促进C13K细胞表达MICA,使其与NK细胞表面NKG2D受体结合,提高了NK细胞杀伤活性,从而增加顺铂对卵巢癌细胞的毒性,这为肿瘤免疫化学治疗提供一定研究基础,为改善卵巢癌疗效带来了新契机。而IL-28A通过哪些信号通路及关键分子诱导卵巢癌细胞NKG2D配体表达,则有待进一步证实。

