YAP通过激活自噬调控脑胶质瘤细胞血管生成拟态的形成
周丽丽,安吉洋
1)郑州大学第一附属医院肿瘤科 郑州 450052 2)郑州大学第一附属医院神经外科 郑州 450052
脑胶质瘤恶性程度高,预后差,抗血管靶向治疗是防止其侵袭和进展的重要策略[1]。然而研究[1]表明,抗血管生成治疗药物贝伐珠单抗不能提高胶质瘤患者的总体生存率,甚至可能因缺氧等因素加速肿瘤侵袭转移,增强化疗抵抗,并在停药后迅速反弹。血管生成拟态(vasculogenic mimicry,VM)是肿瘤细胞的另一种供血途径,在肿瘤发生发展中起着重要作用[2]。自噬在胶质瘤VM形成中发挥重要作用[3]。自噬通过介导血管内皮生成因子受体2(vascular endothelial growth factor receptor 2,VEGFR-2)活化促进VM的形成[1],LC3是自噬过程的标志物。Yes相关蛋白(yes-associated protein,YAP)是Hippo信号通路中最关键的下游效应因子,在包括胶质瘤在内的多种恶性肿瘤中高度表达,并参与肿瘤的发生发展[4]。本研究以胶质瘤细胞为研究对象,以YAP为靶点,通过基因干预和药物干预方法研究YAP对胶质瘤细胞自噬及VM形成的影响,为胶质瘤的治疗提供新的思路。
1 材料与方法
1.1细胞系与主要试剂人脑胶质瘤细胞系HS683、H4、U118、U87和U251细胞购自上海中科院细胞库。维替泊芬(YAP抑制剂)购自Selleck公司,二甲基亚砜(DMSO)、兔抗LC3抗体购自Sigma公司,兔抗YAP抗体购自Cell Signaling Technology公司,兔抗VE-cadherin抗体购自Abcam公司,二抗购自Proteintech公司。
1.2细胞培养和YAP蛋白表达的检测HS683、H4、U118、U87和U251细胞分别用含体积分数10%胎牛血清的DMEM培养基和MEM培养基(Hyclone公司),于37 ℃、体积分数5% CO2的细胞培养箱中培养。采用Western blot法检测上述细胞中YAP蛋白的表达:RIPA裂解液提取细胞总蛋白;取50 μg蛋白样品行SDS-PAGE电泳,湿转法转移至PVDF膜,将膜放入50 g/L脱脂牛奶或牛血清白蛋白中37 ℃封闭1~2 h;加一抗(兔抗YAP抗体,1∶1 000稀释),4 ℃孵育过夜。TBST缓冲液洗膜后,将膜与辣根过氧化物酶标记的二抗(1∶10 000稀释)室温孵育1 h,洗膜后采用化学发光法显影,凝胶成像系统拍照后采用Quantity One软件测定条带灰度值,目的蛋白的表达水平以目的蛋白条带和GAPDH条带灰度值的百分比表示。实验重复3次。
1.3调控YAP表达对U87和U251细胞VM形成及LC3、VE-cadherin蛋白表达的影响根据1.2结果筛选出YAP高表达的U251细胞系和YAP低表达的U87细胞系,采用慢病毒感染干扰U251细胞系YAP的表达、上调U87细胞系YAP的表达。具体步骤如下:取对数生长期的细胞,U87细胞感染YAP过表达慢病毒(Flag标记的LV-YAP,YAP过表达组)和阴性对照慢病毒;U251细胞感染YAP shRNA慢病毒(YAP shRNA组)和阴性对照慢病毒,所用慢病毒均由中国吉凯基因有限公司合成。感染24 h后用含血清培养基培养,并用0.2 mg/L嘌呤霉素筛选细胞。
参照文献[5]观察胶质瘤细胞VM结构的形成:96孔板用30 μL Matrigel基质胶(美国BD公司)涂布,37 ℃下聚合1 h后,将筛选出的细胞分别以2×104个/孔的密度接种到基质胶表面,孵育24 h。倒置显微镜下观察细胞形态并计数管样结构。实验重复3次。
收集筛选出的细胞,提取蛋白。按1.2中Western blot法检测YAP、LC3(LC3Ⅱ/LC3Ⅰ)、VE-cadherin蛋白的表达,其中一抗均按1∶1 000稀释,二抗均按1∶10 000稀释。实验重复3次。
1.4维替泊芬对U87和U251细胞VM形成及YAP、LC3、VE-cadherin蛋白表达的影响U251和U87细胞分别接种于96孔板和6孔板,2×105个/孔,以5 μmol/L(根据预试验选择)维替泊芬处理。另设溶剂对照组。处理24 h后,96孔板细胞用于在倒置显微镜下观察细胞形态并计数管样结构,6孔板细胞裂解,提取蛋白,采用Western blot法检测YAP、LC3、VE-cadherin蛋白的表达情况。
1.5统计学处理应用SPSS 16.0处理数据。采用两独立样本t检验比较YAP shRNA组(U251细胞)、YAP过表达组(U87细胞)与阴性对照组管样结构数、YAP蛋白、LC3及VE-cadherin蛋白表达的差异,以及溶剂对照组和维替泊芬组上述指标的差异。检验水准α=0.05。
2 结果
2.1不同胶质瘤细胞系中YAP蛋白的表达YAP在不同胶质瘤细胞系中的表达不同,U87细胞中表达最低,U251细胞中表达最高(图1)。
2.2调控YAP表达后U251及U87细胞VM形成及LC3、VE-cadherin蛋白表达的变化下调U251细胞YAP表达后,VM形成减少,LC3、VE-cadherin表达减低;上调U87细胞YAP表达后,VM形成增多,LC3、VE-cadherin表达增高(图2、3及表1、2)。

图1 不同胶质瘤细胞系中YAP蛋白的表达
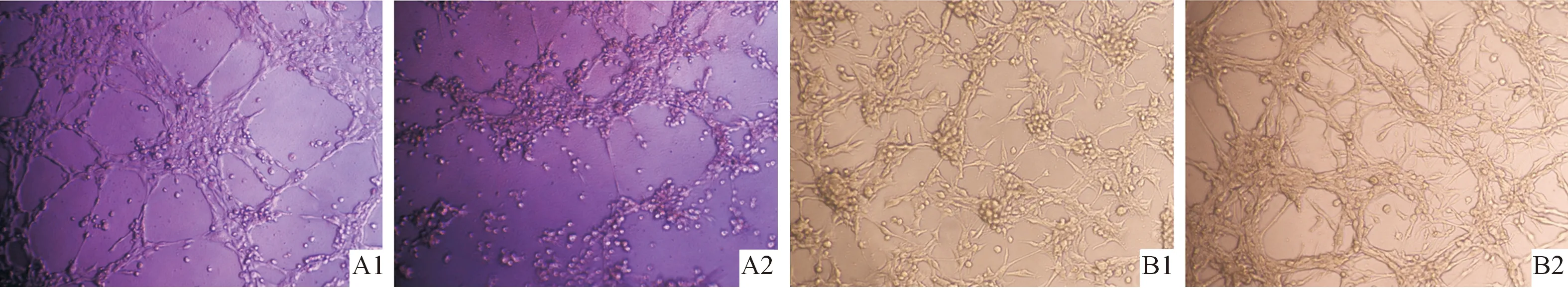
A1、A2:阴性对照组和YAP shRNA组(U251细胞);B1、B2:阴性对照组和YAP过表达组(U87细胞)

1、2:阴性对照组和YAP shRNA组(U251细胞);3、4:阴性对照组和YAP过表达组(U87细胞)

表1 YAP干扰对U251细胞VM形成及YAP、LC3、VE-cadherin蛋白表达的影响

表2 YAP过表达对U87细胞VM形成及YAP、LC3、VE-cadherin蛋白表达的影响
2.3维替泊芬对U251和U87细胞VM形成及YAP、LC3、VE-cadherin蛋白表达的影响与溶剂对照组相比,维替泊芬组VM形成减少,YAP表达减低,LC3和VE-cadherin的表达也减低(图4、5,表3、4)。

A1、A2:分别为溶剂对照组、维替泊芬组(U251细胞);B1、B2:分别为溶剂对照组、维替泊芬组(U87细胞)

1、2:分别为溶剂对照组、维替泊芬组

表3 维替泊芬对U251细胞VM形成及YAP、LC3、VE-cadherin蛋白表达的影响

表4 维替泊芬对U87细胞VM形成及YAP、LC3、VE-cadherin蛋白表达的影响
3 讨论
VM是一种肿瘤组织内微环境结构,肿瘤细胞通过变形、重塑以及相互连接形成管腔样结构,向组织供应血液[2]。VM阳性的肿瘤一般具有高侵袭性、生长迅速、易转移、预后差等特点[6]。自噬是指细胞处在低氧、营养及生长因子匮乏的环境时通过降解错误折叠的蛋白及受损细胞器以满足能量需求、维持存活[7-11]。研究[1]发现自噬可诱导VEGFR-2激活,从而促进胶质瘤干细胞形成VM,抑制自噬可以减少贝伐珠单抗诱导的移植胶质瘤VM形成。自噬相关基因Becin1被抑制后,胶质瘤细胞VM形成减少[6]。本研究发现基因及药物干预YAP后,VM形成和自噬相关蛋白的表达均有相同的变化趋势,提示YAP可能通过调控自噬影响VM形成。研究[7]显示,YAP/TAZ共转录调节肌球蛋白Ⅱ基因的表达和F-actin应激纤维的聚合,从而促进自噬体的形成,细胞对缺氧及低糖耐受,具有更强的增殖活性。在乳腺癌、卵巢癌中均有研究发现YAP通过诱导自噬促进肿瘤细胞存活及耐药[8-10]。
YAP是微环境内细胞的压力感受器,也是Hippo信号通路下游关键的效应因子。YAP功能异常与肿瘤的发生、细胞增殖、干性维持、侵袭转移等密切相关。近年来的研究[11-14]发现mTOR、SOX2等多种分子通过维持YAP的功能促进胶质瘤进展。Wei等[15]在胰腺导管腺癌中发现抑制YAP-TEAD复合物后,Ang2、MMP2、VE-cadherin、α-SMA表达降低,VM形成减少。Azad等[16]研究发现,YAP/TAZ是介导VEGF/VEGFR诱导的血管生成及VM形成的关键分子。YAP 通过调控Twist 与F-actin 蛋白促进胶质瘤细胞的侵袭、转移能力[17]。YAP影响了肿瘤增殖、细胞形态、黏附蛋白、EMT表型等,使肿瘤细胞具备了形成VM的表型特征;YAP 被激活后入核与HIF-1α结合形成复合物,维持HIF-1α的稳定性,并促进其表达与转录,进一步增强肿瘤细胞形成VM的条件[18]。
总之,本研究发现YAP影响了胶质瘤细胞VM的形成,其机制可能与调控自噬有关。本研究为揭示参与VM形成的信号通路提供了实验依据,为胶质瘤的抗血管治疗提供了新的靶点。

