重复经颅磁刺激对注意缺陷多动障碍儿童临床症状及血清脑源性神经营养因子的影响
贾玲,母代斌,李积梅
注意缺陷多动障碍(ADHD)是儿童期常见的心理行为障碍;患病率约5.9%~7.1%[1];其症状和功能损害可持续到成年期,给个人、家庭和社会带来重大负担[2]。药物是临床治疗ADHD的主要方法;虽有一定的疗效,但长期服用及其不良反应会对儿童的生长发育造成影响,甚至增加物质滥用的风险[3]。近10年重复经颅磁刺激(rTMS)在神经精神疾病的治疗中有较大的进展,并被逐渐尝试运用于治疗ADHD;脑源性神经营养因子(BDNF)因其对中枢神经系统多种类型神经元的生长、发育和修复发挥重要作用,且与学习、记忆等认知过程密切相关;对抑郁症[4]及精神分裂症[5]的研究表明,rTMS可改善血清BDNF水平,达到治疗的效果。经新疆医科大学第一附属医院伦理委员会审核批准,本研究在盐酸哌甲酯治疗的基础上,应用高频(10 Hz)rTMS作用于ADHD患儿右侧前额叶皮质,分析其对临床症状和血清BDNF水平的影响。
1 对象和方法
1.1 对象 选取2017年1月至12月新疆医科大学第一附属医院心理医学科住院部及门诊收治的ADHD儿童。入组标准:①符合美国《精神障碍诊断与统计手册》第4版(DSM-IV)诊断标准;②年龄6~12周岁,右利手;③既往未接受过任何ADHD治疗;④能配合完成研究所需要的检查及治疗。排除标准:①有rTMS禁忌证;②共病其他精神障碍;③有癫痫及严重躯体疾病;④治疗过程中出现严重不良反应,需要终止治疗或失访者;⑤除了研究所用治疗手段外还需要其他治疗者。入组前受试者和监护人均知情,并由监护人签署知情同意书。
共34例ADHD患儿入组,用随机数字表法均分为rTMS真刺激组和伪刺激组各17例,其中真刺激组脱落2例(服药后食欲明显下降而退出1例,家庭原因无法继续完成治疗1例),伪刺激组脱落2例(治疗第2天因恶心不适无法继续治疗1例,失访1例),最终两组各完成15例。真刺激组:男10例,女5例;汉族11例,维吾尔族3例,回族1例;年龄6~10岁,平均(8.07±1.16)岁;病程2~5年,平均(3.07±0.96)年。伪刺激组:男11例,女4例;汉族11例,维吾尔族3例,回族1例;年龄6~12岁,平均(8.53±1.55)岁;病程2~6年,平均(3.40±1.18)年。两组性别、年龄、民族、病程比较差异无统计学意义。
1.2 方法
1.2.1 临床评估 在治疗前和治疗4周,由培训合格的两名心理测评师指导患儿父母使用中文版注意缺陷多动障碍斯诺佩评估量表第4版(SNAP-IV)-父母版评估患儿症状。SNAP-IV包括3个分量表、26个条目组成:注意缺陷量表(条目1~9)、多动冲动量表(条目10~18)、对立违抗量表(条目19~26);由每条目按4级(0~3)评分,分数越高,症状越严重。同时进行血常规、肝肾功能、心电图检查。
1.2.2 药物治疗 入组后两组患者均单一服用盐酸哌甲酯控释片(专注达)18 mg/d,连续4周,期间不合并其他药物。
1.2.3 rTMS治疗 采用YRDCCY-I型经颅磁刺激仪(武汉依瑞德公司生产),线圈为“8”字形,由1名不参加此课题的技师治疗。刺激部位为右侧前额叶皮质,治疗参数:频率为10 Hz,强度为100%运动阈值,刺激脉冲数为2 000个,每次间隔30 s,每次30 min,每周5次。真刺激组线圈放置与颅骨平行,伪刺激组线圈平面与头皮呈90°角,其患儿接受治疗时刺激感觉与真刺激组接近,但为无效刺激。
1.2.4 血清BDNF水平检测 在治疗前和治疗4周晨取空腹肘静脉血2 ml,室温下凝固30 min后再离心20 min(2 000 r/min),分离血清保存于-20 ℃冰箱中。采用酶联免疫吸附法(ELISA)检测血清BDNF浓度,使用的BDNF ELISA试剂盒由武汉博士德生物工程有限公司提供,所有样本由同一人使用同一批号试剂盒严格按照说明书集中一次检测。
1.2.5 统计学方法 采用SPSS 17.0统计软件;计数资料的比较采用卡方检验,计量资料同一组患者治疗前后比较使用配对t检验,两组间比较使用两独立样本t检验,两变量之间相关性采用Pearson相关分析。以P<0.05为差异有统计学意义。
2 结果
2.1 两组治疗前后SNAP-IV评分比较 治疗前两组SNAP-IV总分及各分量表得分差异无统计学意义;治疗后,两组SNAP-IV总分及各分量表得分明显降低 (P均<0.01);真刺激组多动冲动分明显低于伪刺激组(P<0.05)。见表1。

表1 两组治疗前后SNAP-IV评分的比较
2.2 两组治疗前后血清BDNF水平比较 治疗前两组血清BDNF水平差异无统计学意义;治疗后两组血清BDNF水平明显升高(P<0.05或P<0.01),但两组间差异无统计学意义。见表2。
2.3 真刺激组SNAP-IV分与血清BDNF水平的相关性分析 治疗前后真刺激组SNAP-IV总分差值[(-26.93±9.57)分]、注意缺陷分差值[(-10.00±3.21)分]、多动冲动分差值[(-10.73±4.82)分]、对立违抗分差值[(-6.00±4.14)分]与血清BDNF差值[(3.19±2.84)ng/ml]无相关。见表3。
2.4 安全性分析 rTMS真刺激组研究中仅有1例在第1天行rTMS治疗后出现能耐受的轻度头痛,持续2 d后自行缓解。两组均未见严重不良反应,且治疗前后血常规 、肝肾功能、心电图等检查均未见明显异常。
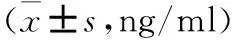
表2 两组患者治疗前后血清BDNF水平比较

表3 真刺激组治疗前后SNAP-IV分值变化与血清BDNF改变的相关性
3 讨论
rTMS治疗因操作方便、无痛、无创、相对安全等优点被广泛应用于精神疾病的治疗,现在也被逐渐尝试用于治疗儿童精神疾病,因其治疗风险较小及耐受性良好,具有巨大的发展前景[6]。rTMS不同频率刺激所致的作用不同,低频刺激(≤1 Hz)能抑制神经元的活动,降低大脑皮质兴奋性;高频刺激(>1 Hz)能易化大脑神经元的活动,提高大脑皮质兴奋性[7]。有关ADHD影像学及大脑半球不对称功能测试[8]提示ADHD患儿右侧前额叶皮质功能障碍,兴奋性降低,故本研究选择高频rTMS,刺激ADHD患儿右侧前额叶皮质,以提高其兴奋性并改善功能障碍。本研究表明,两组疗效差异无统计学意义;但真刺激组多动及冲动症状改善明显好于伪刺激组;且安全性较好,仅1例出现一过性的头痛;与Weaver等[9]以及王利智[10]研究结果一致。真刺激组对多动及冲动症状的改善更优可能是rTMS的治疗作用,有研究[11]表明采用 rTMS 抑制右侧前额叶皮质活动后,受试倾向于选择更冒险的选项,提示受试的抑制控制能力减弱后,更可能做出冒险决策;而刺激右侧前额叶皮质活动兴奋性增强后会降低风险行为,增加安全行为。本研究使用高频rTMS刺激ADHD患儿右侧前额叶皮质可提高其兴奋性,使抑制控制能力增强,从而降低多动及冲动等风险行为。ADHD发病的生物学机制不明;研究[12]认为BDNF功能减退可能是ADHD的发病原因之一;BDNF的质或量发生改变都有可能导致神经递质系统的功能障碍从而引起ADHD发病。有动物实验[13]显示血清BDNF与脑内BDNF水平呈正相关变化趋势。本研究发现,经治疗后随着ADHD患儿症状改善,其血清BDNF水平较之前也有明显升高;提示血清BDNF水平可反映ADHD症状的严重程度;这与Amiri等[14]的研究结果相一致,说明低的BDNF水平可能导致了ADHD患者的神经发育缺陷。但Shim等[15]发现,未治疗的ADHD患者血清BDNF水平较正常对照组明显增高;认为升高的血清BDNF水平可能是对ADHD儿童的一种补偿机制。Scassellat等[16]发现,ADHD儿童与正常对照组儿童血清BDNF水平没有明显差异;甚至还有一些研究认为血清BDNF水平在最初几年增加,然后在达到成人水平后降低。出现有争议的结果可能与各个研究中受试者的年龄、性别、种族等不同有关,且儿童的脑部发育尚不成熟,个体差异较大,体内的BDNF含量可能处于动态变化中,未达到相对稳定的状态。故血清BDNF浓度对ADHD患儿是否有预测疗效的作用暂不能在本研究中被证实,但可为今后的研究提供参考。
rTMS治疗神经精神疾病与BDNF及其通路有着不可分割的联系。目前多认为rTMS有增加BDNF的表达并抑制细胞凋亡的作用,其产生的生物电效应可以影响神经细胞的代谢及其功能,使神经细胞内的信号通路发生适应性改变,导致BDNF的特异性受体酪氨酸蛋白激酶B[17]、第二信使 c-fos[18]及调节BDNF表达的重要转录因子cAMP反应元件结合蛋白[19]的水平上调,从而使BDNF表达的水平增高,促进海马上各种神经元的再生,发挥神经保护作用。在本研究中真刺激组与伪刺激组治疗后的血清BDNF水平比较无明显差异,且真刺激组的治疗前后血清BDNF浓度差值与SNAP-IV量表减分差值无相关性,说明高频rTMS治疗不能显著提高ADHD患儿血清BDNF水平,这可能与样本量较小、研究对象为儿童有关,且rTMS治疗ADHD儿童的刺激频率、强度、部位、治疗周期等尚不明确。
本研究也存在着一定的不足。首先,本次试验虽然研究的是高频rTMS对ADHD患儿的症状改善及血清BDNF水平的影响,但出于伦理学要求,并未设置单用高频rTMS治疗的试验组,均给予对ADHD具有明确治疗效果的盐酸哌甲酯控释片治疗。该药被验证可以阻断突触前膜上的多巴胺转运体,并促进体内去甲肾上腺素释放,从而起到改善ADHD症状的作用。随着症状的改善,血清BDNF水平也可能随之产生相应变化,使研究结果不能完全排除药物治疗所引起的混杂效应。其次,此次试验真刺激组选取的是10 Hz rTMS刺激右侧前额叶皮质,但目前有研究认为rTMS的疗效与治疗方式间的关系是一个富有探讨价值的领域,所以今后可选取不同的治疗部位及治疗频率从而找到对ADHD疗效最佳的rTMS治疗方案。再次,本研究中为严格控制两组间可比性及尽量减少试验误差,给予所有的ADHD患儿盐酸哌甲酯控释片18 mg/d治疗,并未完全考虑到不同患儿的病情程度以及对药物的反应,未给予患儿个体化的治疗。最后,本研究对ADHD患儿血清BDNF浓度水平监测的时间点较少,仅仅选择了治疗前及治疗4周末两个时间点,未考虑到血清BDNF的浓度水平是否可能随治疗时间变化而发生变化。这与研究时间及规模所限有关。在今后的研究中可增加监测时间点及延长治疗及检测时间,以便更全面的研究。本研究还存在样本量相对不足的缺点,需更大样本或多中心研究对研究的结论做更深层次的补充和验证。

