粉蕉MbACO2基因克隆及其表达分析
唐宇其 颜彦 李美英 胡伟

摘要:【目的】克隆粉蕉1-氨基環丙烷-1-羧酸(ACC)氧化酶(ACO)基因(MbACO2),并进行表达分析,为研究ACO基因家族在香蕉果实发育成熟过程及逆境胁迫过程中的功能作用提供参考依据,也为改良香蕉采后贮藏提供潜在的基因资源。【方法】利用RT-PCR从粉蕉果实克隆MbACO2基因,运用生物信息学软件分析其编码蛋白的理化性质、亲疏水性、保守结构域及二、三级结构。利用农杆菌介导的瞬时转化法进行亚细胞定位,并利用实时荧光定量PCR检测MbACO2基因在果实发育成熟过程及高盐、干旱和低温胁迫处理下的表达情况。【结果】克隆获得的MbACO2基因开放阅读框(ORF)长度为918 bp,编码305个氨基酸残基,其蛋白分子量为34.583 kD,理论等电点(pI)为5.43,属于亲水性蛋白,具有典型的植物ACO蛋白家族的结构特征,含有DIOX_N和2OG-FeⅡ_Oxy 2个保守结构域。MbACO2氨基酸序列与同属的香蕉(Musa acuminata AAA group)ACO氨基酸序列(XP_010908825.1)相似性最高,为98.04%,表明其具有高度的保守性。MbACO2蛋白在细胞核和细胞质中均有表达。随着粉蕉果实发育成熟,MbACO2基因表达量整体呈升高趋势,极显著高于开花后0 d(对照)(P<0.01,下同),尤其是在果实采后6 d,其相对表达量达最高值。高盐、干旱和低温胁迫处理下,MbACO2基因的相对表达量较对照(未胁迫处理)显著(P<0.05)或极显著提高。【结论】MbACO2基因属于ACO基因家族成员,含有该家族的典型结构域,在粉蕉果实发育成熟过程及逆境胁迫的应答中发挥正向调控作用,高盐、干旱和低温胁迫处理均能诱导其上调表达。
关键词: 粉蕉;1-氨基环丙烷-1-羧酸氧化酶(ACO);果实发育;逆境胁迫;表达分析
中图分类号: S668.1 文献标志码: A 文章编号:2095-1191(2021)01-0155-08
Abstract:【Objective】To clone 1-aminocyclopropane-1-carboxylic acid(ACC) oxidase(ACO) gene (MbACO2) from Musa ABB group,cv Pisang Awak,FJ,and analyze its bioinformatics and expression,so as to provide reference for studying the function of ACO gene family in banana fruit ripening and stress process,and to provide potential gene resources for improving banana postharvest storage. 【Method】Gene MbACO2 was cloned from Musa ABB group,cv Pisang Awak,FJ by RT-PCR. The physicochemical properties,hydrophilicity/hydrophobicity,conserved domains and sec-ondary/tertiary structures of the encoded protein were predicted by bioinformatics analysis. Subcellular localization was conducted using Agrobacterium-mediated transient transformation. The expression level of MbACO2 gene in fruit deve-lopment and stress response(high-salt, drought and low temperature) was detected by real-time quantitative PCR. 【Result】The open reading frame(ORF) length of MbACO2 was 918 bp,encoding 305 amino acid residues. The molecular weight of the protein was 34.583 kD and the theoretical isoelectric point(pI) was 5.43. The protein encoded by MbACO2 gene belonged to hydrophilic protein,which had typical plant ACO structural characteristics and contained two conservative domainsDIOX_N and 2OG-FeⅡ_Oxy. The amino acid sequence of MbACO2 was similar to that of ACO amino acid sequence(XP_010908825.1) in banana(Musa acuminata AAA group) and the similarity reached 98.04%,indicating that the amino acid sequence of MbACO2 protein was highly conserved. The subcellular localization results showed that MbACO2 protein was expressed in both nucleus and cytoplasm. The expression of MbACO2 gene increased with the development of fruit ripening, and was extremely higher than 0 d after flowering(control) (P<0.01, the same below). The expression level of MbACO2 was the highest 6 d after harvest. Under high-salt, drought and low temperature,the relative expression of MbACO2 gene was significantly up-regulated(P<0.05) or extremely up-regulated compared with control(no stress treatment). 【Conclusion】MbACO2 gene belongs to ACO gene family, it contains the typical domains of the family, and it playsa positive regulation role in banana fruit ripening and stress resistance of Musa ABB group,cv Pisang Awak,FJ. High-salt, drought and low temperature can induce its upregulation of expression.
Key words:Musa ABB group,cv Pisang Awak,FJ; 1-aminocyclopropane-1-carboxylic acid oxidase(ACO); fruit growth; stress; expression analysis
Foundation item: Hainan Key Research and Development Project(SKJC-2020-02-002)
0 引言
【研究意义】香蕉作为世界四大水果之一,其果实富含碳水化合物和蛋白质,是热带地区及亚热带地区重要的粮食作物和经济作物(Inaba et al.,2007)。香蕉是典型的呼吸跃变型果实,其成熟过程受乙烯的调控,在生产上主要通过乙烯吸收剂来延长香蕉的货架期(施怡婷和杨淑华,2016)。乙烯(Ethylene)作为一种非常重要的气态激素,其介导的信号通路在植物生长发育、果实成熟及胁迫应答等过程中发挥重要作用(贺立红等,2009)。1-氨基环丙烷-1-羧酸(ACC)氧化酶(ACO)作为乙烯生物合成途径的限速酶,能直接催化ACC产生乙烯(Alexander and Grierson,2002;侯曉婉等,2015)。因此,加强ACO基因研究有助于深入探究乙烯生物合成的调控机制及其在胁迫应答中的潜在功能。【前人研究进展】目前,ACO基因已在拟南芥(5个)(Vandenbussche et al.,2003)、玉米(13个)(Gallie and Young,2004)、番茄(7个)(Sell and Hehl,2005)、水稻(9个)(Iwai et al.,2006)、苹果(7个)(Binnie and McManus,2009)、菠萝(朱家红等,2018)等多种植物中被鉴定出来,且进行克隆及表达分析。Andersson-Gunneras等(2003)研究发现,重力刺激使张力木材形成组织中ACO活性急剧增强,进而促进形成杨树应拉木。Shi等(2006)研究发现,乙烯生物合成是棉花纤维伸长过程中最显著上调的生化途径之一,且可通过ACO调控乙烯以促进棉花纤维细胞的伸长。Zhang等(2009)研究发现,乙烯应答因子ERF通过调控ACS和ACO基因在乙烯合成中发挥正向调控作用。Liu等(2015)通过基因沉默(VIGS)方法瞬时沉默ACS2、ACS4和ACO1基因后,ACS和ACO活性显著降低,进而抑制果实成熟。Chen等(2016)研究发现,蛋白磷酸酶基因(WIP1)通过调控ACO基因的表达来控制黄瓜单性花的发育进程。在AAA型同源三倍体香蕉中,MaACS1、MaACO1、MaACO5、MaACO13和MaACO14与果实成熟密切相关,且一系列转录因子如MaHDZI19、MaHDZI126、MaHDZII4、MaHDZII7、MaBZR1、MaBZR2、MaERF9、MaERF11和MaMADS7与MaACS或MaACO基因启动子互作调控其转录及乙烯合成(Xiao et al.,2013;Liu et al.,2015;Han et al.,2016;Guo et al.,2019;Yang et al.,2020)。此外,已有研究表明ACO基因在番茄果实呼吸跃变期具有重要的调控和限速作用(Van de Poel et al.,2012,2014;Grierson et al.,2014)。本课题组前期研究结果(Wang et al.,2019)表明,粉蕉B基因组上的ACO基因在果实成熟过程中发挥重要作用。【本研究切入点】ACO基因在植物的生长发育及果实成熟过程中具有重要调控功能作用,但目前有关香蕉ACO基因,尤其是B基因组上ACO基因克隆及表达分析的研究鲜见报道。【拟解决的关键问题】以粉蕉(Musa ABB group,cv Pisang Awak,FJ)为研究对象,选择B基因组上的ACO基因家族成员MbACO2基因进行生物信息学及表达分析,明确其在粉蕉组织和逆境胁迫中的表达水平,为解析该基因在乙烯信号通路及胁迫应答中的调控功能打下基础。
1 材料与方法
1. 1 试验材料
粉蕉由中国热带农业科学院香蕉品种协会提供。本生烟由中国热带农业科学院热带生物技术研究所提供。多糖多酚植物总RNA提取试剂盒、DNA纯化(回收)试剂盒及质粒小提试剂盒购自天根生化科技(北京)有限公司;2×Rapid Taq MasterMix、反转录试剂盒HiScript III 1st Strand cDNA Synthesis Kit(+gDNA wi-per)和荧光定量试剂盒ChamQ Universal SYBR qPCR MasterMix购自南京诺唯赞生物科技股份有限公司;大肠杆菌TOP10感受态细胞和农杆菌GV3101(psoup-p19)感受态细胞购自上海唯地生物技术有限公司;亚细胞定位载体pNC-Green-SubC和连接酶试剂盒Nimble Cloning购自海南壹田生物科技有限公司;氯化钠购自西陇科学股份有限公司;甘露醇购自广州化学试剂公司。主要仪器设备:CT15RT高速冷冻离心机[天美(中国)科学仪器有限公司]、EPS300电泳仪(上海天能科技有限公司)、4100凝胶成像仪(上海天能科技有限公司)、NanoDropTM One/OneC超微量紫外分光光度计(Thermo,美国)、PCR仪(Analytikjena,德国)、FluoView FV1000激光共聚焦显微镜(Olympus,日本)和MX3000荧光定量PCR仪(Agilent,美国)。
1. 2 样品采集及胁迫处理
选择发育状况良好、无病虫害的植株,分别取开花后0、20和80 d的果实及采后3和6 d的成熟果实,切片取样,经液氮处理后置于-80 ℃冰箱保存备用。选择大小均一,生长良好,无病虫害且仅带有5片叶的粉蕉幼苗进行高盐(300 mmol/L氯化钠)、干旱(200 mmol/L甘露醇)和低温(4 ℃ 22 h)胁迫处理,置于温室[培养条件:28 ℃,200 ?mol/(m2·s)光强、16 h光照/8 h黑暗、相对湿度70%]培养7 d。取不同处理叶片经液氮冷冻后置于-80 ℃冰箱保存备用。
1. 3 RNA提取及cDNA合成
将不同时期及不同处理的粉蕉样品,按照多糖多酚植物总RNA提取试剂盒说明提取其总RNA。利用超微量紫外分光光度计分别测定RNA浓度,然后按照反转录试剂盒HiScript III 1st Strand cDNA Synthesis Kit说明反转录合成cDNA。
1. 4 基因克隆及载体构建
根据香蕉基因组数据库Banana Genome Database(http://musagd.biocloud.net/home)中的MbACO2基因序列(>Mb_03_t02600.1),设计其特异性扩增引物(pNC-MbACO2F和pNC-MbACO2R)(表1),以粉蕉果实cDNA为模板进行PCR扩增。反应体系25.0 μL:2×Rapid Taq MasterMix 12.5 μL,cDNA模板1.0 μL,上、下游引物各1.0 μL,ddH2O补足至25.0 μL。扩增程序:95 ℃预变性3 min;95 ℃ 15 s,56 ℃ 15 s,72 ℃ 6 s,进行25个循环;72 ℃延伸5 min。PCR产物用1%琼脂糖凝胶电泳检测后进行切胶回收,并利用Nimble Cloning试剂盒与目的载体pNC-Green-SubC連接,转化大肠杆菌TOP10感受态细胞。挑取阳性单克隆送至生工生物工程(上海)股份有限公司进行测序,将测序正确的单克隆菌液保存并提取其质粒,转化农杆菌GV3101(psoup-p19),保存备用。
1. 5 生物信息学分析
通过NCBI数据库BLASTx对MbACO2基因进行开放阅读框(ORF)预测及同源序列搜索;利用DNAMAN 6.0进行氨基酸序列比对及同源性分析;利用ExPASy预测MbACO2蛋白的理化性质;采用NCBI数据库CDD进行保守结构域预测分析;运用PRABI和SWISS-MODEL预测MbACO2蛋白的二、三级结构;并以MEGA 5.0中的邻接法(Neighbor-joining,NJ)构建系统发育进化树。
1. 6 亚细胞定位
将MbACO2基因编码区(CDS)序列与携带有绿色荧光蛋白(GFP)基因的pNC-Green-SubC表达载体连接,构建pNC-Green-SubC-MbACO2瞬时表达载体,通过农杆菌GV3101(psoup-p19)介导瞬时侵染本生烟草叶片,25 ℃培养3 d后,通过激光共聚焦显微镜观察是否存在GFP信号。
1. 7 基因表达分析
分别设计MbACO2基因编码区(CDS)序列的定量PCR引物(qRT-MbACO2F和qRT-MbACO2R)(表1) 。以粉蕉不同发育成熟阶段的果实及高盐、干旱和低温胁迫处理下的叶片cDNA为模板、Maactin为内参基因,通过实时荧光定量PCR对MbACO2基因的表达量进行检测。反应体系20.0 μL:SYBR qPCR MasterMix 10.0 μL,上、下游引物各1.0 μL,cDNA模板1.0 μL,ddH2O补足至20.0 μL。扩增程序:95 ℃预变性30 s;95 ℃ 10 s,60 ℃ 30 s,进行40个循环。每样品技术重复均为3次。采用2-△△Ct法计算相对表达量。
1. 8 统计分析
试验数据采用Excel 2016进行整理及单因素方差分析(One-way ANOVA)。
2 结果与分析
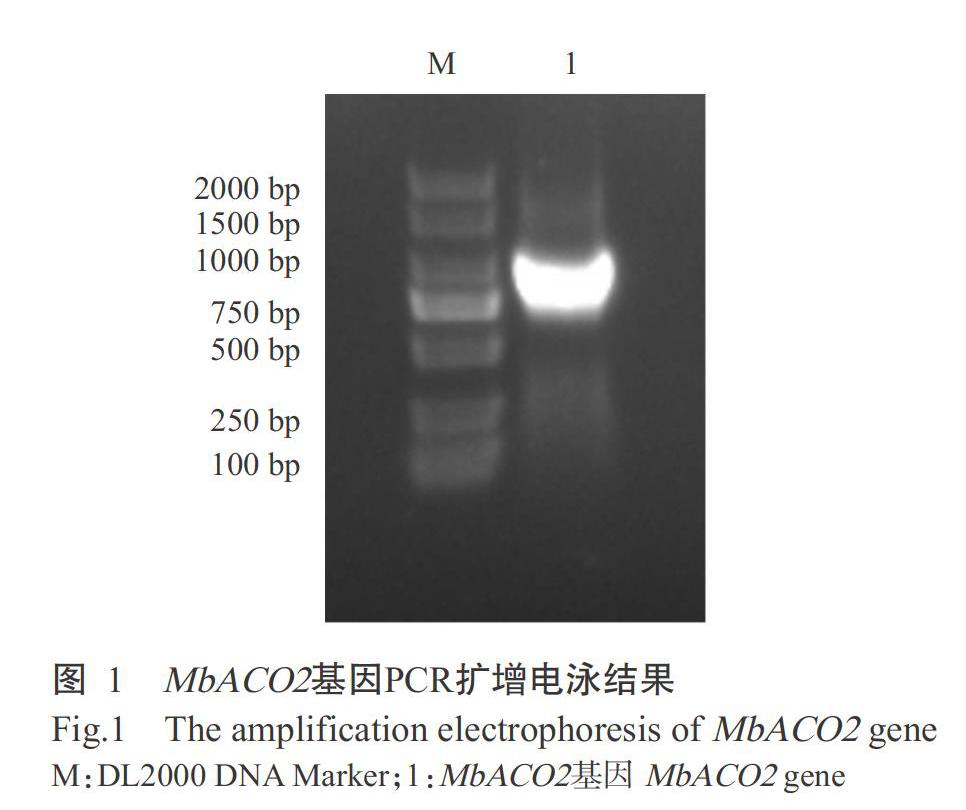
2. 1 MbACO2基因PCR扩增结果
以粉蕉果实cDNA为模板、pNC-MbACO2F和pNC-MbACO2R为引物进行特异性扩增,获得大小约900 bp的特异条带(图1)。测序结果显示,该条带长918 bp,编码305个氨基酸残基,经序列比对鉴定为目的基因MbACO2。
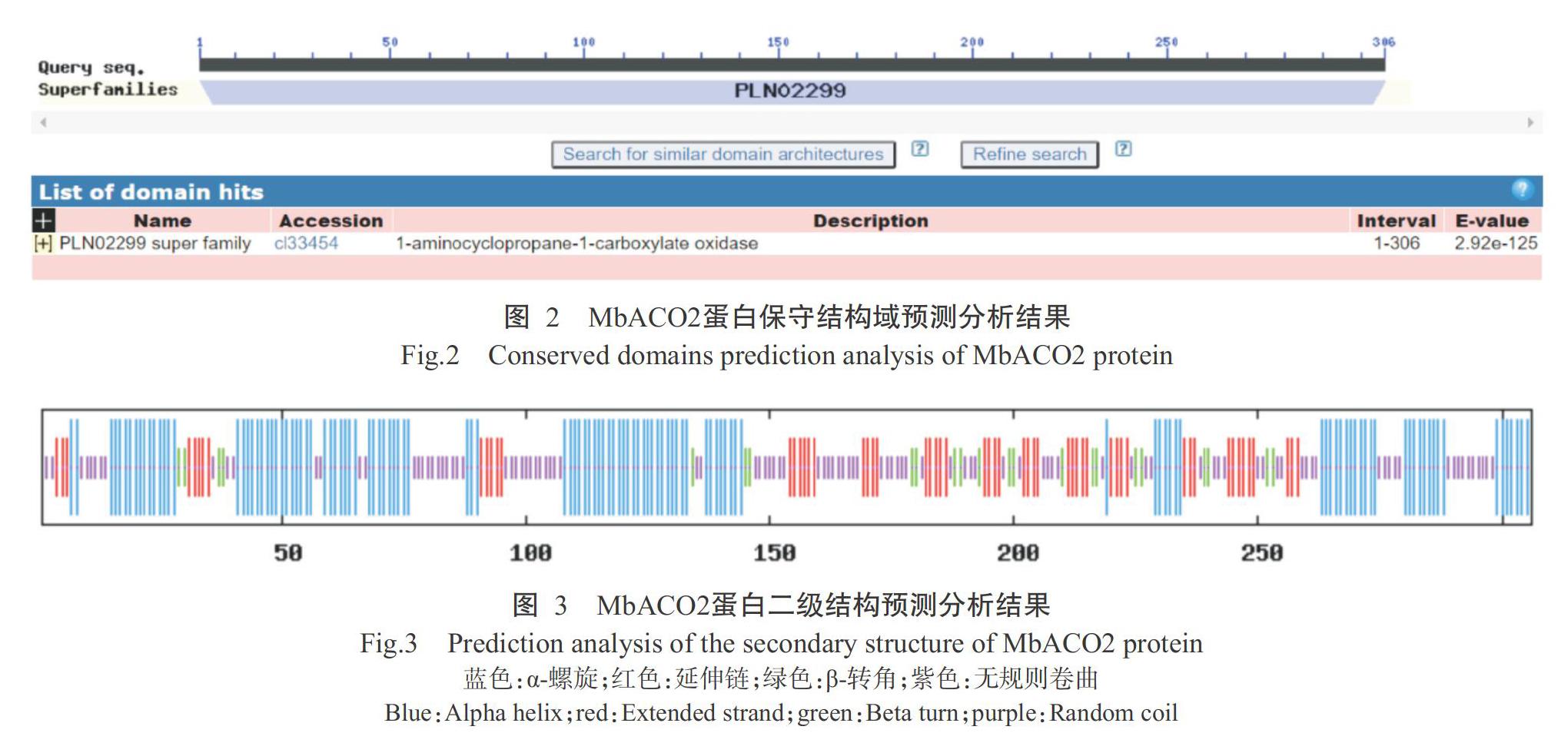
2. 2 MbACO2蛋白理化性质及结构预测分析结果
MbACO2蛋白的原子总数为4839个,化学分子式 C1548H2404N418O456S13,分子量34.583 kD,理论等电点(pI)5.43,蛋白脂肪系数77.12。鉴于不稳定系数值为32.62,亲水性平均值(GRAVY)为-0.475,推测MbACO2属于稳定的亲水性蛋白。利用NCBI数据库中的CDD预测MbACO2蛋白保守结构域(图2),结果发现其含保守结构域PLN02299,故推测MbACO2属于ACO家族成员。MbACO2蛋白二级结构预测结果(图3)显示,α-螺旋120个,占39.22%;延伸链58个,占18.95%;β-转角23个,占7.52%,无规则卷曲105个,占34.31%。利用SWISS-MODEL预测Mb-ACO2蛋白三级结构,其结果(图4)与二级结构预测结果相符。
2. 3 MbACO2氨基酸序列同源比对及系统发育进化树分析结果
利用NCBI数据库中的BLASTp搜索MbACO2蛋白的同源氨基酸序列,结果显示MbACO2氨基酸序列与多个物种的ACO氨基酸序列相似性均较高,包括香蕉(M. acuminata AAA group) AAG43057.1、海枣(Phoenix dactylifera) XP_008799050.1、油棕(Elaeis guineensis) XP_010908825.1、芦笋(Asparagus officinalis)XP_020246901.1、南瓜(Cucurbita mo-schata)XP_022936989.1、黄瓜(Cucumis sativus)XP_004142637.1、菠萝(Ananas comosus) XP_02010670 6.1、橡胶树(Hevea brasiliensis) XP_021636599.1、黍(Panicum hallii) XP_025807219.1、小米(Setaria ita-lic) XP_004960278.1、稗子(Echinochloa crus-galli) AKA60095.1、苦瓜(Momordica charantia)XP_0221 34061.1、高粱(Sorghum bicolor)XP_002439286.1和野燕麦(Avena fatua) QCG69018.1,其ACD氨基酸序列相似性分别为98.04%、82.90%、81.99%、74.35%、73.79%、73.79%、73.55%、73.46%、73.14%、72.67%、72.17%、71.52%、71.02%和70.55%。利用ClustalX进行多序列比对分析,结果发现MbACO2具有典型的植物ACO家族特征结构域(朱家红等,2018),即 DIOX_N(黑色划线处)和2OG-FeⅡ_Oxy(绿色划线处)2个保守结构域(图5)。
基于ACO氨基酸序列相似性构建的系统发育进化树(图6)显示,MbACO2蛋白和香蕉、油棕和海枣ACO蛋白聚在同一分支上,亲缘关系较近,与黍、小米和稗子亲缘关系相对较遠。
2. 4 MbACO2蛋白的亚细胞定位分析结果
利用农杆菌介导的瞬时转化法将pNC-Green-SubC-MbACO2转化至烟草叶片中进行表达,结果(图7)显示,烟草叶片细胞质和细胞核均显示出荧光信号,说明MbACO2蛋白可能在粉蕉的细胞质和细胞核中均有表达。
2. 5 MbACO2基因表达分析结果
利用实时荧光定量PCR检测MbACO2基因在粉蕉果实发育阶段及高盐、干旱、低温胁迫下的表达情况。由图8可知,随着粉蕉果实发育成熟,MbACO2基因表达量整体上呈逐渐升高趋势,均极显著高于开花后0 d(对照)(P<0.01,下同),尤其是在果实采后6 d,其相对表达量达最高值,是对照的1000多倍。由图9可知,在高盐、干旱和冷胁迫处理下,MbACO2基因的相对表达量较对照(未胁迫处理)显著(P<0.05)或极显著提高,说明这3种胁迫处理能诱导该基因上调表达,推测MbACO2基因在粉蕉果实发育成熟过程及逆境胁迫的应答中发挥重要作用。
3 讨论
香蕉是典型的呼吸跃变型果实,其果实发育和成熟决定果实品质(Xu et al.,2007),因此研究粉蕉果实发育成熟的分子机理对延长其货架期非常重要。粉蕉在广东、广西和海南已有广泛种植(游伐,2019),其中ABB基因型植株特点是果实成熟快,较普通的巴西蕉(AAA group)提前约10 d(Wang et al.,2019)。ACO是乙烯形成过程中的关键酶,其对于果实成熟具有重要贡献(Houben and Van de poel,2019)。且本课题组前期研究发现,粉蕉B基因组上的ACO基因在果实成熟过程中发挥重要调控作用(Wang et al.,2019)。由于目前针对于粉蕉成熟机理的研究报道较少,因此本研究选择粉蕉中B基因组上的ACO基因家族成员MbACO2作为研究对象,经蛋白结构预测、序列比对及系统发育进化树分析等发现,MbACO2基因的CDS序列长度为918 bp,编码305个氨基酸残基,含有ACO蛋白家族的2个保守结构域DIOX_N和2OG-FeⅡ_Oxy,且与香蕉、海枣和油棕的氨基酸序列相似性均在80.00%以上,该蛋白定位于细胞质和细胞核,与Tatsuki等(2006)报道的红花CtACO1定位结果一致。
香蕉是对逆境胁迫非常敏感的作物,低温、干旱和高盐胁迫均会造成其减产和品质降低(孙雪丽等,2019),因此研究香蕉对逆境胁迫的应答机理十分重要。随着粉蕉果实发育成熟,MbACO2基因的表达量整体上呈升高趋势,与Liu等 (2015)研究巴西蕉中MaMADS7基因的表达趋势一致,进一步证实不同物种中ACO基因在果实发育成熟过程中发挥一定的调控作用。且低温、高盐和干旱均会显著或极显著提高MbACO2基因的相对表达量,与前人针对桃(Tatsuki et al.,2006)、马铃薯(Kim et al.,2008)及番茄(Mei et al.,2009)等物种的ACO基因研究结果一致,表明不同物种的ACO基因均可对逆境产生应答反应。这也与前人研究发现乙烯可提高植物对逆境抵抗能力的结论相符(Yang et al.,2020)。
本研究克隆获得的MbACO2基因在果实发育成熟过程中高度表达,且经高盐、干旱和低温胁迫后呈高效表达,故推测其在果实发育成熟和逆境胁迫响应中发挥重要作用。在今后的研究中,可通过诱导或沉默MbACO2基因在果实中的表达,进一步深入解析其在果实发育成熟及响应逆境胁迫中的功能。
4 结论
MbACO2基因是ACO基因家族成员,含有该家族的典型结构域,在粉蕉果实成熟及逆境胁迫的应答中发挥正向调控作用,高盐、干旱和低温胁迫处理均能诱导其上调表达。
参考文献:
贺立红,陈建业,于伟民,王勇,陆旺金. 2009. 香蕉果实乙烯受体基因克隆及其表达特性[J]. 中国农业科学,42(4):1359-1364. [He L H,Chen J Y,Yu W M,Wang Y,Lu W J. 2009. Cloning and expression analysis of ethylene receptor in harvested banana fruit[J]. Scientia Agricultura Sinica,42(4):1359-1364.]
侯晓婉,胡伟,颜彦,徐碧玉,金志强. 2015. 香蕉MaPIP2-2基因的克隆、亚细胞定位及表达分析[J]. 热带作物学报,36(7):1267-1273. [Hou X W,Hu W,Yan Y,Xu B Y,Jin Z Q. 2015. Cloning,subcellular localization and expression analysis of MaPIP2-2 gene in banana[J]. Chinese Journal of Tropical Crops,36(7):1267-1273.]
施怡婷,杨淑华. 2016. 中国科学家在乙烯信号转导领域取得突破性进展[J]. 植物学报,51(3):287-289. [Shi Y T,Yang S H. 2016. Chinese scientists made breakthrough in study on ethylene signaling transduction in plants[J]. Chinese Bulletin of Botany,51(3):287-289. ]
孙雪丽,刘范,Bodjrenou Mahoudjro David,项蕾蕾,程春振. 2019. 香蕉MaMPK1基因的克隆与表达模式[J]. 应用与环境生物学报,25(4):985-992. [Sun X L,Liu F,Bodjrenou M D,Xiang L L,Cheng C Z. 2019. Cloning and expre-ssion pattern analysis of the banana MaMPK1 gene[J]. Chinese Journal of Applied and Environmental Bio-logy,25(4):985-992.]
游伐. 2019. 粉蕉优良品种两款[J]. 农村新技术,(12):40-41. [You F. 2019. Two kinds of fine plantain[J]. New Rural Technology,(12):40-41.]
朱家紅,李超燕,范鸿雁,胡福初,罗志文,张治礼. 2018. 菠萝ACC氧化酶基因AcACO1的克隆与表达分析[J]. 基因组学与应用生物学,37(1):339-344. [Zhu J H,Li C Y,Fan H Y,Hu F C,Luo Z W,Zhang Z L. 2018. Cloning and expression analysis of ACC oxidase gene AcACO1 in pineapple(Ananas comosus L. Merr.)[J]. Genomics and Applied Biology,37(1):339-344.]
Alexander L,Grierson D. 2002. Ethylene biosynthesis and action in tomato:A model for climacteric fruit ripening[J]. Journal of Experimental Botany,53(377):2039-2055.
Andersson-Gunneras S,Hellgren J M,Bjorklund S,Regan S,Moritz T,Sundberg B. 2003. Asymmetric expression of a poplar ACC oxidase controls ethylene production during gravitational induction of tension wood[J]. Plant,34(3):339-349.
Binnie J E,McManus M T. 2009. Characterization of the 1-aminocyclopropane-1-carboxylic acid (ACC) oxidase mu-ltigene family of Malus domestica borkh[J]. Phytochemi-stry,70(3):348-360.
Chen H M,Sun J J,Li S,Cui Q Z,Zhang H M,Xin F J. 2016. An ACC oxidase gene essential for cucumber carpel development[J]. Molecular Plant,9(9):1315-1327.
Gallie D R,Young T E. 2004. The ethylene biosynthetic and perception machinery is differentially expressed during endosperm and embryo development in maize[J]. Molecu-lar Genetics and Genomics,271(3):267-281.
Grierson D,Nath P,Bouzayen M,Mattoo A K,Pech J C. 2014. Mattoo A, Nath P, Bouzayen M, Pech J C. Ethy-lene biosynthesis[M]//Fruit ripening:Physiology,signalling and genomics[J]. Oxfordshire:Center for Agriculture and Biology International:178-192.
Guo Y F,Shan W,Liang S M,Wu C J,Wei W,Chen J Y,Lu W J,Kuang J F. 2019. MaBZR1/2 act as transcriptional repressors of ethylene biosynthetic genes in banana fruit[J]. Physiologia Plantarum,165(3):555-568.
Han Y C,Kuang J F,Chen J Y,Liu X C,Xiao Y Y,Fu C C,Wang J N,Wu K Q,Lu W J. 2016. Banana transcription factor MaERF11 recruits histone deacetylase MaHDA1 and represses the expression of MaACO1 and expansins during fruit ripening[J]. Plant Physiology,171(2):1070-1084.
Houben M,Van de Poel B. 2019. 1-aminocyclopropane-1-carboxylic acid oxidase(ACO):The enzyme that makes the plant hormone ethylene[J]. Frontiers in Plant Science,10:695.
Inaba A,Liu X,Yokotani N,Yamane M,Lu W J,Nakano R,Kubo Y. 2007. Differential feedback regulation of ethy-lene biosynthesis in pulp and peel tissues of banana fruit[J]. Journal of Experimental Botany,58(5):1047-1057.
Iwai T,Miyasaka A,Seo S,Ohashi Y. 2006. Contribution of ethylene biosynthesis for resistance to blast fungus infection in young rice plants[J]. Plant Physiology,142(3):1202–1215.
Kim Y S,Kim H S,Lee Y H. 2008. Elevated H2O2 production via overexpression of a chloroplastic Cu/ZnSOD gene of lily(Lilium o-riental hybrid ‘Marco Polo) triggers ethy-lene synthesis in transgenic potato[J]. Plant Cell Reports,27(6):973-983.
Liu J H,Liu L,Li Y,Jia C,Zhang J,Miao H X,Hu W,Wang Z,Xu B Y,Jin Z. 2015. Role for the banana AGAMOUS-like gene MaMADS7 in regulation of fruit ripening and quality[J]. Physiologia Plantarum,155(3):217-231.
Mei Z,Bing Y,Ping L. 2009. The role of ABA in triggering ethylene biosynthesis and ripening of tomato fruit[J]. Journal of Experimental Botany,60(6):1579-1588.
Sell S,Hehl R. 2005. A fifth member of the tomato 1-aminocyclopropane1-carboxylic acid(ACC) oxidase gene family harbours a leucine zipper and is anaerobically induced[J]. DNA Sequence:The Journal of DNA Sequencing and Mapping,16(1):80-82.
Shi Y H,Zhu S W,Mao X Z,Feng J X,Qin Y M,Zhang L. 2006. Transcriptome profiling molecular biological,and physiological studies reveal a major role for ethylene in cotton fiber cell elongation[J]. The Plant Cell,18(3):651-664.
Tatsuki M,Haji T,Yamaguchi M. 2006. The involvement of 1-aminocyclopropane-1-carboxylic acid synthase isogene Pp-ACS1,in peach fruit softening[J]. Journal of Experimental Botany,57(6):1281-1289.
Van de Poel B,Bulens I,Hertog M L A T M,Nicolai B M,Geeraerd A H. 2014. A transcriptomics-based kinetic model for ethylene biosynthesis in tomato(Solanum lycopersicum) fruit:Development,validation and exploration of novel regulatory mechanisms[J]. The New Phytologist,202(3):952-963.
Van de Poel B,Bulens I,Markoula A,Hertog M L A T M,Dreesen R,Wirtz M. 2012. Targeted systems biology profiling of tomato fruit reveals coordination of the Yang cycle and a distinct regulation of ethylene biosynthesis du-ring postclimacteric ripening[J]. Plant Physiology,160(3):1498-1514.
Vandenbussche F,Vriezen W H,Smalle J,Laarhoven L J J,Harren F J M,van der Straeten D. 2003. Ethylene and auxin control the Arabidopsis response to decreased light intensity[J]. Plant Physiology,133(2):517-527.
Wang Z,Miao H X,Liu J H,Xu B Y,Yao X M,Xu C Y,Zhao S C,Fang X D,Jia C H,Wang J Y,Zhang J B,Li J Y,Xu Y,Wang J S,Ma W H,Wu Z Y,Yu L L,Yang Y L,Liu C,Guo Y,Sun S L,Baurens F C,Guillaume M,Frederic S,Olivier G,Nabila Y,Catherine H,Mathieu R,Nathalie L,Remy H,Sebastien R,Ming P,Anping G,Xie J H,LiY,Ding Z H,Yan Y,Tie W W,Angélique D,Hu W,Jin Z Q. 2019. Musa balbisiana genome reveals subgenome evolution and functional divergence[J]. Nature Plants,5(8):810-821.
Xiao Y Y,Chen J Y,Kuang J F,Shan W,Xie H,Jiang Y M,Lu W J. 2013. Banana ethylene response factors are involved in fruit ripening through their interactions with ethylene biosynthesis genes[J]. Journal of Experimental Botany,64(8):2499-2510.
Xu B Y,Su W,Liu J H,Wang J B,Jin Z Q. 2007. Differentially expressed cDNAs at the early stage of banana ripe-ning identified by suppression subtractive hybridization and cDNA microarray[J]. Planta,226(2):529-539.
Yang Y Y,Shan W,Kuang J F,Chen J Y,Lu W J. 2020. Four HD-ZIPs are involved in banana fruit ripening by activating the transcription of ethylene biosynthetic and cell wall-modifying genes[J]. Plant Cell Reports,9(3):351-362.
Zhang Z J,Zhang H W,Quan R D,Wang X C,Huang R. 2009. Transcriptional regulation of the ethylene response factor LeERF2 in the expression of ethylene biosynthesis genes controls ethylene production in tomato and tobacco[J]. Plant Physiology,150(1):365-377.
(責任编辑 陈 燕)

