黄白双花口服液治疗犊牛腹泻的系统药理学分析
董书伟 樊灵芝 李磊 王海峰 朱海鲸 翟军军 屈雷 王胜义

董书伟(1980-),博士,副教授,主要从事牛羊疾病防治及中兽药研究工作,曾赴德国、爱尔兰、匈牙利和肯尼亚等国家开展牛病科研合作学术交流活动。先后主持国家自然科学基金项目、甘肃省科技计划项目及榆林市科技计划项目等科研项目4项;作为主要完成人参与国家级或省部级科研项目8项。以第一作者或通讯作者在《BMC Veterinary Research》《中国农业科学》《畜牧兽医学报》《南方农业学报》等国内外核心期刊上发表学术论文20篇,参编出版著作2部,申请国家专利20项,成功研制出国家三类新兽药3个;获农业农村部农牧渔业丰收奖二等奖1项、甘肃省科技进步奖三等奖1项;被中国畜牧兽医学会评为2015年度优秀牛病科研工作者。
摘要:【目的】利用系统药理学构建黄白双花口服液治疗犊牛腹泻的活性化合物—靶点—通路—疾病相关蛋白的关系网络模型,阐述黄白双花口服液治疗犊牛腹泻的分子机制,为犊牛腹泻防治药物研发提供理论依据。【方法】根据口服利用度(OB)≥30%和类药性(DL)≥0.18,利用中药系统药理学数据库(TCMSP)检索黄白双花口服液中每味中药(黄连、白头翁、金银花、黄芩、地榆和乌梅)的活性化合物及与其相对应的作用靶点,导入Cytoscape绘图软件中建立活性化合物与其对应靶点的互作网络图;通过基因数据库(Gene Cards)检索犊牛腹泻的有关靶点基因,使用维恩图求取二者的交集,得到犊牛腹泻与黄白双花口服液共同的靶点基因组合,然后导入String数据库中以获得相关蛋白相互作用网络图;将黄白双花口服液作用于犊牛腹泻的靶点基因导入DAVID数据库中,分别进行GO功能富集分析和KEGG通路富集分析。【结果】从黄白双花口服液中筛选出43种活性化合物,分別对应131个相关靶点基因。黄白双花口服液与犊牛腹泻交集的蛋白质—蛋白质相互作用网络图包括128个节点及205条相互关系,其中丝氨酸/苏氨酸蛋白激酶1(AKT1)、白介素2(IL-2)、白介素6(IL-6)、白介素8(IL-8)、促分裂素原活化蛋白激酶1(MAPK1)及含半胱氨酸的天冬氨酸蛋白酶3(CASP3)的出现频率较高。利用DAVID数据库对黄白双花口服液与犊牛腹泻交集靶点的蛋白进行GO功能富集分析,最终富集到204条GO功能条目(FDR<10-2),其中细胞组成条目8条、分子功能条目12条、生物过程条目184条;黄白双花口服液治疗犊牛腹泻的相关蛋白主要富集于19条信号通路上(FDR<10-2)。【结论】黄白双花口服液主要以黄连、白头翁、金银花、黄芩、地榆和乌梅中的槲皮素、β-谷甾醇、豆甾醇及山奈酚等活性化合物成分,通过ATK1、MAPK1、IL-2、IL-6和IL-8等靶点,经Toll样受体信号通路、NOD样受体信号通路、T细胞受体信号通路和B细胞受体信号通路等,发挥抗菌消炎、抑制细胞损伤及调节免疫力等作用,以达到治疗犊牛腹泻的目的。
关键词: 黄白双花口服液;系统药理学;犊牛腹泻;活性化合物;靶点;信号通路
中图分类号: S858.23 文献标志码: A 文章编号:2095-1191(2021)01-0001-10
Abstract:【Objective】Based on systematic pharmacology, a network of active compound, target, pathway and di-sease-related protein of Huangbaishuanghua oral liquid was established to elucidate the molecular mechanism of treatingdiarrhea in calves, and to provide the theoretical basis for research and development of drugs for the prevention and treatment of diarrhea in calves. 【Method】According to oral utilization(OB)≥30% and drug-likeness(DL)≥0.18, using traditional Chinese medicine pharmacology (TCMSP) database retrieval and double liquid medium every taste traditional Chinese medicine(Coptidis Rhizoma,Pulsatilliae Radix,Lonicerae Japonicae Flos,Scutellariae Radix,Radix Sanguisorbae and Mume Fructus) of the active compounds and corresponding targets, imported into Cytoscape drawing software to establish active compounds and their corresponding targets interactions network diagram. The target genes of calf diarrhea were retrieved through Gene Cards database, and the intersection of the two was obtained by Venn diagram. The target gene combination of calf diarrhea and Huangbaishuanghua oral liquid was obtained, and then imported into the String database to obtain the network diagram of the interaction of related proteins. The target genes of Huangbaishuanghua oral liquid on diarrhea of calves were imported into DAVID database for GO function enrichment analysis and KEGG pathway enrichment analysis, respectively. 【Result】Forty-three active compounds were screened from Huangbaishuanghua oral Liquid, corresponding to 131 related target genes, respectively.Huangbai Shuanghua Oral Liquid and calf diarrhea intersection protein-protein intera-ction network diagram includded 128 nodes and 205 relationship, among them, serine/threonine protein kinase 1(AKT1), interleukin 2(IL-2) and interleukin 6(IL-6) and interleukin 8(IL-8), promote the mitogen activated protein kinase 1 (MAPK1) and aspartic acid with cysteine proteinase 3(CASP3) had high occurrence frequency. The GO function enrichment analysis of the proteins at the intersection target of Huangbaishuanghua oral liquid and diarrhea of calfs was conducted using DAVID database. Finally, 204 GO functional items(FDR<10-2) were enriched, including 8 cell composition items, 12 molecular function items and 184 biological process items. The related proteins of Huangbaishuanghua oral liquid in the treatment of diarrhea in calves were mainly enriched in 19 signaling pathways(FDR<10-2). 【Conclusion】Huangbaishuanghua oral liquid mainly use quercetin, β-phytosterol, stigstanol and kaempferol from Coptidis Rhizoma,Pulsatilliae Radix,Lonicerae Japonicae Flos,Scutellariae Radix,Radix Sanguisorbae and Mume Fructus. Through ATK1, MAPK1, IL-2, IL-6 and IL-8 and other targets, it can play antibacterial and anti-inflammatory roles, inhibit cell damage and regulate immunity through Toll-like receptor signaling pathway, NOD receptor signaling pathway, T cell receptor signaling pathway and B cell receptor signaling pathway, to achieve the purpose of treating calf diarrhea.
Key words: Huangbaishuanghua oral liquid; systematic pharmacology; calf diarrhea; active compound; target; signal pathway
Foundation item: Youth Fund Project of Natural Science Foundation of China(31502113); Yulin University High Level Talents Research Project (18GK10)
0 引言
【研究意义】犊牛腹泻是由病原微生物感染、消化不良及饲养管理不当等多种复杂因素引发的一种常见疾病(Lee et al.,2019),其主要临床表现为排稀薄或水样粪便,呈黄色或白色,有恶臭,甚至含有黏膜或便血等(武瑞萍,2017),且传染性强(杨保军,2010),通常发病率高达68.6%、死亡率为8.89%(田密,2019),给养殖户带来巨大经济损失。因此,研究犊牛腹泻防治技术对保障养牛业持续健康发展具有重要意义。【前人研究进展】引起犊牛腹泻的主要病原有轮状病毒(Rotavirus)、牛诺如病毒(Bovine norovirus)、大肠杆菌(Escherichia coli)、隐孢子虫(Cryptosporidium)和篮氏贾第鞭毛虫(Giardia lamblia)(Chae et al.,2019;师志海等,2020),其中又以隐孢子虫感染最严重(Riggs and Schaefer,2020)。目前,抗生素仍是临床兽医治疗动物疾病的常用药物(Kr?mker and Leimbach,2017),但长期使用抗生素极易导致耐药菌株的出现及动物体内抗生素残留(Gudiol,2010),进而危及动物和人类的健康。中药不仅具备抗菌消炎及调控机体自身免疫等作用,还具有疗效好、低毒、低残留、环保和不易产生耐药性等优点(王文晓等,2020)。焦桂兰等(2001)将川黄连、紫花地丁、灶心土、白术、藕节、泽夕和茯苓配成方剂,研成细末后用温水冲服,在36例犊牛腹泻中的治愈率达97.2%。江伟等(2010)选用成药白頭翁散及白头翁、黄连、秦皮、板蓝根、蒲公英、石榴皮和诃子等7味中药提取物进行药敏试验,结果显示白头翁散的抑菌效果明显,是治疗犊牛腹泻稳定性较高的药剂。李继昌等(2011)采用乌梅、黄梅和白术等中药制备而成的乌连颗粒剂治疗细菌性犊牛腹泻,结果显示其治愈率为88.46%,具有良好的治疗效果。伦艳霞等(2013)将金银花、黄芩、连翘、乌梅和白术等9味中药组成复方治疗犊牛腹泻,结果表明该中药复方制剂对犊牛腹泻的疗效要优于西药乙酰甲喹。根据中兽医基础理论和辨证施治原则,可将犊牛腹泻分为热痢和寒痢。针对热痢,以白头翁和黄连为君药、金银花和黄芩为臣药、乌梅和地榆为佐药、葛根为使药,诸药合用,能达到清热燥湿、凉血止痢、涩肠止泻及健脾和胃的功效,制备成口服液,临床治疗犊牛腹泻的治愈率达83.6%,有效率为96.4%(董书伟等,2010)。经药效学研究证实,该中药制剂具有抗炎、镇痛、止泻和调节免疫等作用(王胜义等,2011);经毒理学研究发现,该中药制剂为实际无毒,且对其主要有效活性成分进行定性和定量分析,制定质量标准及筛选出最佳制备工艺(王胜义,2010),最终成功研制出防治犊牛腹泻的纯中药制剂——黄白双花口服液,并荣获国家三类新兽药证书(中华人民共和国农业部公告 第1959号)。黄白双花口服液的临床应用效果显著,市场反应良好,但发挥作用的分子机理尚不清楚,进而影响其推广应用。【本研究切入点】系统药理学是综合系统生物学与中药药理学的新方法和新理论(Yu et al.,2017;王艳艳等,2019),通过生物信息学分析中药有效成分与药物靶点和疾病靶点间的关系,并建立相互作用的网络图,以阐明中药在疾病治疗过程中发挥作用的分子机制。系统药理学具有整体性、系统性的特点,与中医药辨证论治的整体思想不谋而合,能在诠释中药活性化合物和作用靶点、阐明作用机制、预测新的并发症、发现中药组效关系及寻找新药等方面发挥重要作用(Zhang et al.,2013;赵雨靓等,2020)。因此,通过系统药理学分析可阐明黄白双花口服液治疗犊牛腹泻的作用机制。【拟解决的关键问题】以黄白双花口服液和犊牛腹泻为研究对象,利用系统药理学构建黄白双花口服液治疗犊牛腹泻的活性化合物—靶点—通路—疾病相关蛋白的关系网络模型,进一步阐述其发挥作用的分子机制,也为犊牛腹泻防治新药的研发提供理论依据。
1 材料与方法
1. 1 试验材料
黄白双花口服液主要原料包括黄连、白头翁、金银花、黄芩、地榆和乌梅等,在兰州黄河中药材市场购买原材料后,按一定比例混合,加水浸泡,煎熬3次后浓缩至每毫升含1 g原材料,然后灌入备好的安瓿瓶中,每瓶100 mL,置于阴凉处封存备用,并根据质量标准进行检测(王胜义,2010)。
1. 2 所用数据库
利用在线数据库及相关软件进行系统药理学分析,主要包括系统药理学数据库(http://tcmspw.com,TCMSP)、Uniprot数据库、DAVID数据库、京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)通路数据库、蛋白质互作网络数据库(String)、基因数据库(Gene Cards)、中国知网(CNKI)、万方数据库(Wanfang Data)及Cytoscape绘图软件。
1. 3 复方中药活性化合物—靶点网络图构建
利用TCMSP数据库检索黄白双花口服液中每味中药(黄连、白头翁、金银花、黄芩、地榆和乌梅)的所有活性化合物,并筛选出与活性化合物相对应的靶点,参数设置为口服利用度(OB)≥30%和类药性(DL)≥0.18。将符合条件的每味中药活性化合物及其所对应靶点下载后,导入Cytoscape绘图软件,建立活性化合物与对应靶点的互作网络图。OB是药物筛选非常重要的要素,活性化合物的OB越高,说明其越具有进一步治疗疾病的可能性(黄超,2015);DL是判断成药可能性的重要依据(Vinotha and Sundar,2019)。
1. 4 蛋白质—蛋白质相互作用网络图构建
将上述筛选到的药物靶点上传至Uniport数据库,物种选择为Bos Taurus,得到中药活性化合物作用于犊牛体内的所有靶点,并利用Gene Cards数据库检索犊牛腹泻的有关靶点基因。将Uniport数据库检索得到的黄白双花口服液相关活性化合物靶点与Gene Cards数据库检索得到的犊牛腹泻相关基因,使用维恩图求取二者的交集,以获得犊牛腹泻与黄白双花口服液共同的靶点基因集。将得到的相关靶点基因导入String软件,物种选择为Bos Taurus,即得到黄白双花口服液治疗犊牛腹泻相关蛋白的相互作用网络图。
1. 5 靶点基因GO功能富集及KEGG通路富集分析
将黄白双花口服液作用于犊牛腹泻的靶点基因导入DAVID数据库中,物种选择为Bos Taurus,分别进行GO功能富集和KEGG通路富集分析,筛选结果后导出(FDR<10-2)。
2 结果与分析
2. 1 复方中药活性化合物—靶点网络图
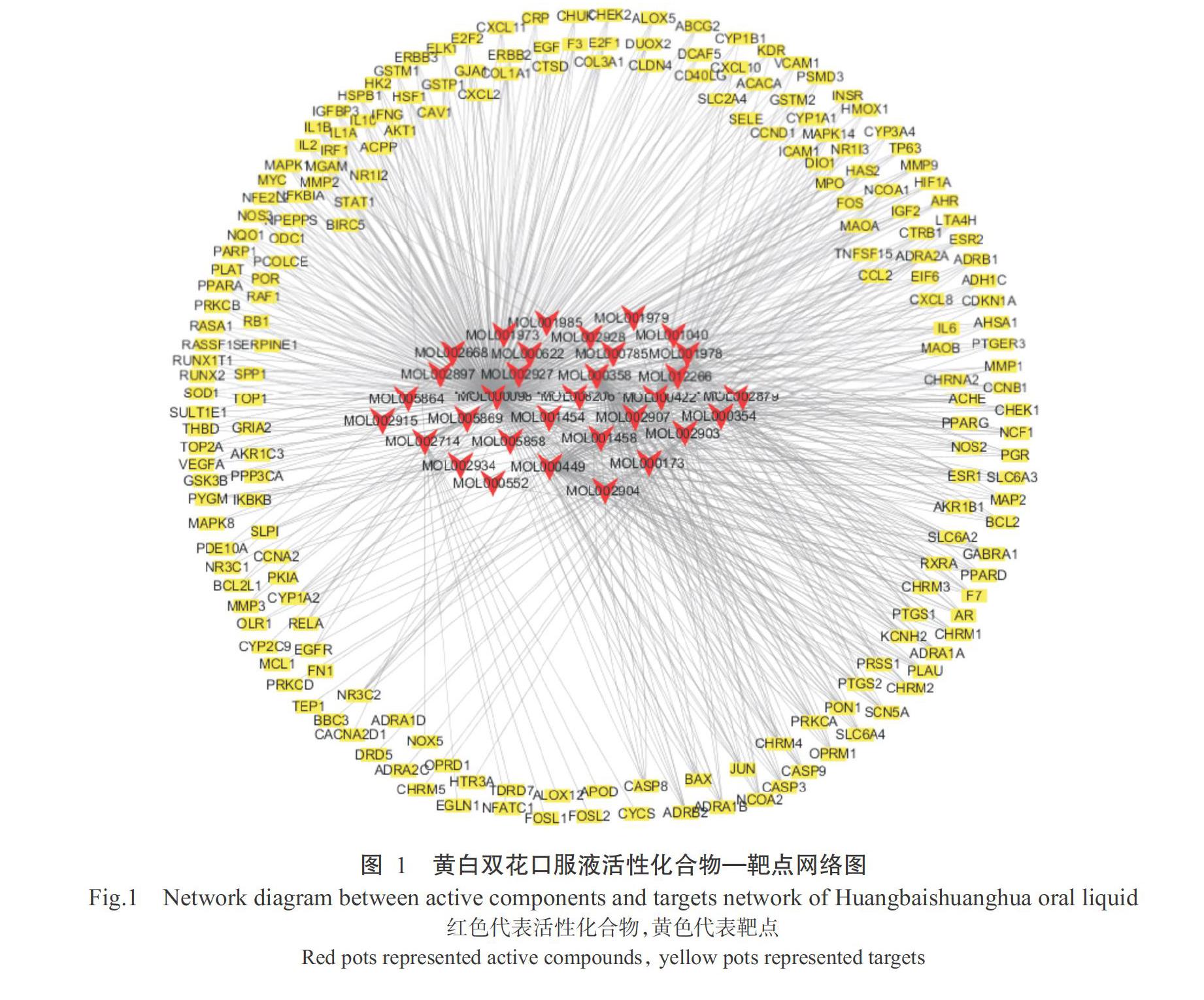
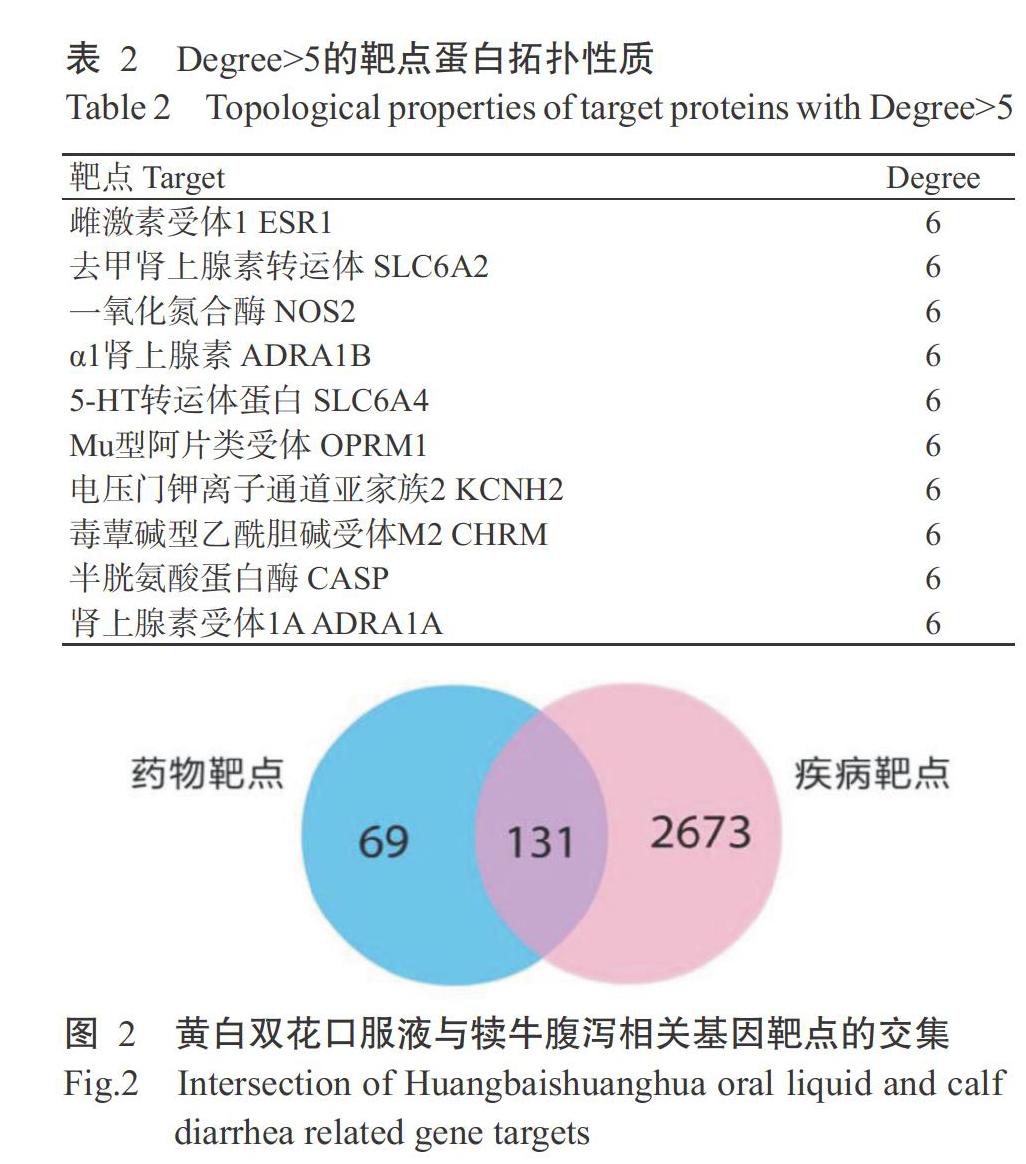
在TCMSP数据库中筛选出43种符合条件的活性化合物,并得到其对应靶点,将得到的数据导入Cytoscape绘图软件,建立化合物与对应靶点间的网络图(图1),共发现32种活性化合物节点、229个靶点节点和679条边,每种活性化合物平均与21.2个靶点存在互作关系,每个靶点平均与7种活性化合物存在互作关系,说明黄白双花口服液在治疗犊牛腹泻过程中存在多成分、多靶点的特征,连接较多靶点及活性化合物的节点分子在治疗犊牛腹泻疾病中发挥重要作用;也存在多个靶点对应1种活性化合物,体现了复方中药多途径的作用机制。从活性化合物的角度来看, Degree>10的活性化合物有11种,靶点Degree>50的活性化合物有3种(表1)。其中,槲皮素的连接度最高,能与342个靶点相连接,其次是β-谷甾醇和豆甾醇等。从靶点的角度来看,连接活性化合物Degree>5的靶点有32个,分别是雌激素受体(ESR1)、去甲肾上腺素转运体(SLC6A2)、一氧化氮合酶2(NOS2)及α1肾上腺素(ADRA1B)等(表2)。
2. 2 复方中药成分作用于犊牛腹泻的蛋白质—蛋白质相互作用网络图
将通过Gene Cards数据库检索得到与犊牛腹泻相关的2804个靶点基因与Uniport数据库中黄白双花口服液的200个相关活性化合物靶点,使用维恩图求取二者的交集,共得到131个相关靶点基因(图2)。利用String数据库建立复方中药各活性化合物靶点的蛋白质—蛋白质相互作用网络图(分值大于0.9),结果(图3)显示该网络图包括128个节点和205条相互关系,其中丝氨酸/苏氨酸蛋白激酶1(AKT1)、白介素2(IL-2)、白介素6(IL-6)、白介素8(IL-8)、促分裂素原活化蛋白激酶1(MAPK1)及含半胱氨酸的天冬氨酸蛋白酶3(CASP3)的出现频率较高,故推测这些蛋白在黄白双花口服液治疗犊牛腹泻过程中发挥重要作用。
为了更直观地反映黄白双花口服液与犊牛腹泻的交集靶点与活性化合物间的关系,将其在String数据库和TCMSP数据库中的蛋白质与复方中药活性化合物的相互作用关系导入Cytoscape绘图软件,即得到活性化合物与交集靶点的关系网络图(图4)。
2. 3 GO功能富集分析结果
利用DAVID数据库对交集靶点的蛋白进行GO功能富集分析,得到204条GO功能条目(FDR<10-2)。其中,细胞组成条目8条(图5),包括细胞外区域部分(Extracellular region part)、细胞外空间(Extracellular space)、细胞质(Cytosol)和细胞成分(Cell fraction)等;分子功能条目12条(图6),包括配体依赖性核受体活性、类固醇激素受体活性、药物结合、血红素结合、四吡咯结构结合、同一蛋白质结合(Identical protein binding)、酶结合(Enzyme binding)、脂质结合(Lipid binding)和蛋白质聚合活性(Protein dimerization activity)等;生物过程条目184条,具体为细胞增殖(Regulation of cell proliferation)、细胞程序化死亡调控(Regulation of programmed cell death)、細胞死亡调控(Regulation of cell death)、对有机物质的响应(Response to organic substance)及对细胞程序死亡的负调控(Negative regulation of programmed cell death)等,图7是前10种生物过程条目。
2. 4 KEGG通路富集分析结果
KEGG通路富集分析结果(表3)表明,黄白双花口服液治疗犊牛腹泻的相关蛋白主要富集在19条信号通路上(FDR<10-2),包括膀胱癌、前列腺癌、胰腺癌和p53等癌症相关通路(Pathways in cancer),还涉及炎症相关的Toll样受体信号通路(Toll-like receptor signaling pathway)、NOD样受体信号通路(NOD-like receptor signaling pathway)、免疫相关的T细胞受体信号通路(T cell receptor signaling pathway)及B细胞受体信号通路(B cell receptor signaling pathway)等。
3 讨论
本研究利用TCMSP数据库,根据OB和DL筛选出黄白双花口服液中6味中药活性化合物的作用靶点,并通过String、Cytoscape和DAVID数据库构建黄白双花口服液活性化合物—靶点网络图及复方中药成分与犊牛腹泻的蛋白质—蛋白质相互作用网络图,解析黄白双花口服液治疗犊牛腹泻的作用分子机制,也进一步印证中药复方“多成分—多靶点—多通路”治疗疾病的理论。
黄连和白头翁是黄白双花口服液中的君药,治腹泻的主证。黄连含有槲皮素、氢化小檗碱和黄连素,其中,槲皮素具有抗氧化、抗细胞凋亡及免疫调节等作用(Li et al.,2016;Mlcek et al.,2016),氢化小檗碱能有效抑制大肠杆菌和肠球菌类病原菌的生长,同时具有抗肿瘤等多种药理活性作用(黄祖良等,2002;Zou et al.,2017);黄连素的主要作用是抗炎、降血糖和降血脂(Ma et al.,2017)。白头翁含有β-谷甾醇和豆甾醇,均属于类固醇,类似于甾体类激素,具有良好的抗炎作用,还可降低血液胆固醇、抗氧化、免疫调节及促生长等(Antwi et al.,2018;汪帅等,2019)。此外,黄白双花口服液中的金银花、黄芩、地榆和乌梅等原料含有山奈酚、异鼠李素和黄芩素等活性化合物。山奈酚不仅能抑制凋亡相关蛋白及信号通路蛋白的表达(Wu et al.,2018),还具有抗癌、治疗糖尿病和骨质疏松等药理作用(赵妍,2013);异鼠李素具有抗氧化、抗炎及抗肿瘤等作用(Gao et al.,2017)。可见,黄白双花口服液主要是利用上述各种化合物的活性作用,通过多靶点、多通路发挥抗菌消炎、抗氧化及免疫调节等作用,以达到治疗犊牛腹泻的目的。
本研究通过分析黄白双花口服液中与腹泻相关基因的相互作用网络,结果发现AKT1、MAPK1、IL-2、IL-6和IL-8为关键蛋白,故推测黄白双花口服液治疗犊牛腹泻是通过这些蛋白发挥作用。AKT1可通过调节葡萄糖的摄取和转运以抑制细胞凋亡及促进细胞增殖(Yamashita et al.,2001);MAPK1为MAPK信号通路中重要的蛋白家族成员,对细胞增殖与分化均起关键作用(Yoon and Seger,2006)。因此,推测黄白双花口服液可能是通过调控AKT1和MAPK1蛋白表达,抑制胃肠道黏膜上皮细胞凋亡,并促进其增殖,从而修复黏膜损伤。IL-2、IL-6和IL-8是炎症过程的趋化因子,是机体抵御炎症的调节因子。本研究中的KEGG通路富集分析结果也表明,黄白双花口服液治疗犊牛腹泻的相关基因主要富集在Toll样受体信号通路、NOD样受体信号通路和癌症相关通路上,推测黄白双花口服液也参与调控机体的炎症反应。Toll样受体是一类模式识别受体,可对相应的病原体进行识别和结合,并向胞内传递信号,诱导IL-6、IL-8、TNF-α及IFN-γ等多种炎症因子表达,在病原体入侵早期阶段即启动天然免疫;在感染后期阶段,还可促进树突状细胞的分化,启动获得性免疫,共同参与抗感染过程(徐海花和孙蓬明,2020)。T细胞受体能特异性识别MHC细胞表面提呈的抗原肽,并向细胞内部传递信号,诱导酪氨酸激酶活化,促进信号传递复合物组装,活化下游MAPK、PKC及钙离子等信号途径,最终调控效应蛋白分子表达,激活机体的天然免疫(梁静静等,2016)。B细胞受体介导B细胞的活化,激活机体的体液免疫及分泌特异性抗体,从而中和病原微生物。因此,在黄白双花口服液治疗犊牛腹泻过程中,T细胞受体信号通路和B细胞受体信号通路分别参与机体天然免疫及体液免疫的激活过程。
综上所述,黄白双花口服液中的活性化合物是通过抑制胃肠道黏膜损伤,参与机体炎症反应和调控免疫机能等生物学过程,从而达到治疗犊牛腹泻的目的,即黄白双花口服液是通过多靶点、多通路来发挥药理作用,与前期的药理学研究结果(王胜义等,2011)相吻合。
4 结论
黄白双花口服液主要以黄连、白头翁、金银花、黄芩、地榆和乌梅中的槲皮素、β-谷甾醇、豆甾醇及山奈酚等活性化合物成分,通过ATK1、MAPK1、IL-2、IL-6和IL-8等靶点,经Toll样受体信号通路、NOD样受体信号通路、T细胞受体信号通路和B细胞受体信号通路等,发挥抗菌消炎、抑制细胞损伤及调节免疫力等作用,以达到治疗犊牛腹泻的目的。
参考文献:
董书伟,刘永明,齐志明,荔霞,刘世祥,王胜义. 2010. 中药新复方治疗犊牛腹泻临床试验[J]. 黑龙江畜牧兽医,(23):116-117. [Dong S W,Liu Y M,Qi Z M,Li X,Liu S X,Wang S Y. 2010. Clinical trial of new compound Chinese herbal medicine for treating calf diarrhea[J]. Heilongjiang Animal Science and Veterinary Medicine,(23):116-117.]
黄超. 2015. 药物口服生物利用度预测及在中药归经研究上的应用[D]. 楊凌:西北农林科技大学. [Huang C. 2015. Drug oral bioavailability prediction and application in the meridian tropism theory of traditional Chinese medicine[D]. Yangling:Northwest A & F University.]
黄祖良,韦启后,汤春荣,李红蕾. 2002. 氢化小檗碱镇痛和消炎作用的研究[J]. 江西中医学院学报,14(1):33-34. [Huang Z L,Wei Q H,Tang C R,Li H L. 2002. Experimental study on anti-inflammatory and analgesia effects of tetrahydraoberberine[J]. Journal of Jiangxi College of Traditional Chinese Medicine,14(1):33-34.]
江伟,王洪海,王文有,王国卿. 2010. 白头翁散等中药抑制犊牛腹泻致病菌的效果[J]. 黑龙江畜牧兽医,(6):91-92. [Jiang W,Wang H H,Wang W Y,Wang G Q. 2010. The effect of Baitouwengsan and other traditional Chinese medicines on inhibiting the pathogenic bacteria of calf diarrhea[J]. Heilongjiang Animal Science and Veterinary Medicine,(6):91-92.]
焦桂兰,谭忠田,孙利国,于丽丽,郝友珍. 2001. 中药治疗犊牛腹泻的报告[J]. 内蒙古兽医,(4):39. [Jiao G L,Tan Z T,Sun L G,Yu L L,Hao Y Z. 2001. Report on the treatment of calf diarrhea with traditional Chinese medicine[J]. Inner Mongolia Veterinary Medicine,(4):39.]
李继昌,于文会,张秀英,侯振中,徐利,姜晓文,徐丹丹. 2011. 乌连颗粒剂对细菌性犊牛腹泻的临床疗效观察[J]. 中国奶牛,(8):46-48. [Li J C,Yu W H,Zhang X Y,Hou Z Z,Xu L,Jiang X W,Xu D D. 2011. Clinical effect observation of Wulian granules in treating bacte-rial diarrhea in calves[J]. China Dairy Cows,(8):46-48.]
梁静静,吕俊,鲁林荣. 2016. T细胞受体(TCR)信号传递的调控及其功能[J]. 生命科学,28(2):153-161. [Liang J J,Lü J,Lu L R. 2016. The regulation and function of TCR signaling pathway[J]. Chinese Bulletin of Life Sciences,28(2):153-161.]
伦艳霞,王学静,樊爱丽. 2013. 中药复方制剂治疗犊牛腹泻的临床效果观察[J]. 中国奶牛,(10):65-66. [Lun Y X,Wang X J,Fan A L. 2013. Observation on the clinical effect of Chinese herbal compound preparation on calf diarrhea[J]. China Dairy Cows,(10):65-66.]
师志海,徐照学,兰亚莉,王文佳. 2020. 牛诺如病毒及牛嵴病毒双重PCR检测方法的建立及初步应用[J]. 中国动物传染病学报,28(1):28-32. [Shi Z H,Xu Z X,Lan Y L,Wang W J. 2020. Development and preliminary application of a duplex PCR method for simult detection of bovine norovirus and bovine kobuvirus[J]. Chinese Journal of Animal Infectious Diseases,28(1):28-32.]
田密. 2019. 犊牛腹泻的发病原因及防治措施[J]. 当代畜禽养殖业,(8):24-25. [Tian M. 2019. Cause of calf diarrhea and prevention measures[J]. Modern Animal Husbandry,(8):24-25.]
汪帅,孙宇,李春梅,卢群. 2019. 豆甾醇的研究进展概述[J]. 中国药业,28(23):96-98. [Wang S,Sun Y,Li C M,Lu Q. 2019. Research progress of stigmasterol[J]. China Pharmaceuticals,28(23):96-98.]
王勝义,刘永明,齐志明,荔霞,董书伟,刘世祥. 2011. 热痢净口服液药效学试验[J]. 中国兽医杂志,47(2):65-67. [Wang S Y,Liu Y M,Qi Z M,Li X,Dong S W,Liu S X. 2011. Pharmacodynamics test of Reshijing oral liquid[J]. Chinese Journal of Veterinary Medicine,47(2):65-67.]
王胜义. 2010. 中兽药黄白口服液的生产工艺、质量标准与药效学研究[D]. 北京:中国农业科学院. [Wang S Y. 2010. Study on the production method,quality control and pharmacodynamics of traditional Chinese veterinary medicine Huangbai liquid[D]. Beijing:Chinese Academy of Agricultural Sciences.]
王文晓,乐世俊,刘娟,冯五文,陈艳琰,鄢丹,唐于平. 2020. 基于肠道菌群的中药改善胰岛素抵抗的作用机制研究进展[J]. 中草药,51(1):216-228. [Wang W X,Yue S J,Liu J,Feng W W,Chen Y Y,Yan D,Tang Y P. 2020. Research progress on insulin resistance-attenuating mechanisms of Chinese materia medica based on gut microbiota[J]. Chinese Traditional and Herbal Drugs,51(1):216-228.]
王艳艳,王团结,丁琳琳. 2019. 基于系统药理学的厚朴药理作用机制探究[J]. 中草药,50(24):6024-6031. [Wang Y Y,Wang T J,Ding L L. 2019. Exploring pharmacological mechanism of Magnoliae Officinalis Cortex based on systems pharmacology[J]. Chinese Traditional and Her-bal Drugs,50(24):6024-6031.]
武瑞萍. 2017. 犢牛腹泻病因及治疗措施探析[J]. 畜牧兽医科学(电子版),(12):48. [Wu R P. 2017. Analysis of the causes and treatment of calf diarrhea[J]. Graziery Veterinary Sciences(Electronic Version),(12):48.]
徐海花,孙蓬明. 2020. Toll样受体与输卵管疾病[J]. 中国生育健康杂志,31(3):289-291. [Xu H H,Sun P M. 2020. Toll-like receptors and fallopian tube diseases[J]. Chinese Journal of Reproductive Health,31(3):289-291.]
杨保军. 2010. 中兽医理论指导防治犊牛腹泻[J]. 中国牛业科学,36(1):92-94. [Yang B J. 2010. Theoretical gui-dance of Chinese veterinary medicine to prevent and cure calf diarrhea[J]. China Cattle Science,36(1):92-94.]
赵妍. 2013. 山奈酚对脂多糖诱导小鼠急性肺损伤的保护作用[D]. 哈尔滨:东北农业大学. [Zhao Y. 2013. Protective effects of kaempferol on the acute lung injury in mice[D]. Harbin:Northeast Agricultural University.]
赵雨靓,李丰,石彬彬,李燕. 2020. 中药系统药理学Ⅱ:在药物开发和复方研究领域的应用进展[J]. 辽宁中医杂志,47(3):92-94. [Zhao Y L,Li F,Shi B B,Li Y. 2020. Chinese medicine systems pharmacology:Progress in drug discovery and formula study[J]. Liaoning Journal of Traditional Chinese Medicine,47(3):92-94.]
Antwi A O,Obiri D D,Osafo N,Essel L B,Forkuo A D,Atobiga C. 2018. Stigmasterol alleviates cutaneous allergic responses in rodents[J]. BioMed Research Internation,2018:3984068. doi:10.1155/2018/3984068.
Chae J B,Park J,Jung S H,Kang J H,Chae J S,Choi K S. 2019. Acute phase response in bovine coronavirus positive post-weaned calves with diarrhea[J]. Acta Veterinaria Scandinavica,61(1):36. doi:10.1186/s13028-019-0471-3.
Gao L,Yao R,Liu Y Z,Wang Z,Huang Z,Du B B,Zhang D H,Wu L M,Xiao L L,Zhang Y Z. 2017. Isorhamnetin protects against cardiac hypertrophy through blocking PI3K-AKT pathway[J]. Molecular and Cellular Bioche-mistry,429(1-2):167-177.
Gudiol F. 2010. Prudent use of antibiotics and suggestions for improvement in long-term-care facilities[J]. Enfermedades Infecciosasy Microbiologia Clinica,28(S4):32-35.
Kr?mker V,Leimbach S. 2017. Mastitis treatment-reduction in antibiotic usage in dairy cows[J]. Reproduction in Domestic Animals,52(S3):21-29.
Lee S H,Kim H Y,Choi E W,Kim D. 2019. Causative agents and epidemiology of diarrhea in Korean native calves[J]. Journal of Veterinary Science,20(6):e64. doi:10.4142/jvs.2019.20.e64.
Li Y,Yao J Y,Han C Y,Yang J X,Chaudhry M T,Wang S N,Liu H N,Yin Y L. 2016. Quercetin,inflammation and immunity[J]. Nutrients,8(3):167. doi:10.3390/nu8030167.
Ma Y G,Liang L,Zhang Y B,Wang B F,Bai Y G,Dai Z J,Xie M J,Wang Z W. 2017. Berberine reduced blood pressure and improved vasodilation in diabetic rats[J]. Journal of Molecular Endocrinology,59(3):191-204.
Mlcek J,Jurikova T,Skrovankova S,Sochor J. 2016. Quercetin and its anti-allergic immune response[J]. Molecules,21(5):623. doi:10.3390/molecules21050623.
Riggs M W,Schaefer D A. 2020. Calf clinical model of cryptosporidiosis for efficacy evaluation of therapeutics[J]. Methods in Molecular Biology,2052:253-282.
Vinotha G,Sundar T V. 2019. Drug likeness prediction using structure based molecular descriptors and support vector machines[J]. Materials Today:Proceedings,18(4):1658-1669.
Wu P,Meng X F,Zheng H D,Zeng Q,Chen T F,Wang W,Zhang X,Su J Y. 2018. Kaempferol attenuates ROS-induced hemolysis and the molecular mechanism of its induction of apoptosis on bladder cancer[J]. Molecules,23(10):2592. doi:10.3390/molecules23102592.
Yamashita K,Kajstura J,Discher D J,Wasserlauf B J,Bishopric N H,Anversa P,Webster K A. 2001. Reperfusion-activated Akt kinase prevents apoptosis in transgenic mouse hearts overexpressing insulin-like growth factor-1[J]. Circulation Research,88(6):609-614.
Yoon S,Seger R. 2006. The extracellular signal-regulated kinase:Multiple substrates regulate diverse cellular functions[J]. Growth Factors,24(1):21-44.
Yu G H,Zhang Y Q,Ren W Q,Dong L,Li J F,Geng Y,Zhang Y,Li D F,Xu H Y,Yang H J. 2017. Network pharmacology-based identification of key pharmacological pathways of Yin-Huang-Qing-Fei capsule acting on chronic bronchitis[J]. International Journal of Chronic Obstructive Pulmonary Disease,12:85-94.
Zhang G B,Li Q Y,Chen Q L,Su S B. 2013. Network pharmacology:A new approach for chinese herbal medicine research[J]. Evidence-based Complementary and Alternative Medicine,2013:621423. doi:10.1155/2013/621423.
Zou K,Li Z,Zhang Y,Zhang H Y,Li B,Zhu W L,Shi J Y,Jia Q,Li Y M. 2017. Advances in the study of berberine and its derivatives:A focus on anti-inflammatory and anti-tumor effects in the digestive system[J]. Acta Pharmacologica Sinica,38(2):157-167.
(責任编辑 兰宗宝)

