羊链球菌CVCC55001、CVCC55002株的制备与鉴定
张一帜,任小侠,李 建,王秀丽,刘元杰,李俊平,张 媛
(中国兽医药品监察所,北京 100081)
羊链球菌病是由溶血性链球菌引起的一种急性热性传染病,多发于冬春寒冷季节(11月至次年4月)。羊链球菌病主要通过消化道和呼吸道传播,自然感染潜伏期通常为2~10 d。病羊主要症状是呼吸困难,行动不便,临死时跪地不起,伴有磨牙、呻吟等症状。临床上特征表现为发热,下颌和咽喉部肿胀,胆囊肿大和纤维素性肺炎[1]。在我国,羊链球菌严重危害山羊、绵羊健康,该菌也能够感染人,引起高热伤口感染、心内膜炎、肺炎及会厌炎等细菌感染典型症状[2]。
羊链球菌CVCC55001、CVCC55002为羊链球菌灭活疫苗生产、检验用强毒菌种,也是羊链球菌菌种免疫原性鉴定的攻毒菌种。此二株菌种最初由青海牧医所于青海省贵南县分离所得,现保存于中国兽医微生物菌种保藏管理中心。羊链球菌CVCC55001、CVCC55002均属于强毒株,血清型为兰氏C型,属马链球菌兽疫亚种(S.equisubsp.zooepidimicus)[3]。该菌环境抵抗力较弱,对湿热和干燥均敏感,在60 ℃处理30 min即会死亡。该菌对于红霉素、青霉素、四环素、金霉素以及磺胺类药物都非常敏感[4]。《中华人民共和国兽用生物制品规程》二〇〇〇年版中规定这两株菌种在冻干状态下2~8 ℃的保存期为4年,新制备的菌种应按照《规程》进行鉴定。本文对CVCC55001、CVCC55002株羊链球菌的制备和鉴定方法进行了研究,并对该菌的适宜生长培养基进行比对,以期为该菌的鉴定和相关标准的制修订提供参考。
1 材料与方法
1.1 菌种 羊链球菌CVCC55001、CVCC55002 株,2016年3月22日冻干,F7,由中国兽医药品监察所菌种保藏中心提供。
1.2 培养基及试剂 马丁琼脂培养基、改良马丁琼脂培养基、胰蛋白胨大豆琼脂(TSA)培养基、马丁肉汤培养基、缓冲肉汤培养基、液体硫乙醇酸盐培养基(TG)、胰酪大豆胨液体培养基(TSB)、生理盐水、5%蔗糖脱脂牛奶均购自北京中海生物技术有限公司; ATB链球菌快速鉴定试剂盒、哥伦比亚血琼脂平板购自Bio Mérieux公司,革兰氏染色液购自海博生物,荚膜染色液购自源叶生物,链球菌分型试剂盒购自Oxoid公司。
1.3 实验动物 实验兔购自北京隆安实验动物技术有限公司; 健康绵羊分别购自河北、甘肃某养殖场。
1.4 菌种复壮 开启2016年3月22日冻干的羊链球菌CVCC55001、CVCC55002株各一支,用0.5 mL马丁肉汤溶解后,分别接种含10%绵羊脱纤血马丁琼脂平板(以下简称血平板)2付,37 ℃培养18 h。之后挑取该平板上的典型菌落,分别接种含10%绵羊脱纤血琼脂斜面2支,37 ℃培养24 h,血斜培养物呈灰色、半透明、湿润、粘稠。将血斜培养物划取少量接种含10%马血清的马丁肉汤,37 ℃静置培养24 h后,肉汤培养物一致混浊,无菌膜。将肉汤培养物20倍稀释后,2 mL/只颈静脉注射1~2岁健康绵羊。羊于4~5 d内死亡,剖解无菌取肝脏和心血,用接种环分别取少量肝脏、心血接种血平板各1付,37 ℃培养24 h。
1.5 菌种的鉴定
1.5.1 真空度测定、纯粹检验及剩余水分测定 根据2015年版《中国兽药典》进行检验[5]。
1.5.2 培养特性鉴定 用接种环取刮取少量菌体在含10%绵羊脱纤血琼脂平板或哥伦比亚琼脂平板上划线培养,37 ℃培养18~24 h,观察菌落形态。
1.5.3 形态和生化特性鉴定 取新鲜培养的哥伦比亚琼脂平板上的菌体进行革兰氏染色、荚膜染色,进行判定。参照ATB链球菌快速鉴定试剂盒使用说明书进行生化特性检查。
1.5.4 血清学特性鉴定 按照Oxoid链球菌分群试剂盒说明书,挑取新鲜培养物,加至酶溶液中混匀、消化后,分别与革兰氏A、B、C、D、E、F群典型血清进行反应,观察是否出现凝集现象。
1.5.5 培养基比对研究 分别使用含10%新生牛血清改良马丁琼脂、改良马丁琼脂、含10%新生牛血清TSA、TSA对于CVCC55001、CVCC55002肉汤培养物进行活菌计数,平板培养18~24 h观察记录结果。
1.5.6 免疫原性鉴定 按照《中华人民共和国兽用生物制品规程》制备羊链球菌CVCC55001、CVCC55002灭活疫苗[6],2~8 ℃保存。分别免疫1~2岁各绵羊4头,5 mL/头。再分别用CVCC55001、CVCC55002新鲜菌液对同一批羊进行测毒,14 d后确定各株的最小致死量。免疫21 d后使用CVCC55001、CVCC55002最小致死量对免疫组、对照组羊进行攻毒,观察各组羊状态持续21 d,记录结果。
1.5.7 毒力鉴定 分别采集CVCC55001、CVCC55002株测毒试验中濒死羊心血,接种含5%血清缓冲肉汤,培养16 h后用马丁肉汤1000倍稀释濒死羊心血培养物,2 mL/头静脉注射绵1~2岁羊2头,之后对于菌液进行活菌计数。再取出 1 支CVCC55001株和CVCC55002株濒死羊心血,接种含5%血清缓冲肉汤,培养16 h。次日,统计活菌计数结果并按该结果使用马丁肉汤将两种菌液分别稀释至90 CFU/mL(规程要求70~100 CFU/mL),同时复数确认实际注射剂量,1 mL/只静脉注射家兔各5只。要求绵羊注射后21 d内全部死亡,家兔注射后10 d内全部死亡[6]。
2 结果与分析
2.1 真空度测定 对冻干的2株菌种进行真空度测定,CVCC55001株194/200、CVCC55002株194/200呈现白色或粉色或紫色辉光,符合规定;将不符合规定的冻干菌种进行无害化处理。
2.2 纯粹检验 分别各抽取5支真空度测定良好的CVCC55001、CVCC55002株菌种进行纯粹检验,结果均为5/5符合规定。
2.3 剩余水分测定 分别各抽取8支真空度测定良好的CVCC55001、CVCC55002株菌种进行剩余水分测定,剩余水分测定结果为CVCC55001:0.8%、0.6%、0.9%、1.2%;CVCC55002:0.6%、0.7%、0.9%、1.1%,均符合规定。
2.4 培养特性鉴定 肉眼观察培养18 h的CVCC55001、CVCC55002株菌落状态为灰色、半透明、湿润、粘稠,继续培养至24 h,对光观察可见菌落周围有一圈透明溶血环,为β溶血(图1)。

图1 CVCC55001株(左)、CVCC55002株(右)菌落培养形态
2.5 形态和生化特性鉴定 挑取新鲜培养物进行革兰氏染色,结果为革兰氏阳性球菌,呈单个、成对和短链排列。挑取新鲜培养物进行荚膜染色,结果为有透明状荚膜。符合形态鉴定规定。使用自动细菌鉴定系统读取CVCC55001、CVCC55002菌种反应结果相同,均为马链球菌兽疫亚种,具体详见表1,生化特性鉴定结果符合规定。
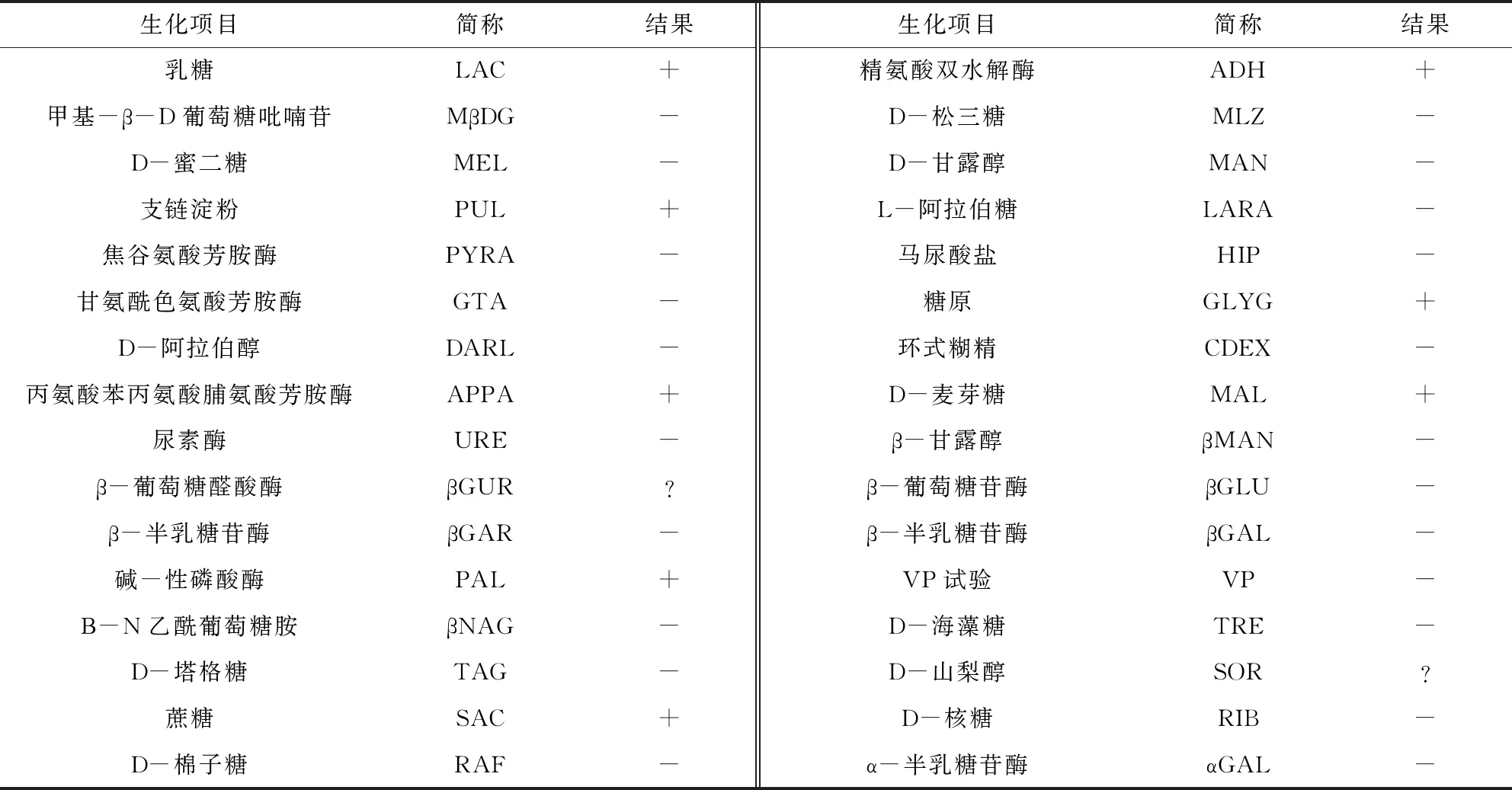
表1 CVCC55001、CVCC55002菌种生化特性鉴定结果
2.6 血清学特性鉴定 按照Oxoid链球菌分群试剂盒说明书进行检测,菌种CVCC55001、CVCC55002株菌落与A、B、D、E、F群典型血清均无凝集反应,与C群典型血清出现凝集反应。判定血清学特性鉴定结果均符合规定。
2.7 培养基比对研究 分别对CVCC55001、CVCC55002肉汤培养物进行活菌计数,将原菌液稀释至10-5/3后,吸取0.1 mL滴板培养20 h。结果可以看到,无论是改良马丁琼脂还是TSA,在不加新生牛血清(NBS)的情况下都无链球菌生长,说明血清是CVCC55001、CVCC55002株菌生长必须营养成分。对比改良马丁琼脂(含血清)和TSA(含血清)的结果,菌落数相近,TSA(含血清)平板上的菌落较大,说明TSA促进该菌生长速度优于改良马丁琼脂,二者对于该菌的促生长能力相近(表2)。

表2 CVCC55001、CVCC55002菌种不同培养基活菌计数结果
2.8 免疫原性鉴定 经测毒得到两株菌对于绵羊的最小致死剂量为:CVCC55001 1.2×104CFU、CVCC55002 2.6×104CFU。将新鲜培养菌液稀释至最小致死剂量对于免疫组和对照组进行攻毒,同时进行复数,1 d后计算确定实际攻毒剂量。攻毒后14 d内,CVCC55001株对照组2/2死亡,免疫组4/4存活;CVCC55002株对照组2/2死亡,免疫组3/4存活(表3),CVCC55001、CVCC55002株免疫原性鉴定符合规定。
2.9 毒力鉴定 将CVCC55001、CVCC55002死羊心血缓冲肉汤培养物1000倍稀释,静脉注射1~2岁绵羊2头各2 mL,次日根据复数结果计算实际注射剂量为CVCC55001:1.2×105CFU/头、CVCC55002:3.4×105CFU/头,绵羊经注射后21 d内全部死亡。分别注射家兔CVCC55001 91 CFU/只、CVCC55002 85 CFU/只,在注射后10 d内全部死亡(表4)。CVCC55001、CVCC55002株毒力鉴定符合规定。

表3 CVCC55001、CVCC55002菌种免疫原性鉴定试验结果

表4 CVCC55001、CVCC55002菌种毒力鉴定试验结果
3 讨论与小结
本研究鉴定该批羊链球菌CVCC55001及CVCC55002株培养特性、形态及生化特性、血清学特性、免疫原性、毒力、纯粹、剩余水分及真空度项目均符合《中华人民共和国兽用生物制品规程》二〇〇〇年版标准的规定。在免疫原性和毒力鉴定中显示CVCC55001对于羊的最小致死剂量为1.2×104CFU、对于兔的致死剂量为91 CFU;CVCC55002对于羊的最小致死剂量为2.6×104CFU、对于兔的致死剂量为85 CFU。马链球菌兽疫亚种链球菌对于其他动物也有着感染性,孙智远等使用链球菌马链球菌兽疫亚种C74-63株对兔最小致死量为250 CFU,猪最小致死量为3000 CFU[7]。近年来,随着分子生物学等技术的发展,对于菌种的功能研究也不断深入,Xu 等对于链球菌马链球菌兽疫亚种抗吞噬作用的研究中,利用转座子诱变定位了若干与抗吞噬作用相关的基因[8],这些基因的功能与该菌的致病能力密切相关,此类研究也为今后提升优化菌种鉴定的精确性和科学性提供了思路。
在《中华人民共和国兽用生物制品规程》中规定该菌种培养时使用改良马丁琼脂和绵羊血马丁琼脂平板培养[6]。但在实际鉴定和研究过程中,由于马丁琼脂和改良马丁琼脂在制备中均需求牛肉汤和猪肺汤等天然性成分,导致这两种培养基不同批次的促生长能力时常出现差异。TSA作为国际上广泛应用的一般细菌培养基,配制简便,标准明确。本研究将TSA与改良马丁琼脂对于CVCC55001和CVCC55002的促生长情况进行了比对,发现TSA能够替代改良马丁琼脂,同时还具有更强的促生长速度,为相关标准和规程对于该菌的培养基的优化和变更提供了参考。

