DAPT预处理对脑缺血/再灌注损伤小鼠的神经保护作用
陈华轩,罗 波,王 林,张 渊,刘 毅,范润金
(四川省南充市中心医院/川北医学院第二临床医学院神经外科,四川南充 637000)
脑卒中是导致死亡的主要原因之一,其中缺血性脑卒中约占80%[1],它因发病率和致残率“双高”的特点而备受重视。缺血性脑卒中急性期患者主要通过组织纤溶酶原激活物静脉溶栓治疗,但血管再通可导致神经细胞延迟死亡,从而引起脑缺血/再灌注损伤[2]。既往研究证实细胞凋亡、炎性反应、氧化应激、血脑屏障破坏等是缺血性脑卒中导致脑损伤的主要发病机制[3],进一步研究发现Notch信号通路是一种调控脑缺血/再灌注损伤的重要途径[4],但现阶段仍未明确脑缺血/再灌注损伤被Notch信号通路调控的具体机制。N-[N-(3,5-双氟酚内氨酰)]-S-苯氨基乙酸t-丁基酯{N-[N-(3,5-difluorohenacetyl-L-alanyl)]-S-phenyl glycine t-butyl ester,DAPT}作为常见的γ-分泌酶抑制剂,其通过阻断酶切过程来抑制Notch信号通路的信号传导,有助于减轻脑缺血/再灌注损伤。本研究通过DAPT预处理及建立局灶性小鼠脑缺血/再灌注模型,观察动物模型神经功能缺损、神经细胞凋亡、脑梗死体积、炎症指标、星形胶质细胞活化指标、Notch信号通路激活指标的变化,旨在探讨DAPT预处理对脑缺血/再灌注损伤小鼠的神经保护作用及其机制。
1 材料与方法
1.1 动物及实验材料
SPF级8周龄雄性C57BL/6小鼠75只,体质量(28±2)g,购自上海杰思捷实验动物有限公司,生产许可证号:SCXK(沪)2018-0004;TUNEL试剂盒(瑞士Roche公司);2,3,5-氯化三苯基四氮唑(2,3,5-triphenyltetrazolium,chloride,TTC)染液购于北京雷根生物技术有限公司;Hes1和Hes5 抗体购于美国Abcam公司;DAPT和Notch1抗体购于美国CST公司;白细胞介素-1β(IL-1β)、肿瘤坏死因子-α(TNF-α)ELISA试剂盒购自上海酶联生物科技有限公司;逆转录试剂盒、实时荧光定量PCR(RT-PCR)引物和PCR试剂盒、TRIzol试剂购自北京赛因坦科技有限公司。
1.2 方法
1.2.1分组与建模
小鼠分为假手术组、大脑中动脉缺血/再灌注组(模型组)、DAPT预处理+大脑中动脉缺血/再灌注组(DAPT预处理组),每组25只。DAPT预处理组小鼠造模前连续7 d每天腹腔注射1次DAPT(20 mg/kg),而模型组和假手术组小鼠腹腔注射等量生理盐水。DAPT预处理组与模型组用线栓法闭塞右侧大脑中动脉缺血2 h,再灌注24 h,而假手术组仅采用相同的手术方法,没有插入线栓。采用线栓法闭塞右侧大脑中动脉,建立局灶性小鼠脑缺血/再灌注模型具体过程如下:通过腹腔内注射体积分数10% 的水合氯醛麻醉小鼠(2.5 mL/kg),从颈部正中切开皮肤后将右侧颈总动脉、颈内动脉和颈外动脉仔细分离,然后在离颈总动脉分叉处5 mm处做一个小切口,将0.3 mm线栓从颈总动脉缓慢插入颈内动脉至大脑中动脉,缺血2 h后轻柔拉出线栓,使血流恢复正常。
1.2.2Longa生物学评分评价神经功能缺损
在小鼠脑缺血2 h及再灌注24 h后采用Longa生物学评分评估其神经功能缺损状况,具体评分细则如下。小鼠活动完全正常、没有任何神经功能缺损症状,记为0分;将小鼠提尾悬空后其出现左侧前肢屈曲、肘关节伸直、肩部内收为轻度神经功能缺损,记为1分;小鼠爬行时向左侧转圈并且侧推时左右推动的阻力不等为中度神经功能缺损,记为2分;左侧肢体肌力明显减退导致其不能承受体重而向左侧倾倒为重度神经功能缺损,记为3分;呈筒样滚动或无自主活动,甚至意识障碍为严重神经功能缺损,记为4分。其中1~3分视为合格模型,排除0分及4分模型。
1.2.3TUNEL染色检测神经元细胞凋亡
采用TUNEL 染色法对小鼠凋亡神经元细胞进行计数,遵照TUNEL试剂盒说明书的操作步骤检测各组小鼠缺血半侧区神经元细胞凋亡。正常神经元细胞显示为蓝色,而凋亡神经元细胞核在显微镜下则显示为不均一的紫色,即为TUNEL阳性。显微镜下计数视野内凋亡神经元细胞。
1.2.4TTC染色测定小鼠脑梗死体积
小鼠迅速断头并取出脑组织,于-20 ℃冰箱内冷冻20 min后沿冠状位切成2 mm厚的薄片,然后在避光、室温下将脑薄片放于2% TTC溶液中浸泡30 min,后于4%多聚甲酸溶液中固定24 h,拍片后运用Image-Pro Plus7.0图像处理软件测定脑梗死体积。
1.2.5RT-PCR测定小鼠脑组织的胶质纤维酸性蛋白(GFAP)和信号转导与转录激活因子3(STAT3) mRNA相对表达水平
取小鼠缺血侧大脑组织,称量脑组织并加入TRIzol试剂后用匀浆器匀浆,完成低温离心、氯仿抽取、75%乙醇洗涤和焦碳酸二乙酯(DEPC)水溶解,然后进行总RNA浓度测量、RNA定量、稀释、逆转录成cDNA;加入GFAP引物(上游引物5′-TGG AAA TGA CAG TGA AGC ACC TC-3′,下游引物5′-TCG TTC ATG CAC TCG CTG AAG-3′)、STAT3引物(上游引物5′-CCA TTG GGC CAT CCT GTT TCT-3′,下游引物5′-AGA AAC AGG ATG GCC CAA TGG-3′)后使用CFX Connect Real Time PCR仪进行PCR反应,检测各组GFAP mRNA和STAT3 mRNA的相对表达水平。
1.2.6Western blot检测小鼠脑组织Notch1、Hes1、Hes5蛋白的相对表达水平
将小鼠在冰上迅速断头后取出缺血侧大脑组织,称重后加入裂解液匀浆,取经离心处理的上清液备用;用BCA法测定蛋白质浓度,取等量蛋白行十二烷基硫酸钠-聚丙烯酰氨凝胶(SDS-PAGE)电泳,电转至聚偏氟乙烯(PVDF)膜上;用脱脂奶粉(50 g/L)在室温下封闭2 h,然后分别加入Hes1、Hes5、Notch1(1∶1 000)及β-actin(1∶2 000)一抗,并在4 ℃恒温孵育过夜;加入二抗(1∶2 000)后在室温下孵育1 h,然后洗膜、避光条件下滴加ECL显影,使用化学发光成像系统分析。以标准参照条带为基准,采用Syngene Bio Imaging检测系统分析目的条带灰度值,计算各目的蛋白的相对表达水平。
1.2.7ELISA检测小鼠脑组织IL-1β、TNF-α的水平
取小鼠缺血侧脑组织加入裂解液后用匀浆器匀浆,完成离心处理后取上清液备用,分别按照IL-1β、TNF-α ELISA试剂盒说明书方法,由有检测资质的实验员进行测定。
1.3 统计学处理
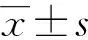
2 结 果
2.1 小鼠神经功能缺损情况
Longa生物学评分结果显示,假手术组Longa生物学评分为0分(无神经功能缺损症状);模型组Longa生物学评分为(2.12±0.39)分,神经功能缺损较对照组加重,而DAPT预处理组Longa生物学评分[(1.29±0.25)分]显著低于模型组,差异有统计学意义(P<0.01),见图1。
a:P<0.01,与模型组比较;b:P<0.05,与假手术组比较。
2.2 小鼠神经元细胞凋亡及脑梗死体积比较
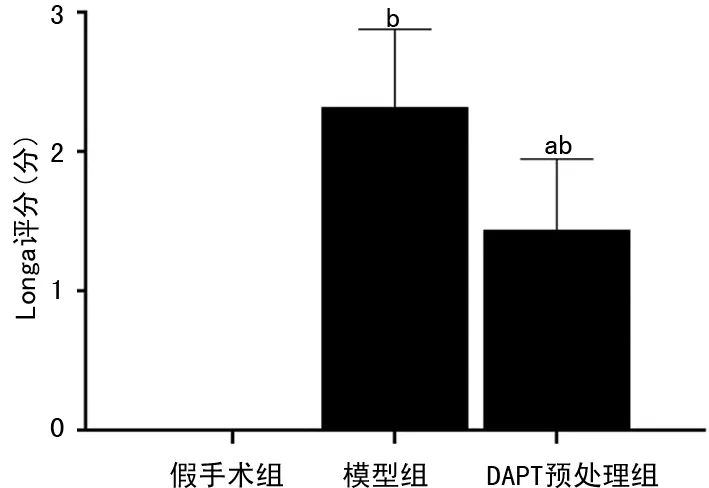
TUNEL染色评估神经元细胞凋亡结果显示,DAPT预处理组、模型组、假手术组的神经元细胞凋亡数分别为(33.60±2.41)个、(75.00±2.74)个、(4.00±1.58)个,3组组间比较差异有统计学意义(P<0.05),见图2。TTC染色检测的结果显示DAPT预处理组、模型组、假手术组的脑梗死体积分别为(19.87±1.18)mm3、(42.37±0.85)mm3、0 mm3,3组组间比较差异有统计学意义(P<0.05),见图3。
2.3 小鼠脑组织GFAP和STAT3 mRNA相对表达水平比较
qRT-PCR检测结果显示,模型组GFAP和STAT3 mRNA相对表达水平较假手术组明显升高(P<0.05),而DAPT预处理组GFAP mRNA和STAT3 mRNA相对表达水平较模型组显著降低(P<0.05),但仍高于假手术组(P<0.05),差异均有统计学意义,见图4。
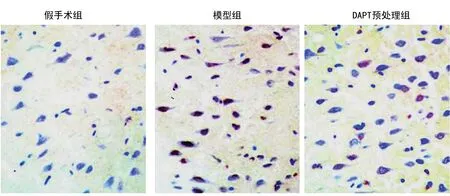
图2 TUNEL染色显示各组神经元凋亡情况(X400)
图3 TTC染色显示各组脑梗死情况

a:P<0.01,与模型组比较;b:P<0.05,与假手术组比较。
2.4 Hes1、Hes5及Notch1蛋白相对表达水平比较
Western blot检测结果显示,模型组Hes1、Hes5及Notch1蛋白相对表达水平明显高于假手术组(P<0.05),DAPT预处理组Hes1、Hes5及Notch1蛋白相对表达水平较模型组显著降低(P<0.05),但仍高于假手术组(P<0.05),差异均有统计学意义,见图5。
2.5 IL-1β、TNF-α结果比较
ELISA检测结果显示,模型组IL-1β、TNF-α较假手术组明显升高(P<0.05),DAPT预处理组IL-1β、TNF-α表达水平较模型组显著降低(P<0.05),但仍高于假手术组(P<0.05),差异均有统计学意义,见图6。

A:Western blot;B:Western blot分析图。a:P<0.01,与模型组比较;b:P<0.05,与假手术组比较。
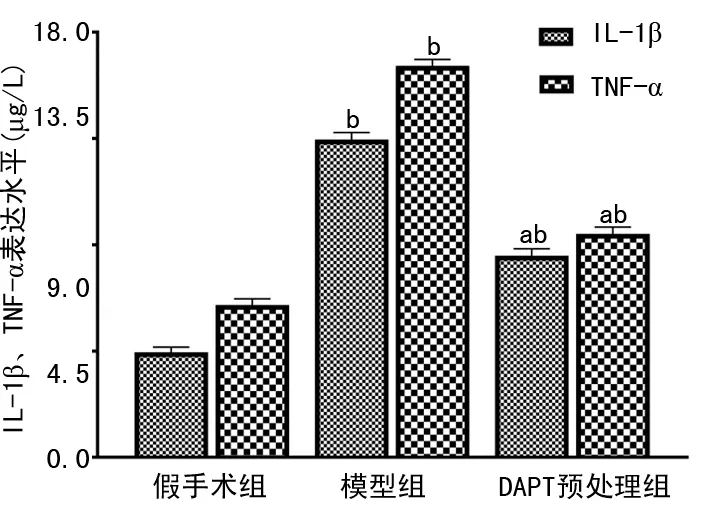
a:P<0.01,与模型组比较;b:P<0.05,与假手术组比较。
3 讨 论
缺血性脑卒中导致的再灌注损伤危害极大,而Notch信号通路已被发现在脑缺血/再灌注损伤中起着重要的调节作用[5]。神经祖细胞增殖、迁移、分化和凋亡被具有高度保守性的Notch信号通路精确调控,Notch信号通路在细胞生长和生理功能等方面发挥着至关重要的作用[6]。研究显示,邻近细胞的Notch受体与配体相互作用而产生Notch信号,通过3次裂解Notch受体蛋白形成胞内段,Hes1、Hes5等下游靶基因被CSL结合蛋白与进入细胞核的胞内段结合形成的转录激活复合体激活,从而发挥生物学效应[7]。
DAPT是最常用的γ-分泌酶抑制剂,它作用于Notch受体S3蛋白水解酶切割位点,阻止胞内段的形成,抑制Notch信号通路下游效应分子Hes1、Hes5表达,进而使神经祖细胞向神经元细胞分化[8]。研究显示,脑缺血/再灌注损伤激活Notch信号通路会使神经元细胞凋亡加剧,而脑缺血/再灌注的细胞凋亡效应在使用Notch信号阻断剂后显著减轻[9]。本研究通过DAPT预处理抑制脑缺血/再灌注小鼠的Notch信号通路,探讨其对脑缺血/再灌注损伤小鼠的作用。结果显示,模型组出现明显神经功能缺损,TUNEL染色示大量凋亡神经元细胞,TTC染色示右侧大脑半球大面积梗死,并且Notch1、Hes1和Hes5 蛋白表达水平明显升高。然而DAPT预处理组神经功能缺损较模型组明显减轻,凋亡神经元细胞及脑梗死面积显著减少,而且Notch1、Hes1及Hes5 蛋白表达水平显著降低,由此说明Notch信号通路被DAPT抑制,DAPT预处理能减少脑缺血/再灌注损伤小鼠的神经元凋亡细胞与促进神经功能恢复,这与王晗等[10]的研究结果一致。
STAT3是一种具备信号转导和转录功能并广泛存在于中枢神经系统的DNA结合蛋白,对脑缺血/再灌注损伤导致的炎性反应有一定调控作用,激活的STAT3进入细胞核内启动其下游基因转录,进而促进炎性因子IL-1β、TNF-α等表达[11]。WU 等[12]报道,抑制STAT3信号通路使炎性因子的表达水平降低,可减轻脑缺血/再灌注损伤的炎性反应。DING 等[13]靶向抑制STAT3信号通路减轻了脑缺血/再灌注大鼠的神经炎性损伤。本研究结果显示,模型组IL-1β、TNF-α及STAT3 mRNA表达水平较假手术组显著增加,表明脑缺血/再灌注使抗炎能力减弱,神经损伤加重,但DAPT预处理组IL-1β、TNF-α及STAT3 mRNA表达水平较模型组明显降低。由此可见,DAPT预处理抑制Notch信号通路可以通过降低STAT3的活化,提高脑缺血/再灌注损伤小鼠的抗炎能力,从而产生神经保护作用。
GFAP是星形胶质细胞的标志物之一,它特异地存在星形胶质细胞中并反映星形胶质细胞的活性。过度活化的星形胶质细胞会在病灶周围形成胶质瘢痕,同时分泌硫酸软骨素蛋白多糖,它们均会抑制轴突再生,阻碍神经功能恢复[14]。WANG 等[15]研究表明,抑制星形胶质细胞过度活化和胶质瘢痕形成可通过抑制GFAP基因表达来实现,从而改善脑缺血后神经功能。DZAMBA 等[16]研究发现,使用反义GFAP mRNA技术抑制星形胶质细胞过度活化能减少星形胶质细胞肥大与促进神经元轴突生长。本研究结果显示,模型组的GFAP mRNA表达水平显著高于假手术组,然而,DAPT预处理组GFAP mRNA表达水平较模型组明显降低,表明脑缺血/再灌注后星形胶质细胞过度活化被DAPT预处理抑制,提示抑制Notch信号通路可能通过抑制GFAP过度表达来发挥神经保护作用。
综上所述,DAPT预处理能明显减轻脑缺血/再灌注小鼠的神经功能缺损,减少神经元凋亡、脑梗死体积及减轻炎性反应,对脑缺血/再灌注损伤有神经保护作用,其可能机制为DAPT预处理通过抑制Notch信号通路来减弱STAT3活化与抑制GFAP过度表达。

