重组人促红细胞生成素对创伤性脑损伤大鼠炎性因子及线粒体损伤的影响
詹亚琨罗 艳邹 蓓
(1.南昌大学第二附属医院急诊科, 南昌 330006; 2.南昌大学第二附属医院影像中心,南昌 330006;3.南昌大学第二附属医院检验科,南昌 330006)
创伤性脑损伤(traumatic brain injury,TBI) 是临床上最常见的神经外科疾病之一[1]。临床上主要表现为眩晕、头痛或者意识障碍,进而导致各种神经功能障碍、运动障碍甚至丧失生活自理能力[2]。目前造成TBI 的主要因素是交通事故和暴力事件。因其后期的高致死率、高致残率,给患者的家庭以及社会都带来沉重的负担。因此寻找可靠的治疗手段,恢复患者的神经功能,提高患者的生存率,已成为神经外科领域的研究重点。研究表明[3]创伤性脑损伤后脑组织的炎症反应是后期病程发展中最重要的病理改变。Hinson 等[4]研究指出TBI 后神经细胞的线粒体功能障碍参与了脑损伤后的病理演变的全过程。因此从目前神经外科医治手段出发,寻找药物控制炎性反应以及降低或者缓解神经细胞的线粒体障碍已成为控制创伤性脑损伤病程发展的有效途径[5]。重组人促红细胞生成素(recombinant human erythropoietin,rhEPO)是临床上治疗由肾功能不全引起的贫血的常用药物。药理学研究表明[6]rhEPO 具有抗氧化、抗细胞凋亡、以及促进神经细胞再生的作用。近年来研究证明[7]rhEPO 在TBI 中具有脑组织保护的作用,对中风、脑出血、以及创伤性脑损伤等神经系统疾病具有潜在的治疗作用。周龙等[8]研究证明rhEPO 能够减轻TBI 小鼠的脑损伤,抑制炎症反应,改善T 细胞平衡。因此本研究通过建立创伤性脑损伤大鼠模型,从rhEPO 对线粒体以及炎性反应的角度来探讨rhEPO 对创伤性脑损伤神经细胞的保护机制,为日后的临床研究提供实验基础。
1 材料和方法
1.1 实验动物
36 ~40 月龄,SPF 级,280 ~ 320 g,雄性 SD 大鼠共计60 只,提供自我院实验动物实验中心[SCXK(赣)2018-0009],依照我院实验动物管理办法,所有大鼠在本院动物房中[SYXK(赣)2018-0003],室温 18℃ ~25℃,湿度在(56±5)%内,适应性喂养一周后进行实验;本研究中涉及动物的实验操作中给与动物人道的关怀按3R 原则进行,并经本院实验动物管理伦理委员会批准(IACUC-2019-093)。
1.2 主要试剂与仪器
重组人促红细胞生成素(Recombinant human erythropoietin,rhEPO)采购自北京四环生物制药有限公司;Rh123 染色剂采购自Sigma 公司;动力相关蛋白1(Drp-1)、分裂蛋白 1(Fis-1)、融合蛋白 2(Mfn 2)、视神经萎缩蛋白1 (Opa 1)抗体采购自美国Abcam 公司;BCA 蛋白浓度测定试剂盒、3,3’-二氨基联苯胺(3,3’-diaminobenzidine,DAB)化学发光试剂盒采购自南京建成生物技术有限公司;IL-1β、IL-6 和 TNF-α 抗体采购自美国 (Cell Signaling Technology,CST)公司;实验用动物麻醉剂5%戊巴比妥钠(德国进口分装,每瓶250 g)采购自北京化学试剂公司;冰冻切片包埋剂采购自美国樱花公司。
1.3 实验方法
1.3.1 创作性脑损伤大鼠模型的制备以及实验分组处理
将已进行适应性喂养的大鼠随机分为假手术组(sham 组)模型组、rhEPO 干预组(治疗组),每组20 只,其中模型组、治疗组采用改良过的Feeney 自由落体撞击大鼠头部来建立创伤性大鼠模型:将戊巴比妥钠(5%,0.15 mL/100 g)腹腔注射以麻醉大鼠,将大鼠以俯卧位固定,沿颅骨正中线行纵切口,暴露右侧顶骨,在矢状缝旁开2 mm 处,以颅骨钻造一个直径5 mm 的孔。使用致伤力度为20 g 的小锤从50 cm 的高度自由落下,以制成大鼠右侧大脑脑挫裂伤,保持大鼠硬脑膜完整,止血结束后无菌手术针缝合;本实验中动物实验处理手段符合动物伦理学标准。sham 组大鼠除不撞击操作外,其余同上。术后各组大鼠均出现不同程度的肢体抽搐,四肢平衡协调性变差,呼吸不规则,瞳孔扩大或缩小,瞳孔对光反应减弱,睫毛反射、刺痛反应以及角膜反射消失,部分出现口腔或鼻腔出血现象甚至暂时性昏迷,但经行为学观察各行为异常在30 min 内恢复认定造模手术成功。在造模结束后,治疗组每日定时以5000 IU/kg 剂量rhEPO 进行腹腔注射,sham组和模型组腹腔注射等剂量生理盐水,连续给药7 d后处死大鼠,并且断头取脑,将各组大鼠的全脑组织在5%多聚甲醛中进行室温固定,48 h 后,以大鼠挫伤灶为中心,以2 cm 为半径,切取2 mm 厚的标本,常规脱水后,以液氮封存,置于深冷冰箱中待测。实验过程中 sham 组死亡2 只,模型组死亡3只,治疗组死亡1 只,最终每组均纳入15 只大鼠进行统计分析。
1.3.2 HE 染色观察各组大鼠脑组织病理学形态变化
从深冷冰箱中取出各种大鼠的脑组织标本,在分析天平上分别称取100 mg,制成5 μm 厚度大小的切片,HE 染色,US-2018 荧光显微镜观察各组大鼠脑组织损伤情况。
1.3.3 各组大鼠脑组织线粒体膜电位的检测
取各组大鼠的脑组织样品,在分析天平上分别称取100 mg,常规方法固定,常规裂解后,制成单细胞悬液,按Rh123 试剂盒要求进行染色,清洗,US-2018 荧光显微镜下观察,细胞核周围绿色的亮点即为摄取了Rh123 的线粒体。对图像中的绿色荧光强度使用图像软件Image J 1.41 进行统计分析。
1.3.4 透射电镜观察各组大鼠脑组织细胞的线粒体超微结构改变
从深冷冰箱中取出各种大鼠的脑组织标本,在分析天平上分别称取100 mg,将大鼠脑组织制成超薄组织切片:①用30%聚甲醛和0.05%锇酸将其固定1 h。②无菌脱水5 min。③置于预冷4℃乙醇3 min。④环氧树脂 812 浸透 5 min,石蜡包埋。⑤铀铅进行双重染色,制成50 nm 的超薄切片,上透射电镜观察,应用Simple-PCI8.0 图像软件进行分析,获取大鼠脑组织细胞的线粒体比表面积、体密度、数密度、以及比膜面积等参数。
1.3.5 免疫组化检测组各组标本中IL-1β、IL-6 和TNF-α 的表达
从深冷冰箱中取出各种大鼠的脑组织标本,在分析天平上分别称取100 mg,根据免疫组化试剂盒要求进行固定,包埋,切片,抗原修复,封闭,清洗,滴入一抗,孵育,加入二抗,显色,复染,脱水,封片,显微镜下观察。用MetaMorPH 图像软件进行系统分析 IL-1β、IL-6 和 TNF-α 的阳性细胞比例。
1.3.6 蛋白免疫印迹检测 Drp-1、Fis-1、Mfn 2、Opa 1 的表达水平
从深冷冰箱中取出各种大鼠的脑组织标本,在分析天平上分别称取100 mg,常规提取总蛋白及测定其浓度,取50 μg 蛋白上样,经凝胶电泳,转膜,封闭,分别加稀释好的一抗(1 ∶1000),4℃过夜孵育。次日,加适量二抗(1 ∶5000), 洗膜,显色,拍照及灰度扫描,以GAPDH 作为内参蛋白,Image J 软件分析条带的灰度值。
1.4 统计学方法
采用软件SPSS 19.0 进行实验数据的统计分析,采用平均数±标准差(±s)进行来表示符合正态分布的计量资料,采用单因素方差分析进行多组间比较,采用独立t检验进行两两组间比较,当P<0.05 表示具有统计学意义。
2 结果
2.1 HE 染色
HE 观察各组大鼠脑组织病理变化如图1 所示,sham 组大鼠脑组织结构清晰,细胞排列规则,无肿胀,无出血等现象,未见炎性细胞浸润。模型组大鼠脑组织脑水肿严重,可见明显的出血坏死病灶,病灶区可见大量变性环死的神经细胞,病灶周围可见大量的炎性细胞浸润,并且细胞核固缩明显,细胞间隙增大,细胞基质疏松。治疗组大鼠脑组织脑水肿明显减轻,病灶区及水肿区明显变小,坏死细胞减少,炎性细胞浸润较少。
2.2 各组大鼠脑组织线粒体膜电位的检测
本研究采用罗丹明123(rhodamine 123,Rh123)荧光染色来检测线粒体膜电位(mitochondrial membrane potential,MMP)的变化,进而能够反映细胞线粒体结构的完整性。Rh123 染色结果如图2 所示,与sham 组相比,模型组大鼠脑组织细胞Rh123荧光强度明显减弱(P<0.05),线粒体膜损伤严重;与模型组相比,治疗组脑组织中细胞Rh123 荧光强度明显增强(P<0.05),说明治疗组大鼠脑组织中线粒体损伤有所恢复。
2.3 各组大鼠脑组织中与线粒体动力学相关蛋白的表达
脑组织细胞基质中的线粒体处于动态相对平衡的细胞器,主要通过线粒体内外膜的裂解和融合而改变其形状,使其在长的相互连接的网络状性态和不连接的破碎的性态之间相互转换,细胞生物学上将这中动态平衡过程称为细胞线粒体的动力学[9-10]。动力相关蛋白1(Drp-1)和分裂蛋白1(Fis-1)是调节线粒体膜裂解的主要蛋白,Drp-1 通过接头蛋白Fis-1 相互作用定位在线粒体膜上,进而促进线粒体裂解; 调节线粒体外膜相融合的蛋白是融合蛋白2(Mfn 2),调节线粒体内膜相融合的是为视神经萎缩蛋白1(Opa 1)。
本研究中采用研究采用Western blot 法检测各组大鼠脑组织中 Drp-1、Fis-1、Mfn 2、Opa 1 蛋白的表达水平以进一步提示rhEPO 对脑组织线粒体的作用机制,,结果显示,和sham 组相比,模型组大鼠脑组织中Drp-1、Fis-1 蛋白的表达明显升高(P<0.05),Mfn 2、Opa 1 蛋白的表达明显降低(P<0.05);和模型组组相比,治疗组大鼠脑组织中Drp-1、Fis-1 蛋白的表达明显降低(P<0.05),Mfn 2、Opa 1 蛋白的表达明显升高(P<0.05),见图3。
2.4 透射电镜观察各组大鼠脑组织细胞的线粒体超微结构改变
为更加直观的了解各组大鼠脑组织中线粒体的变化,本研究中采用电镜观察线粒体超微结构,结果如图4 所示,sham 组大鼠脑组织内细胞结构完整,胞膜完整,线粒体形态正常,嵴结构清晰可辨,并且排列整齐,细胞基质内高尔基体、内质网、核糖体等内容物结构完整,清晰可辨,无肿胀、溶解等现象。模型组大鼠脑组织中细胞内容物或肿胀或结构重叠或者破裂,线粒体出现肿胀现象,多数线粒体出现空泡样改变,嵴结构变形或者变少或者缺失,部分线粒体嵴病变成为空泡样嵴,线粒体基膜模糊,整个神经元内线粒体总数量明显减少。治疗组大鼠脑组织内线粒体超微结构有所好转,线粒体空泡样变性明显缓解,稍见肿胀,线粒体的数量明显增多,结构趋于正常,仅有部分线粒体轻度肿胀,线粒体嵴结构的数目和形态也趋于正常,偶见线粒体嵴断裂或消失。
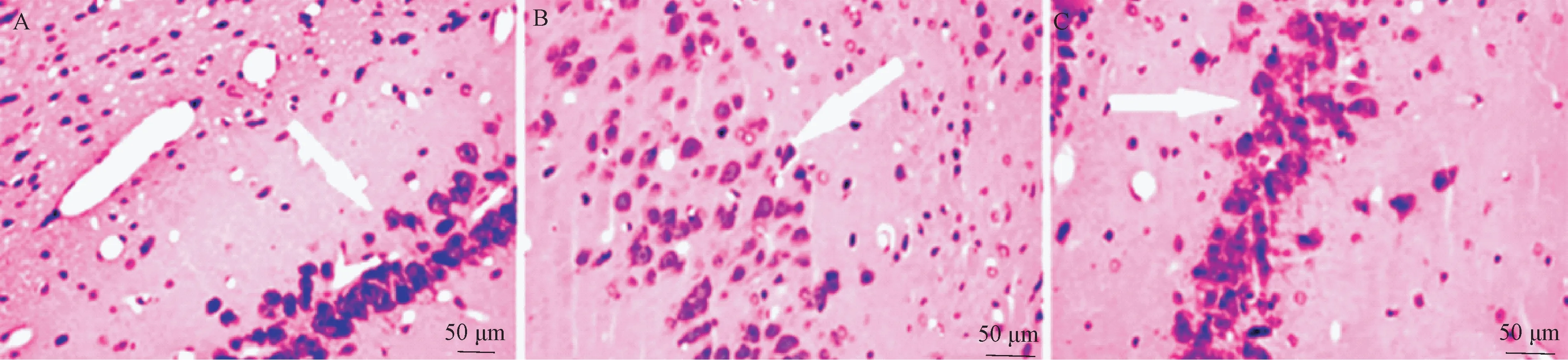
注:A:sham 组;B:模型组;C:治疗组。白色箭头所指为神经元细胞。图1 HE 染色结果Note.A, sham group.B, model group.C, treatment group.The white arrows refer to neuronal cells.Figure 1 The result of HE staining

注:A:sham 组;B:模型组;C:治疗组。与 sham 组相比,∗P<0.05;与模型组相比,#P<0.05。下同。图2 Rh123 染色结果Note.A, sham group.B, model group.C, treatment group.Compared with rats in the sham group, ∗P <0.05.Compared with rats in the model group, #P <0.05.The same as below.Figure 2 The result of Rh123 staining
各组大鼠脑组织线粒体体视学分析如图5 所示,与sham 组相比,模型组脑组织中线粒体的体密度数值、比表面积、比膜面积以及数密度数值均明显减小(P<0.05),说明模型组的线粒体损伤严重;与模型组相比,治疗组线粒体的体密度数值、比表面积、比膜面积以及数密度数值均明显增大(P<0.05),说明治疗组的线粒体损伤有所恢复。
2.5 各组大鼠脑组织中 IL-1β、IL-6 和 TNF-α 的表达
各组大鼠脑组织中 IL-1β、IL-6 和 TNF-α 的表达如图6~8 所示,与sham 组相比,模型组大鼠脑组织IL-1β、IL-6 和 TNF-α 阳性细胞比例出现了明显升高(P<0.05),与模型组相比,治疗组脑组织中细胞 IL-1β、IL-6 和 TNF-α 阳性细胞比例出现了明显降低(P<0.05)。
3 讨论
创伤性脑损伤(TBI)是严重危害人类健康的急性的神经系统疾病。因TBI 所引发的一系列并发症严重影响了TBI 的根治性治愈[11]。研究表明[12]炎性反应,线粒体损伤以及兴奋性氨基酸神经毒性作用使导致TBI 后脑神经功能受损的重要原因。因此寻找一种能有效控制炎性反应或者缓解线粒体功能障碍的的药物或者治疗手段是改善TBI 患者治疗及预后的的关键所在。

图3 Western blot 检测结果Figure 3 Result of Western blot
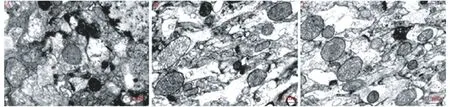
图4 电镜观察结果Figure 4 Result of electron microscope
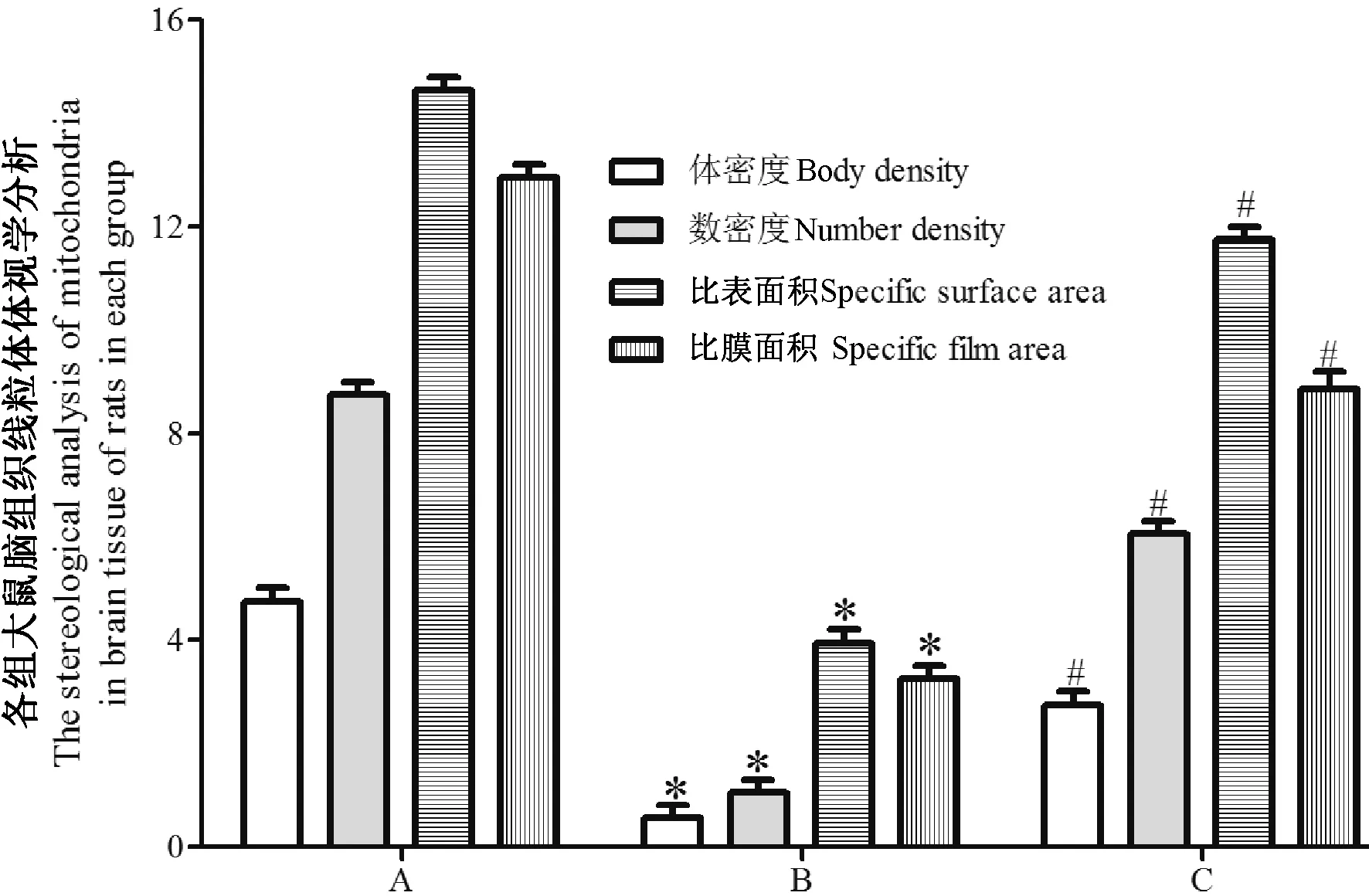
图5 各组大鼠脑组织线粒体体视学分析Figure 5 Stereoscopic analysis of mitochondrial in brain tissue of rats in each group
重组人促红细胞生成素(rhEPO)是体内调节红细胞生成的糖蛋白。大量的动物模型实验证明[13]rhEPO 在神经保护方面发挥了抗氧化、抗炎症、减轻脑水肿、抗兴奋性毒性,以及促血管新生、血脑屏障保护的作用。随着临床研究的进展,rhEPO 在创伤性脑损伤和缺血性脑卒中发挥的的神经保护引起关注。段淼等[14]研究报道rhEPO 能够改善脑损伤后新生大鼠的认知功能。杨利辉等[15]连续3 周给与急性缺血性脑卒中患者皮下注射rhEPO,发现rhEPO 能减少急性缺血性脑血管病患者的梗死面积,改善其临床疗效。已有临床研究证实[16]rhEPO能够抑制炎性反应,抑制急性脑损伤后的神经细胞的凋亡和具有促进血管生成的作用。但是有关rhEPO 在TBI 后脑损伤的线粒体功能障碍中的作用少见报道。
本研究中采用改良过的Feeney 自由落体撞击大鼠头部来建立创伤性大鼠模型[17],造模操作过程简便易行,造模结束后HE 观察模型组大鼠脑组织脑水肿严重,可见明显的出血坏死病灶,病灶区可见大量变性环死的神经细胞,病灶周围可见大量的炎性细胞浸润,并且细胞核固缩明显,细胞间隙增大,细胞基质疏松,TBI 症状明显。采用rhEPO 治疗后,治疗组大鼠脑组织脑水肿明显减轻,病灶区及水肿区明显变小,坏死细胞减少,炎性细胞浸润较少,TBI 症状明显减轻。

图6 免疫组化检测IL-1β 的表达Figure 6 Immunohistochemical detection of the expression of IL-1β
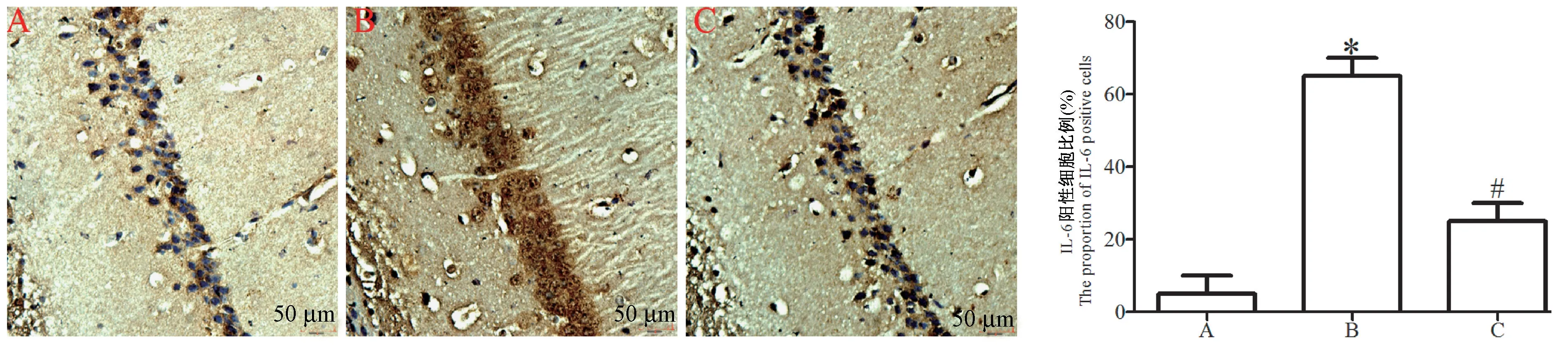
图7 免疫组化检测IL-6 的表达Figure 7 Immunohistochemical detection of the expression of IL-6
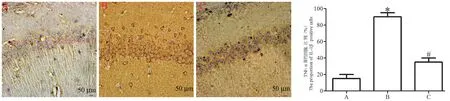
图8 免疫组化检测TNF-α 的表达Figure 8 Immunohistochemical detection of the expression of TNF-α
线粒体是细胞的“power house”,是细胞进行能量代谢的主要场所。因此线粒体结构的损伤是最能体现细胞病变或者损伤的指标[18]。本研究中采用Rh123 染色、Wetern blot 法来研究各组大鼠脑组织中线粒体膜电位的变化以及与线粒体动力学相关的蛋白的表达。结果表明:与sham 组相比,模型组大鼠脑组织细胞Rh123 荧光强度明显减弱(P<0.05),脑组织中Drp-1、Fis-1 蛋白的表达明显升高(P<0.05),Mfn 2、Opa 1 蛋白的表达明显降低(P<0.05),说明模型组大鼠脑组织中线粒体膜结构的损伤严重。与模型组相比,治疗组脑组织中细胞Rh123 荧光强度明显增强(P<0.05),脑组织中Drp-1、Fis-1 蛋白的表达明显降低(P<0.05),Mfn 2、Opa 1 蛋白的表达明显升高(P<0.05),说明治疗组大鼠脑组织中线粒体损伤有所恢复。为进一步研究线粒体的的损伤情况,本研究中采用电镜观察线粒体的超微结构的变化并进行体视学分析,结果表明:模型组大鼠脑组织中细胞内容物或肿胀或结构重叠或者破裂,线粒体出现肿胀现象,多数线粒体出现空泡样改变,嵴结构变形或者变少或者缺失,部分线粒体嵴因线粒体外室肿胀扩张,成为空泡样嵴,线粒体基膜模糊,整个神经元内线粒体总数量明显减少。治疗组大鼠脑组织内线粒体超微结构有所好转,空泡样变性明显缓解,稍见肿胀,线粒体的数量明显增多,结构趋于正常,仅有部分线粒体轻度肿胀,线粒体嵴结构的数目和形态也趋于正常,偶见线粒体嵴断裂或消失。各组大鼠脑组织线粒体体视学分析结果表明,与sham 组相比,模型组大鼠细胞中脑组织中线粒体的体密度数值、比表面积、比膜面积以及数密度数值均明显减小(P<0.05),说明模型组的线粒体损伤严重;与模型组相比,治疗组脑组织中神经细胞中线粒体的脑组织中线粒体的体密度数值、比表面积、比膜面积以及数密度数值均明显增大(P<0.05),说明治疗组的线粒体损伤有所恢复。
炎性反应在TBI 进程中发挥了重要的作用。L-1β、IL-6 和 TNF-α 是最常见的炎性因子。有研究报道证明[19]rhEPO 能够明显抑制心脏、肺等脏器损伤后的炎性反应。但未见有rhEPO 与脑损伤后炎性反应的的关系的的报道。本研究采用免疫组化和Wetern blot 法检测炎性因子的表达,结果都表明,与sham 组相比,模型组大鼠脑组织细胞IL-1β、IL-6 和TNF-α 明显升高(P<0.05),与模型组相比,治疗组脑组织中细胞 IL-1β、IL-6 和 TNF-α 明显降低(P<0.05)。说明rhEPO 能明显抑制TBI 后脑损伤的炎性反应。
综上所述,重组人促红细胞生成素可以减轻创伤性脑损伤后的炎性反应,减轻线粒体损伤,从而发挥对创伤性脑损伤后的脑组织的保护作用。但如何将rhEPO 的这种保护作用于临床上靶向治疗创伤性脑损伤后的脑血管疾病,仍需进一步的探索。

