联合检测TTF-1、NapsinA与CK7在肺结节活检中鉴别原发性肺腺癌和转移性腺癌的应用价值
盘日海,于磊,伍小玲
(新兴县人民医院病理科,广东云浮 527400)
肺癌是目前临床上较为常见的恶性肿瘤之一,腺癌是其中最为常见的肺癌病理组织类型,发生比例在35%~50%[1]。由于肺癌患者大部分都在晚期确诊,进行疗效最优的手术治疗为时已晚,因此对原发病灶来源及准确分期进行确诊后选择最合适的放化疗方案对阻断及控制患者病灶起到较为积极的治疗效果。组织学检查可以对转移情况有较好的判断,但由于转移性腺癌形态学较为相似,但不同来源的腺癌在治疗方式上也有着较大的不同[2~3]。近年来免疫组化技术的进步使得有价值抗体在临床上的运用,为明确腺癌的性质及来源提供了较为有效的帮助,因此本文就检测 TTF-1(甲状腺转录因子-1)、NapsinA(天冬氨酸蛋白酶)和CK7(细胞角蛋白7)在肺结节活检中鉴别原发性肺腺癌和转移性腺癌的应用价值进行讨论,详细方法及结果如下。
1 资料与方法
1.1 一般资料
回顾性分析本院2017年1月-2020年1月收治的146例高度怀疑肺癌的患者,根据病理科诊断结果分为两组,原发性肺腺癌组(n=130)及转移性腺癌组(n=16)。两组患者均为女性,原发性肺腺癌组年龄28~63岁,平均年龄(45.12±12.78)岁,癌症病史0.5~12年,平均病史(5.68±6.21)年。转移性腺癌组年龄27~63岁,平均年龄(45.45±12.65)岁,癌症病史0.5~10年,平均病史(5.32±5.85)年。两组一般资料上的差异无统计学意义(P>0.05),具有可比性。
1.2 方法
活检标本均经过甲醛进行固定,经石蜡包埋切片后进行苏木素伊红及单克隆抗体TTF-1、NapsinA和CK7免疫组织化学染色(二步法,用到的抗体均来自北京中杉金桥公司);NapsinA在肿瘤细胞质中呈现出棕黄色颗粒为阳性,CK7在肿瘤细胞质中呈棕黄色为阳性,TTF-1在肿瘤细胞核中呈现出棕黄色或棕褐色为阳性,每张切片高倍镜下(×400)选取10个视野 ,均计数100个瘤细胞 ,对阳性细胞的百分比进行计数。当阳性细胞<10%为阴性,≥10%为阳性。
1.3 观察指标
对比两组的一般资料(肿瘤大小、组织分化、组织学分型、淋巴结转移、肿瘤分期)、影像学表现及TTF-1、NapsinA和CK7免疫组织化学染色情况。
1.4 统计学方法
采用 SPSS19.0 统计软件对研究数据进行处理,计数资料(n,%)采用χ2检验,当P<0.05时认为差异具有统计学意义。
2 结果
2.1 两组一般资料比较
肺原发性腺癌组肿瘤大小>3cm患者人数比例大于转移性腺癌组,差异无统计学意义(P>0.05);两组患者在组织分化上的差异无统计学意义(P>0.05);两组在组织学分型上的差异无统计学意义(P>0.05);两组在淋巴结转移上的差异无统计学意义(P>0.05);两组在肿瘤分期上的差异无统计学意义(P>0.05),见表1。
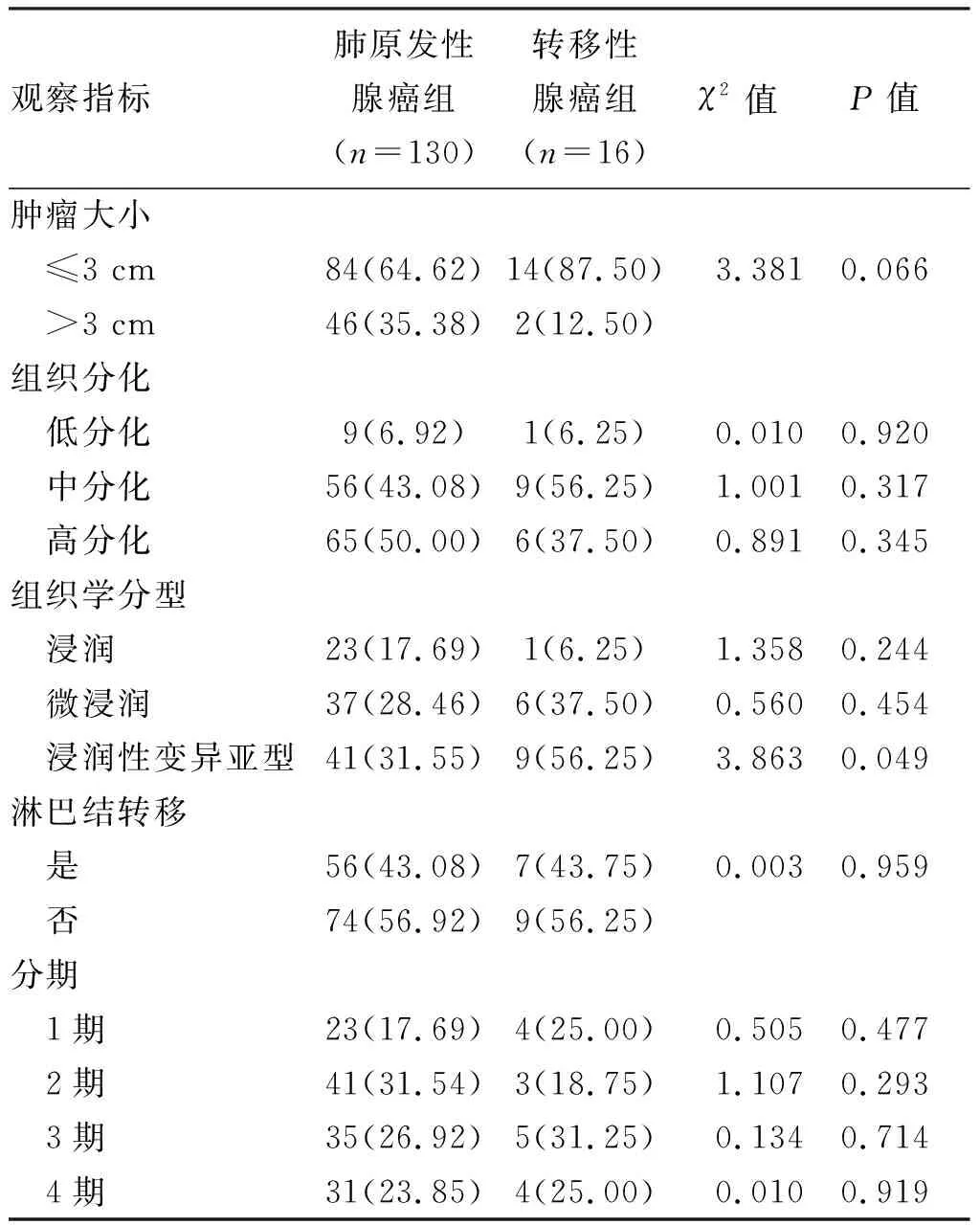
表1 两组一般资料比较(n,%)
2.2 两组影像学表现比较
105例原发性肺腺癌组均为中心型,见图1A;22例原发性肺腺癌组及16例转移性腺癌组为周边型见图1B、C。由表1可见原发性肺腺癌组及转移性腺癌组的影像学形态有交叉部分,有孤立性结节、多发性球形结节、粟粒样结节。且原发性肺腺癌组的孤立性结节多于转移性腺癌,差异具有统计学意义(P<0.05);转移性腺癌组的多发性球形结节发生率大于原发性肺腺癌组,差异具有统计学意义(P<0.05);原发性肺腺癌组及转移性腺癌组在粟粒样结节上的差异无统计学意义(P>0.05)。
2.3 两组TTF-1、NapsinA和CK7免疫组织化学染色比较
TTF-1在肺原发性腺癌组、转移性腺癌组的表达率分别为82.31%(107/130)、6.25%(1/16),见图1D、E;NapsinA在肺原发性腺癌组、转移性腺癌组的表达率分别为79.23%(103/130)、18.75%(3/16),见图1F、G;CK7在肺原发性腺癌组、转移性腺癌组的表达率分别为88.46%(115/130)、56.25%(9/16),见图1H、I。三者在肺原发性腺癌组、肺转移性腺癌组的表达之间差异显著(P<0.05);原发性肺腺癌组患者TTF-1(+)和/或CK7(+)、TTF-1(+)和/或NapsinA(+)、NapsinA(+)和/或CK7(+)为90.00%(117/130),见表2-3。

A:原发性肺腺癌中心型(胸部正位片); B:原发性肺腺癌周边型(CT); C:转移性腺癌周边型(CT); D:肺原发性腺癌TTF-1染色阳性(IHCX100); E:转移性腺癌TTF-1染色阳性(IHCX200);F:肺原发性腺癌NapsinA染色阳性(IHCX100);G:转移性腺癌NapsinA染色阳性(IHCX100); H:肺原发性腺癌CK7染色阳性(IHCX200);I:转移性腺癌CK7染色阳性(IHCX100)

表2 原发性肺腺癌组与转移性腺癌组影像学形态的比较

表3 原发性肺腺癌组与转移性腺癌组影像学形态的比较
3 讨论
很多肺癌患者确诊时已为晚期,甚至在转移后才被发现,因此在明确癌灶来源后的治疗及预后就尤为重要[4]。TTF-1是一种分子量在38KDa~40KDa的核蛋白,存在于胎儿肺组织及成人Ⅱ型肺泡上皮,主要存在于成人甲状腺滤泡上皮、间脑局部、呼吸道上皮,是目前临床上较为常用的肺腺癌诊断标记物[5]。napsinA是一种单链蛋白,分子量将近38 KDa,有研究napsinA在鉴别肺腺癌上的参考价值高于TTF-1,也是一种较高的诊断标记物[6~7]。CK7是一种碱性角蛋白,主要存在于成人肺部、乳腺、卵巢等组织[8],有研究显示CK7也会在卵巢腺癌、肺腺癌中表达增高[9]。因此本研究就TTF-1、NapsinA和CK7进行联合检测对原发性肺腺癌和转移性腺癌的诊断效果进行观察。
本研究结果显示:两组在肿瘤大小、组织分化、组织学分型、组织学分期上的差异没有统计学意义;原发性肺腺癌组的孤立性结节多于转移性腺癌,差异具有统计学意义;转移性腺癌组的多发性球形结节发生率大于原发性肺腺癌组,差异具有统计学意义;原发性肺腺癌组及转移性腺癌组在粟粒样结节上的差异无统计学意义;TTF-1、NapsinA及CK7在肺原发性腺癌组的阳性率均高于转移性腺癌,差异均具有统计学意义;TF-1、NapsinA及CK7联合检测肺原发性腺癌患者的准确率为85.38(111/130)。原因有:两组患者虽然分期及组织学分型上的差异无统计学意义,但由于个人体质上、病程发展上的不同,因此两组在一般资料上的差异无统计学意义,且在影像学表现上的差异也具有一定的差别;文献显示TTF-1常在肺鳞癌中非常常见,与本文研究结果较为接近[10];有研究显示NapsinA对Ⅱ型肺泡上有较高的特异性,与本文结果较为一致[11];而CK7在本文的研究显示在原发性腺癌组、转移性腺癌组的表达率分别为88.46%(115/130)、56.25%(9/16),原因为CK7并不是非常优秀的肺腺癌检验指标,但联合检验显示三种因子对区别原发性腺癌组、转移性腺癌组上的表达最高,已有研究显示TTF-1联合NapsinA可以提高鉴别原发性腺癌组、转移性腺癌的准确[12]。因此,本文研究也显示了TTF-1、NapsinA和CK7进行联合检测对原发性肺腺癌和转移性腺癌具有较为积极的意义,可以增强临床上的诊断。
综上所述,联合检测TTF-1、NapsinA和CK7在鉴别原发性肺腺癌和转移性腺癌上具有积极意义,可以提高早期的诊断率并提高患者预后。

