血浆纤维蛋白原不同检测系统间检测结果的一致性分析及质控品的互通性探讨
洪生静,谢小娟,周伶俐,魏力强(.西安医学院,西安 700;.陕西省人民医院,西安 70068)
纤维蛋白原(fibrinogen,Fib)是血浆中含量最高的一种凝血蛋白,是临床常用的凝血功能检测项目之一。在出血性疾病与凝血功能的评估中具有重要意义,也是指导血浆输注及观察疗效的重要指标[1-2]。近几年发现Fib水平与肿瘤严重程度相关[3-6]。Fib检测结果的一致性对临床做出正确的诊疗决策具有重要影响。由于多种进口和国产的自动化仪器和品种繁多的商品化检测试剂,应用于凝血试验检测,导致不同实验室间的Fib检测结果差异较大,不利于实验室间的结果互认。本研究对Fib 在不同检测系统间检测结果的一致性进行分析,并观察8个厂家凝血质控品在不同检测系统上检测结果的差异,评价其是否具有互通性。
1 材料与方法
1.1 材料
1.1.1 样本来源:40份混合的患者血浆样本,Fib浓度范围约在1.0~5.0g/L 之间。每份样本分装7份,置于−70℃冻存,排除溶血、脂血和黄疸样本。
1.1.2 待评价质控品:日本Sysmex 公司凝血质控品Dade Ci-Trol 1,2,3(编号1,2,3);法国Stago公司凝血质控品STA-Control N+P(编号4,5);美国IL 公司HemosIL High Abnormal control Assayed,HemosIL Normal control Assayed,HemosIL Low Abnormal control Assayed(编号6,7,8);深圳雷杜INR 质控品水平1 和2(编号9,10);北京赛科希德公司凝血非定值质控品水平Ⅰ和Ⅱ(编号11、12);北京众驰伟业凝血质控品正常水平(编号13);上海太阳公司凝血非定值质控品正常值(编号14);成都协和公司正常值凝血质控品(编号15)。
1.2 仪器与试剂 见表1。Sysmex CS 5100,IL ACL TOP 700,STA-Compact,Rayto RAC 1830,Zonci XL1000i,Succeeder SF 8100 全自动凝血分析仪及其各自配套Fib检测试剂、质控物、清洗液、稀释液等;非配套检测系统Sysmex CS 5100 仪器(太阳试剂、太阳质控品)。
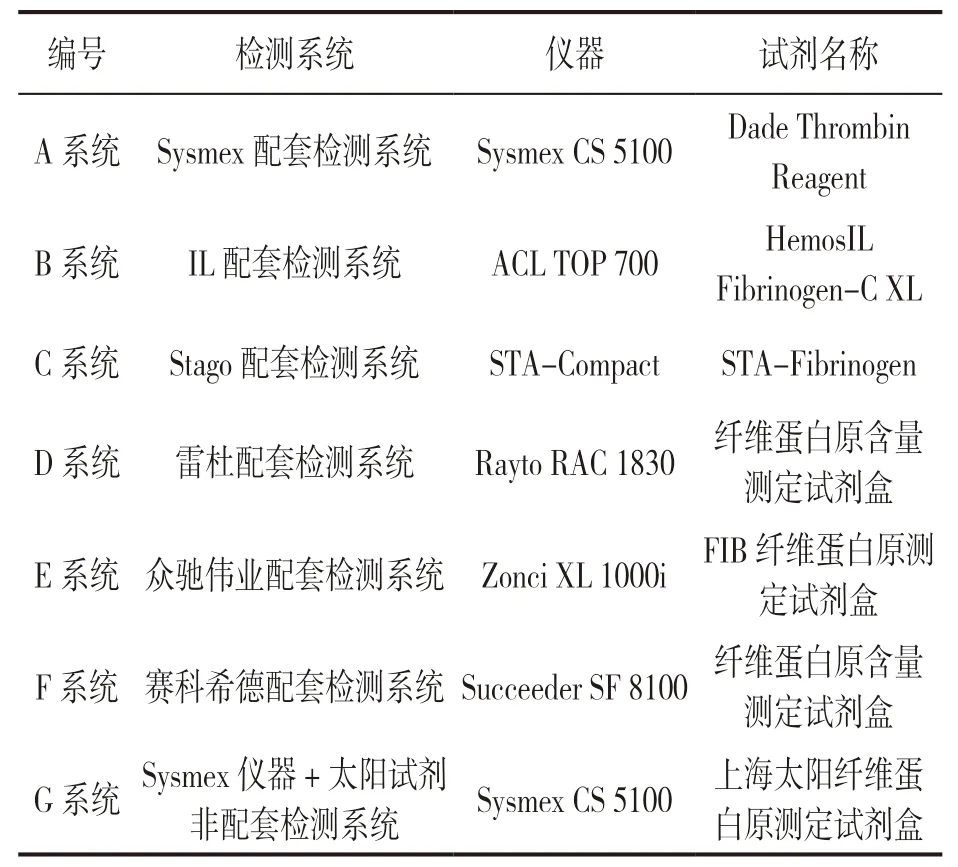
表1 检测系统基本信息
1.3 方法
1.3.1 检测系统的选择:根据2019年陕西省临床实验室凝血试验室间质量评价(EQA)统计结果,选择实验室数大于20 家、且PT 成绩合格的7种检测系统。
1.3.2 凝血质控品和临床样本检测:每个检测系统在检测前做好仪器的校准、室内质控和维护保养工作;将不同品牌商品化的凝血质控品复溶后,与40份临床样本随机穿插排列,然后分别在7个系统上测定所有样本Fib,每个样本重复检测2次。
1.3.3 检测结果分析:按照EP9-A2 文件[7]对实验数据进行检测系统内和检测系统间的离群值检验,剔除离群值,以某一检测系统为评估系统,其检测结果为Y,比对系统测定结果为X,对40份患者血浆样本Fib检测结果作散点图,观察数据分布和拟合回归方程,用评估系统与比对系统的相关系数(r)估计纳入数据范围是否合适,如果r>0.975时认为所选标本浓度范围合适,计算其回归方程;如果r<0.975,可以使用分部偏倚法代替线性回归来估计平均偏差。计算各医学决定水平的预期偏差的95%可信区间,与可接受误差进行比较,判断结果是否具有一致性。总允许误差来自卫生部临检中心的规定,可接受误差为1/2总允许误差,参考医疗机构临床实验室管理办法规定。如果r2≥0.95,认为比对系统和评估系统的结果相关性和一致性较好,回归曲线可用于质控品的互通性分析,按照EP14-A3 文件[8]和《基质效应与互通性评估指南》(WS/T 356-2011)[9]的要求,进行互通性分析及评价;当r2<0.95时,检测系统间的相关性不佳,无法进一步行互通性分析。
1.4 统计学分析 采用Excel 2007 和SPSS 22.0 软件对检测系统间进行回归和相关分析,求得相关系数r、决定系数r2、回归方程(Y=bX+a)。计算不同厂家质控品在各系统间的均值(x)、标准差(s)、变异系数(CV%)。
2 结果
2.1 不同检测系统间Fib检测结果的相关性及一致性分析 参考EP9-A2 文件进行分析,分别以我国主流的三种检测系统(A,B,C系统)作为比对系统,其余检测系统为评估系统计算回归方程和r及r2,见表2、表3、表4。其中各系统间r<0.975,使用分部偏倚法代替线性回归来估计平均偏差,并计算预计偏差。将预期偏差的可信区间与医学决定水平点Xc 处的允许误差的限值相比较,如果预期偏差的可信区间包含了规定的可接受偏差,说明评估系统的偏差小于可接受偏差,检测系统间结果可接受。如预期偏差的可信区间不包含规定的可接受偏差时,可做以下两种判断:①可接受偏差小于预期偏差可信区间的下限,预期偏差大于可接受偏差的概率很高(>97.5%),不能被接受,检测结果间不具有一致性;②如可接受偏差大于预期偏差可信区间的上限,预期偏差小于可接受偏差的机率很高(>97.5%),检测结果间一致性可接受,分析结果见表5,表6,表7。

表2 以Sysmex CS 5100为比对系统与其他检测系统间Fib检测结果的相关性

表3 以IL ACL TOP 700为比对系统与其他检测系统间Fib检测结果的相关性
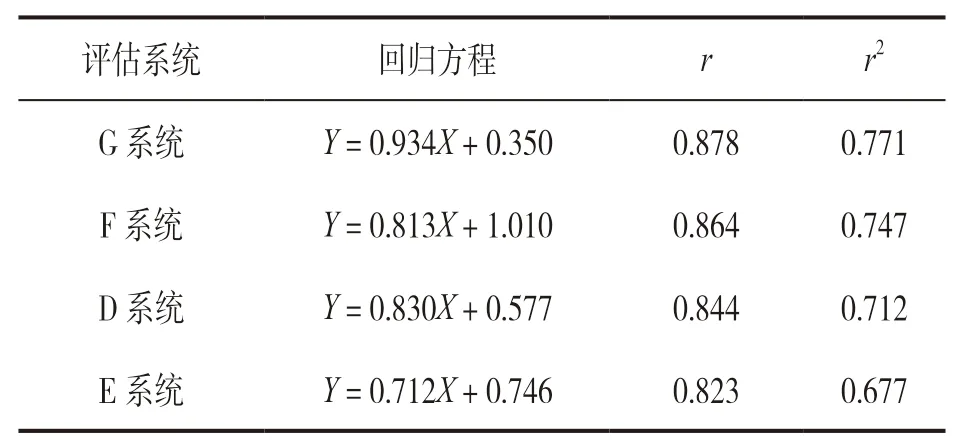
表4 以STA-Compact为比对系统与其他检测系统间Fib检测结果的相关性
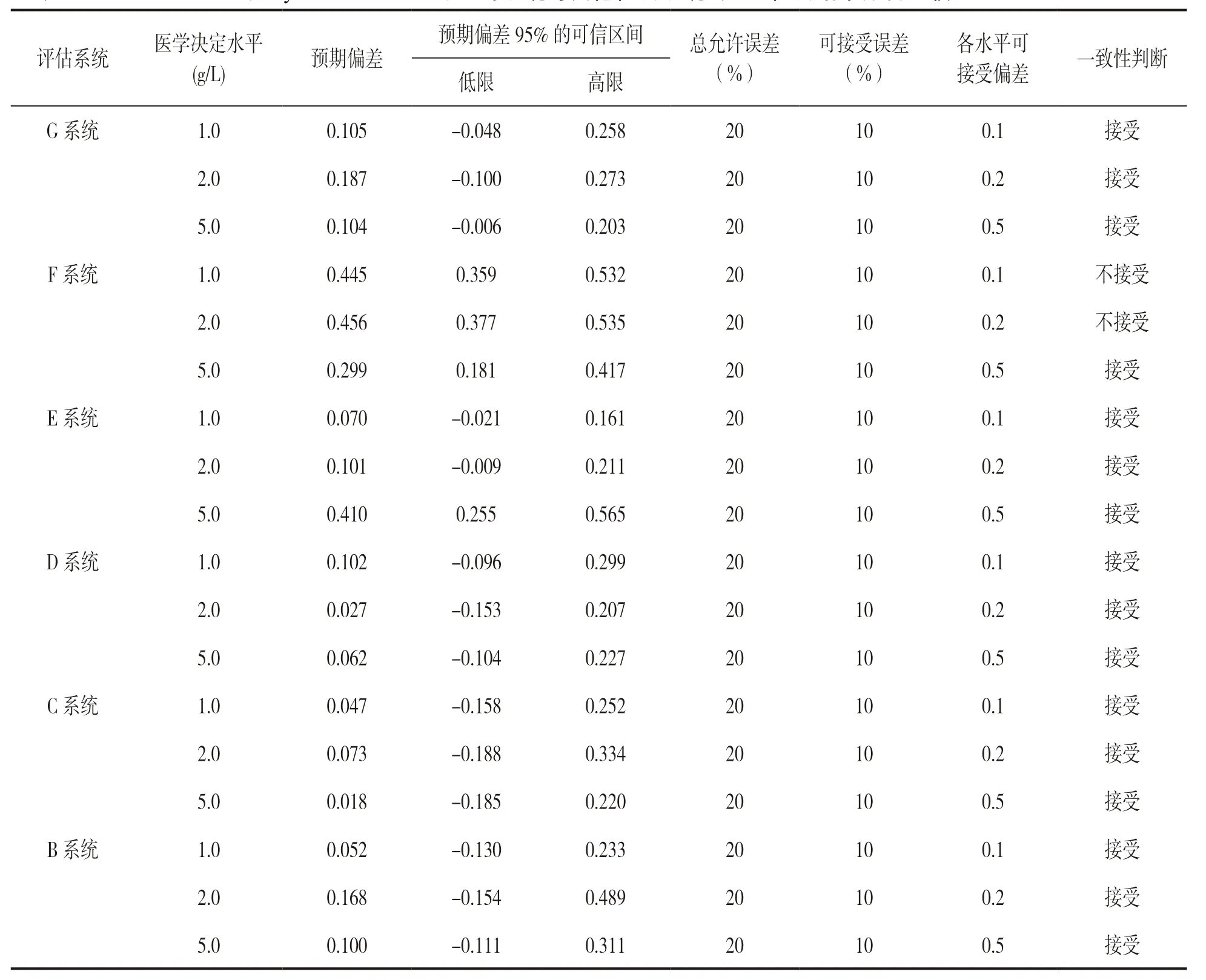
表5 以Sysmex CS 5100为比对系统与其他检测系统间Fib检测结果分析比较
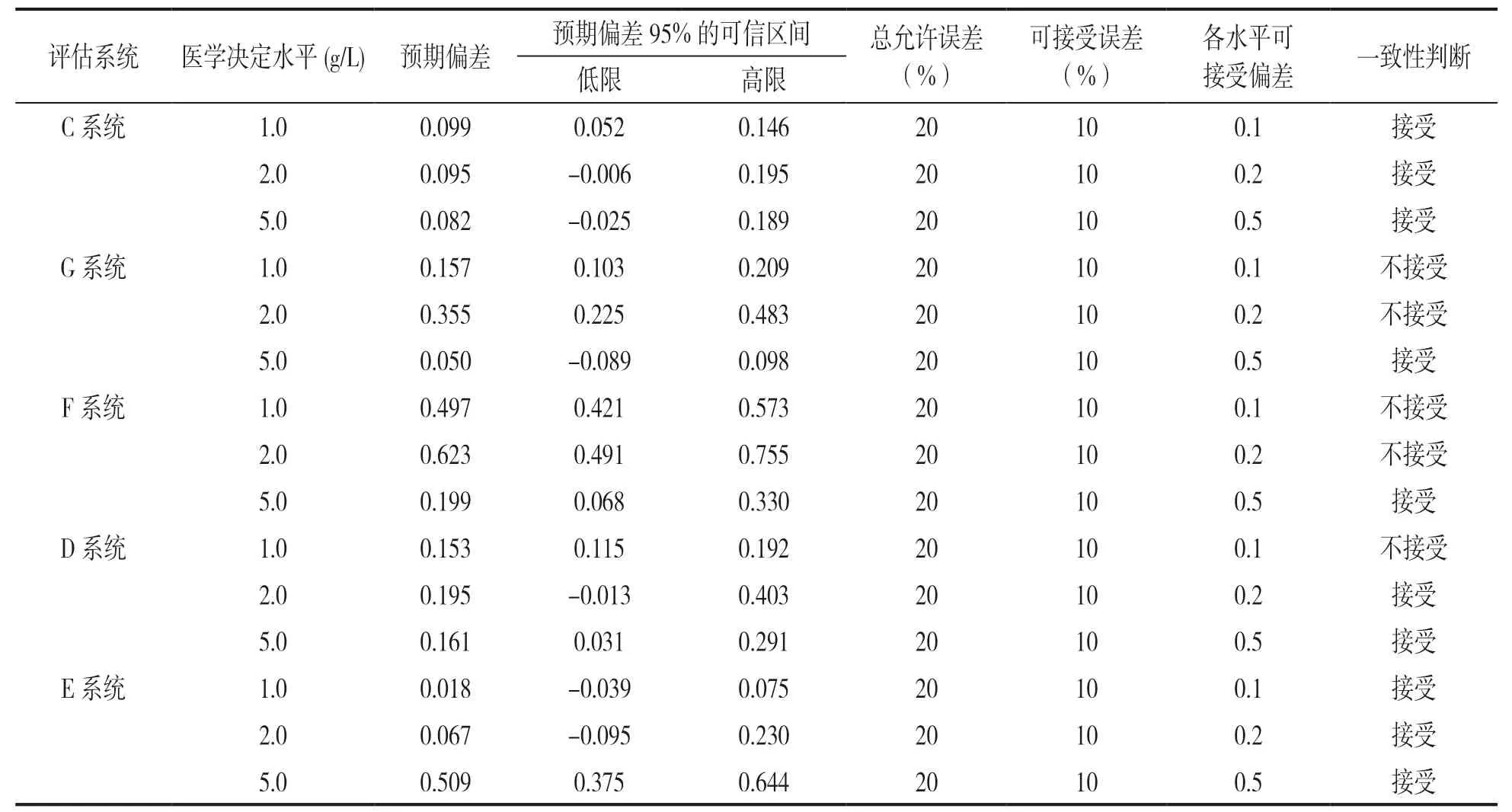
表6 以IL ACL TOP 700为比对系统与其他检测系统间Fib检测结果分析比较
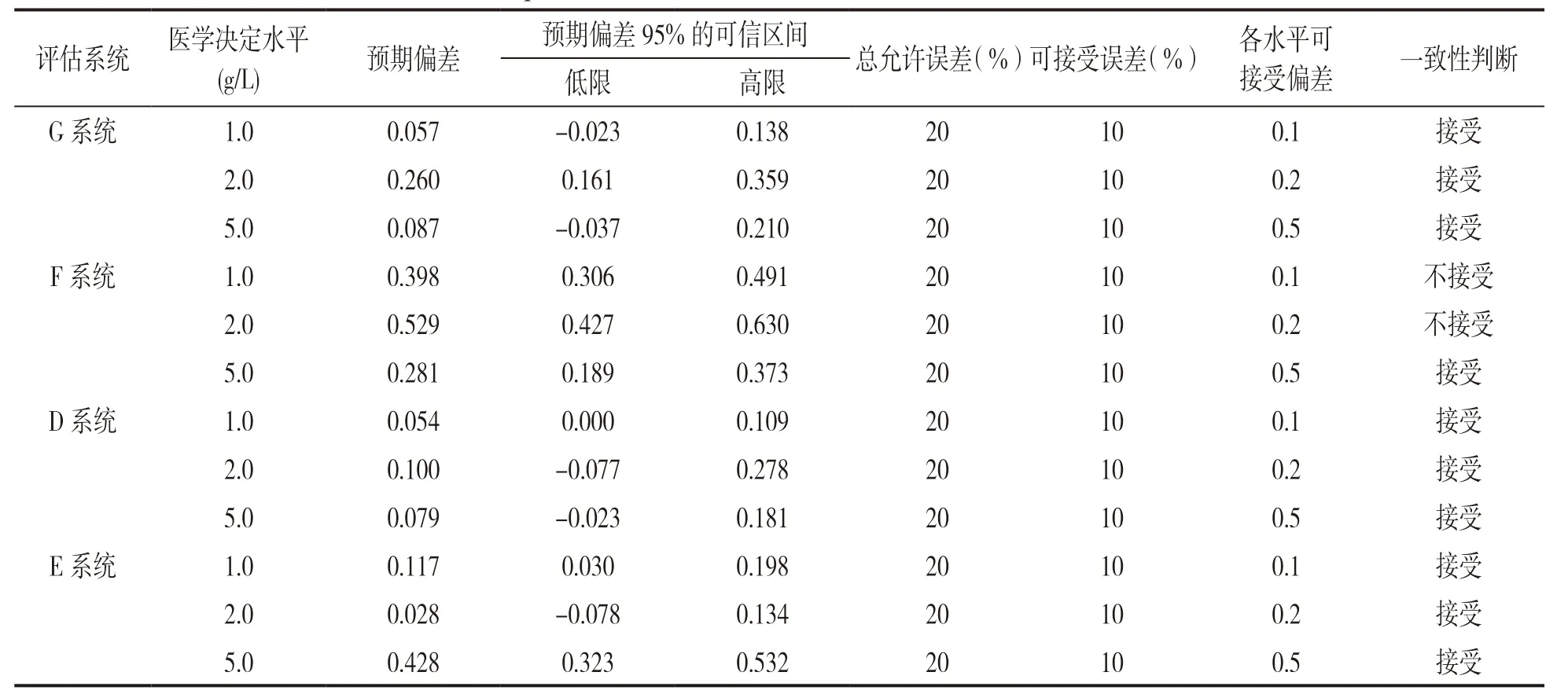
表7 以STA-Compact为比对系统与其他检测系统间Fib检测结果分析比较
2.2 质控品在各系统间的结果差异 见表8。在7种检测系统上对不同厂家质控品重复检测2次。计算各质控品均值(x)、标准差(s)、变异系数(CV%)。8个厂家凝血质控品Fib检测结果均值范围在1.12~2.91 g/L;凝血质控品Fib值<2g/L时,变异系数范围最大(9.34%~14.51%);质控品值处于2~3g/L时,变异系数均小于10%,其中美国IL 公司生产的正常水平质控品(Hemos IL normal control assayed)变异系数最小(CV=5.49%)。可观察到异常低值的凝血质控品变异系数明显高于正常值质控品。本研究中所选择的8个厂家凝血质控品中,对于Fib检测项目无异常高值质控品。
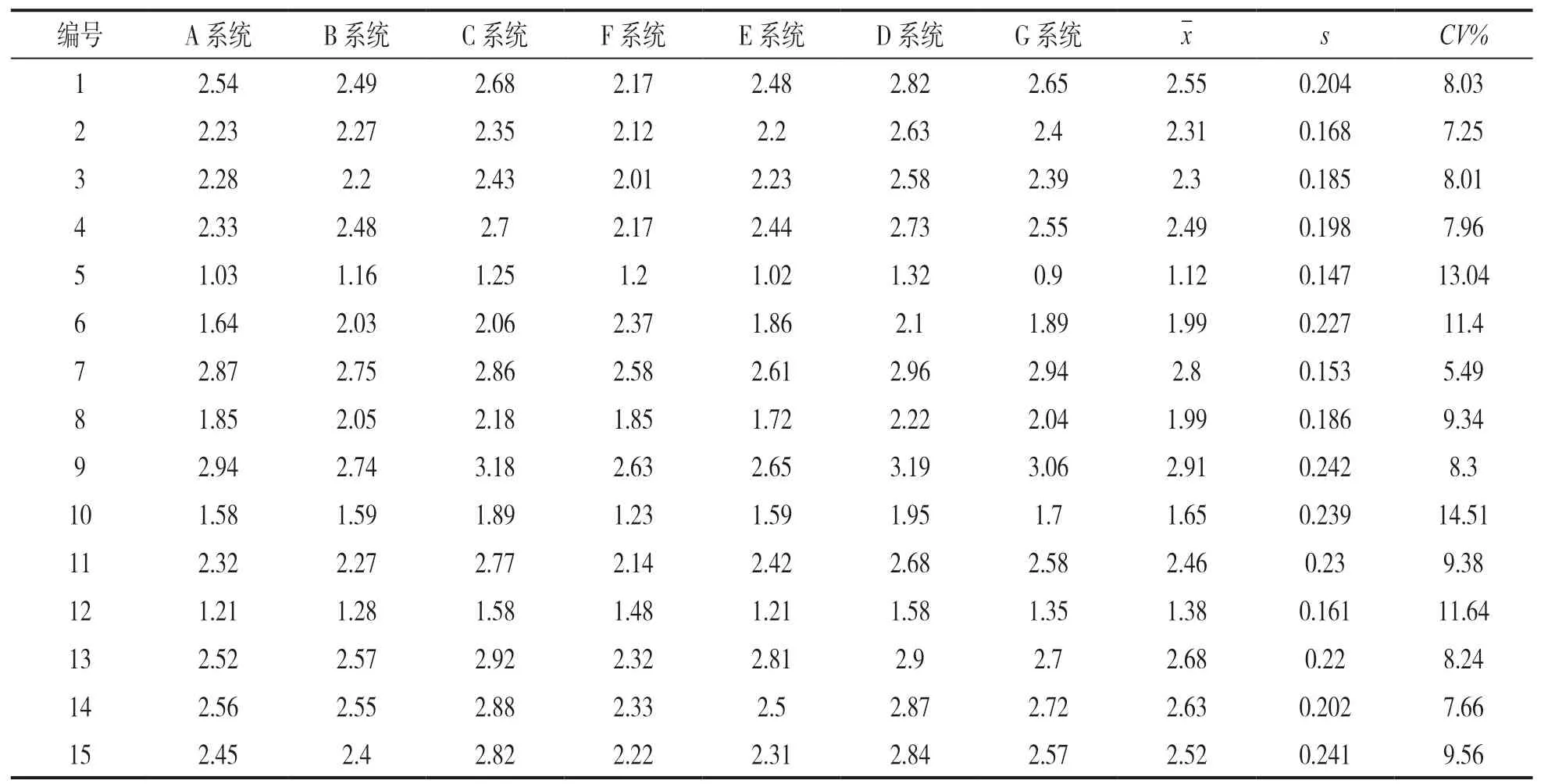
表8 不同检测系统对不同厂家质控品检测结果
3 讨论
本研究中,选择我国主流的三种检测系统(A,B,C系统)作为比对系统时,不同检测系统间对于血浆样本Fib检测结果相关系数不佳(r2<0.95),其中A系统与G系统相关性r2=0.944,这两种检测系统均使用Sysmex CS 5100 全自动凝血分析仪,区别在于使用不同的试剂及质控品。用分部偏倚法来分析各检测系统间Fib 结果临床可接受性能,以Sysmex CS 5100,STA-Compact 配套检测系统作为比对系统时,各检测系统间Fib检测结果偏差小于允许误差,临床可接受(除F检测系统部分结果不被接受);以IL ACL TOP 700为比对系统时,与3个系统(G,F,D)检测结果间存在差异;Fib检测结果在不同检测系统间一致性仍需进一步研究。目前国内外对于不同检测系统测定Fib 结果一致性的研究结论各不相同。SOLOMONL 等[10]报道中基于Clauss 法用不同检测方法测定Fib 结果之间存在差异;张芹等[11]研究表明STAGO-STA 和Sysmex CA1500 全自动血凝仪对凝血四项检测结果的一致性不佳;刘艳红等[12]报道未经过国际标准物质校准前Sysmex CS-5100,Stago STA-R Evolution,IL ACL TOP 700检测系统间测定Fib检测结果可比性(r2<0.95)不满足互通性评价要求。也有学者报道不同血凝分析仪检测结果间的一致性良好,颜存粮等[13]研究表明检测原理基本相同的不同血凝分析仪,其检测结果具有较好的一致性;阳建等[14]报道以ACL TOP700 全自动血凝分析仪作为标准检测系统,Sysmex CA7000 全自动凝血分析仪测定的结果具有临床可接受性,两台血凝仪检测的结果具有良好的相关性。
不同检测系统间Fib 结果存在差异,可能有以下几方面的原因:①Fib检测项目无法溯源至IS 单位,只有约定的两个国际标准品(WHO 09/264)、国际血栓与止血协会科学标准化委员会(SSC/ISTH)凝血标准品(SSSC LOT4),各厂家通过这两个标准品,对各自的检测系统进行校准,而各厂家的溯源物质选择不同,溯源程度不一致,影响检测结果之间的一致性判断。②Fib 尚没有公认的参考方法,本研究中Fib检测原理均为凝固法,其中根据终点判断方法可以分为两大类:光学法和机械法[15]。如本研究中选用美国的IL ACL TOP 700 和北京众驰伟业凝血分析仪其检测方法为光学凝固法,日本Sysmex CS-5100 和深圳雷杜的凝血分析仪均采用散射光比浊法,法国STAGO-STA 和北京赛科希德凝血分析仪检测方法为磁珠法。世界卫生组织第一个国际标准的结果也突出了检测方法之间存在差异的可能性(例如,机械检测的值比光学检测的值更高),检测方法不同是各检测系统之间结果不可比的重要原因之一[10]。③在我国实验室中,非配套检测系统使用是普遍现象,在凝血检测项目中尤甚。多厂商生产的仪器、试剂、校准品组成的非配套检测系统加大了检测结果之间的差异。
为使患者检测结果间趋于一致,促进不同医院实验室的检测结果互认,笔者认为同一个地区或同一实验室最好使用相同的检测系统。临床实验室在使用非配套检测系统前,一定要对该检测系统的检测项目进行性能验证,至少应进行精密度、分析范围、参考范围验证。临床实验室检验报告单上应注明检测系统信息,并应与临床医师及时沟通,确保检测结果的正确应用[16]。
室间质评样本的互通性对客观的评价临床实验室的检测能力尤为重要[17]。国家卫健委和各省市临床检验中心的纤维蛋白原EQA 样本多来自第三方公司商品化的质控品。本研究中,8个厂家的凝血质控品在7种不同的检测系统上Fib检测结果差异显著,CV值在5.49%~14.51%之间,尤其是在异常水平的凝血质控品中Fib检测结果差异大。如果仅使用某厂家的凝血质控品Fib的值,不能评价不同检测系统的检测能力,因此,开展室间质量评价活动时,对检测仪器、试剂、校准品等进行分类分组评价其一致性是相对可靠的方法。需要特别说明的是质评数据分组统计对使用数量少的方法或检测系统存在一定的不确定性,参评实验室成绩不合格很可能是由统计因素引起。在这种情况下,作者建议临床实验室应做好该项目的性能验证和室内质量控制工作来保证患者结果的质量。

