CO 2气体水合物相平衡条件和热力学稳定性研究进展
焦丽君
(1. 青岛职业技术学院海尔学院,山东青岛 266555;2. 中国石油大学新能源学院山东青岛266580)
气体水合物是一种气体分子或低沸点的液体分子,在低温高压条件下形成的,非化学计量的包络状晶体。客体分子如甲烷、二氧化碳、环戊烷、四氢呋喃等,被包络在由主体分子通过氢键形成的晶穴结构中,客体分子与主体水分子之间通过微弱的范德华力相互作用[1]。由于客体分子的尺寸不同,水合物结构主要有三种:sI型、sII型和sH型,如图1所示[2]。CO2气体分子尺寸处于4.3和5.3A之间,通常形成sI型水合物,其理想的化学计量比分子式为CO2· 5.75H2O[3]。当体系中有两种以上的分子时,大分子会优先占据大晶穴,Lee和Kim通过X射线衍射实验发现,当CO2和环戊烷两种客体分子同时存在时,系统形成了sII型水合物,环戊烷完全占据大晶穴,CO2占据小晶穴(晶穴占有率为62%)[4]。对于sII型水合物,当晶穴全部被占据时,化学计量式可以表示为X·5.66H2O。当只有大晶穴被占据时,化学计量式为X·17H20,如环戊烷水合物、R141b水合物、四氢呋喃水合物等。

表1 气体水合物晶体结构
最早被发现是氯气水合物,由Davy在1811年最早提出[5]。之后,人们发现这种水合物是一种非计量的笼形晶体结构,与冰的热力学性质差别较大[6]-[8]。由于气体分子被包络在水分子形成的笼形结构中,于1948年正式命名为包络状水合物(clathrate hydrate)[9]。关于CO2水合物的研究,主要集中在二氧化碳捕集、二氧化碳海底封存、置换法开采甲烷水合物、海水淡化、蓄冷储能等应用领域。随着全球变暖的加剧和能源消耗的急剧增长,二氧化碳捕集和储存技术(CCS)得到了快速发展,其中基于水合物的碳捕集技术,利用CO2比 N2更易进入水合物相的特点[10],促使CO2气体在水合物相富集,完成烟气中的碳捕集,捕集过程中能量损耗低至7%[11]。而且,气体水合物可以作为气体储存和输运的媒介,1m3水合物可以储存150-170m3的气体,具有较大的研究和应用价值。自然界中现存大量的天然气水合物,多存在于冻土区和深海区域。与天然气水合物相比,二氧化碳水合物具有更好的热力学稳定性,而且研究表明CO2- CH4二元水合物的稳定性比其中任何一种单一客体分子的稳定性要好[12]。因此,将二氧化碳注射入海底和冻土区,既可以实现二氧化碳的海底封存,又能置换水合物中的甲烷。此外,二氧化碳水合物晶体中只有水和客体二氧化碳分子,不包括杂质和盐,可以通过水合物的合成和分解过程,实现海水的淡化(HBD)[13]。二氧化碳水合物由于相变温度适宜,相变潜热较大,洁净环保,来源可靠等特点,是一种比较良好的空调蓄冷介质,作为一种相变储能材料(PCM),应用于热能储存系统(TES),通过夜间制冷、白天释冷,实现移峰填谷,可以最大限度的减少能源供应和需求之间的差异[14][15]。
然而,二氧化碳水合物在空调运行期间合成的压力相对较高(相平衡压力区间为1.81-3.82MPa)[16],水合物在生成过程中需要耗费能源提供压力,通过相平衡条件的改善可以缓解和克服这一问题,使水合物更加稳定。研究不同条件下水合物的稳定性,可以为海底封存提供依据,同时采取措施提高水合物的稳定性,使之在相对温和的条件下存在,有利于储能系统的稳定应用,也对确定合适的水合物储存和输运条件具有重要意义。
1 CO 2水合物相平衡条件研究
1.1 CO 2水合物相平衡条件测定方法
气体水合物相平衡测定方法有差示扫描量热法和高压反应釜实验法[17]。差示扫描量热法可以直接测定材料的相平衡温度和分解焓,但是由于测试样本较少,其结果较真实值低。以高压反应釜为反应容器,目前主要通过观察法和图形法来实现相平衡条件的测定。
(1)观察法:
要求水合物反应釜可视,在水合物生成稳定之后,对水合物缓慢加热溶解,当观察到反应釜中仅有微量水合物存在于溶液中时,保持反应釜内状态(压力、温度或体积)不变,如果气体水合物晶体能保持3-5小时,此时反应釜内的压力和温度即为气体水合物相平衡条件。
按照相平衡测定过程中反应釜内设定参数是否变化,可分为等压法、等温法和等容法。其中,等容测量法比较常见:即保持反应釜容积不变,通过控制温度的升降实现水合物的分解和生成过程,通过记录反应釜内的温度和压力,获得相平衡条件。
(2)图形法:
对于没有视窗的反应釜而言,可以采用图形法测定相平衡条件。具体过程如图1所示,首先将反应釜降温至实验温度,此时反应釜内的温度开始下降,当到达水合物的合成温度时,水合物开始生成,放出大量的热量,表现为温度基本不变,同时由于水合物的持续生成,气体被消耗,压力急剧下降,当水合物生成结束,体系温度开始继续下降,直至到达设定温度。稳定一段时间后,调节恒温槽的温度,使反应釜内温度缓慢升高(升温速率低于0.15K/h),水合物开始分解,直到压力-温度的斜率再次发生变化,表明水合物分解基本结束,与初始状态反应过程的交点即为相平衡点(Dissociation point)[18]。
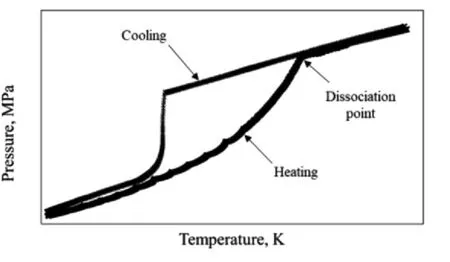
图1 图形法测定相平衡条件
水合物相平衡还可以通过分子动力学模拟的方法测定。Costandy等[19]建立了水合物(2x2x2)-水(368个水分子)-二氧化碳(200个水分子)-水(368个)四层模型体系,使用GROMACS模拟软件,在NPT系综下运行50-400ns。具体方法为:在恒定压力下对不同体系设置不同的温度,模拟体系会在某一温度下合成,而在另外一个温度条件下分解。比如,保持压力为40MPa,温度从260-280K之间设定(每隔5K进行一次模拟,当差别较大时,取中间温度再模拟),相平衡温度就是使水合物分解的最低温度与使水合物生成的最高温度的算术平均值。Costandy对20、40、100、200、300、400和500MPa压力下进行相平衡的模拟设计,发现使用不同的水分子模型对水合物相平衡条件的影响较大,而客体分子模型的影响较小。当相互作用系数为1时,相平衡温度与实验值相差15K左右。经过优化,发现当χ=1.15(Lorentz-Berthelot相互作用参数)时,相平衡与实验值吻合度要好。此外,Lasich等[20]通过计算自由能,得到了甲烷水合物的相平衡曲线。可以用分子动力学模拟的方法,测定实验室测定有困难的,较高压力范围下水合物的相平衡参数;或者预测不同的热力学促进剂对水合物相平衡的影响,效果较好的话,再通过实验验证,节省实验资源。
1.2 CO 2水合物相平衡条件影响因素
水合物的相平衡条件受到热力学促进剂和热力学抑制剂的影响,热力学促进剂通常通过占据水合物大晶穴的方式来降低体系的自由能,形成II型(如CP)或H型水合物(如MCP),使气体水合物生成条件更加温和,相平衡条件向着温度升高、压力降低的方向移动。比较常见的水溶性热力学促进剂有四氢呋喃(THF)、季盐(四丁基溴化铵TBAB、四丁基溴化磷TBPB、四丁基氯化铵TBAC等)。非水溶性的热力学促进剂包括各种碳氢化合物,比如环己烷(CH)、环戊烷(CP)、环丁烷(CB)、甲基环己烷-甲基环戊烷(MCP)、环庚烷(CHP)、1,4-二甲基环己烷、2,2-二甲基丁烷和环辛烷(CO),及HCFC-141b、四氢吡喃(THP)、环戊酮(CP-one)等。热力学抑制剂会使水合物相平衡向低温高压方向移动,包括氯化钠和乙醇等,由于NaCl在溶液中电离,溶解离子的水难以再生成水合物,盐析作用和离子聚类作用使水合物形成更加困难,相平衡向左移动,且浓度越高,抑制作用越强烈。乙醇的羟基与水分子的氢键相作用,同样引发聚类作用,使水合物更难形成[21]。表1列出了文献中已报道的热力学添加剂对水合物相平衡条件的作用。
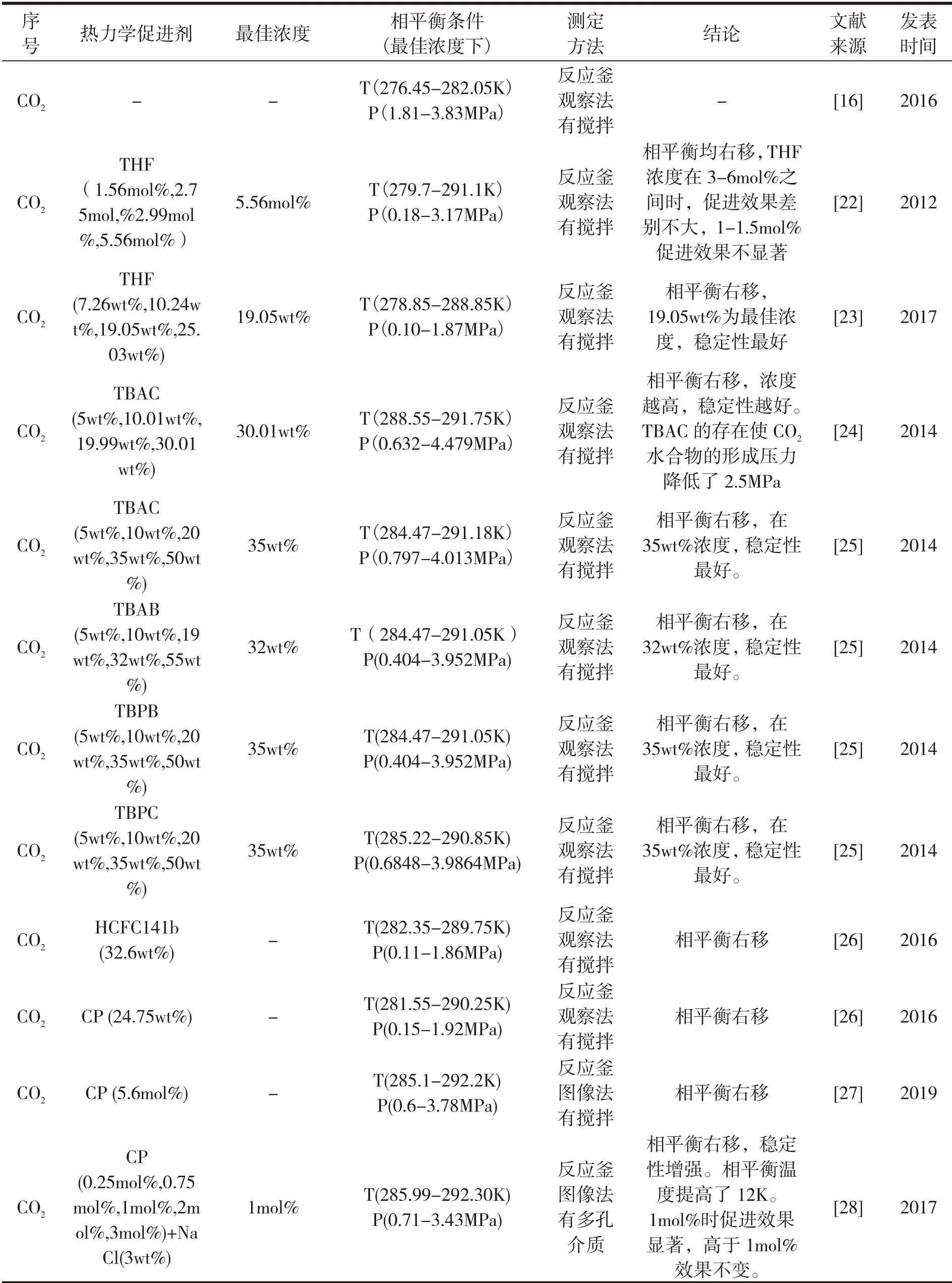
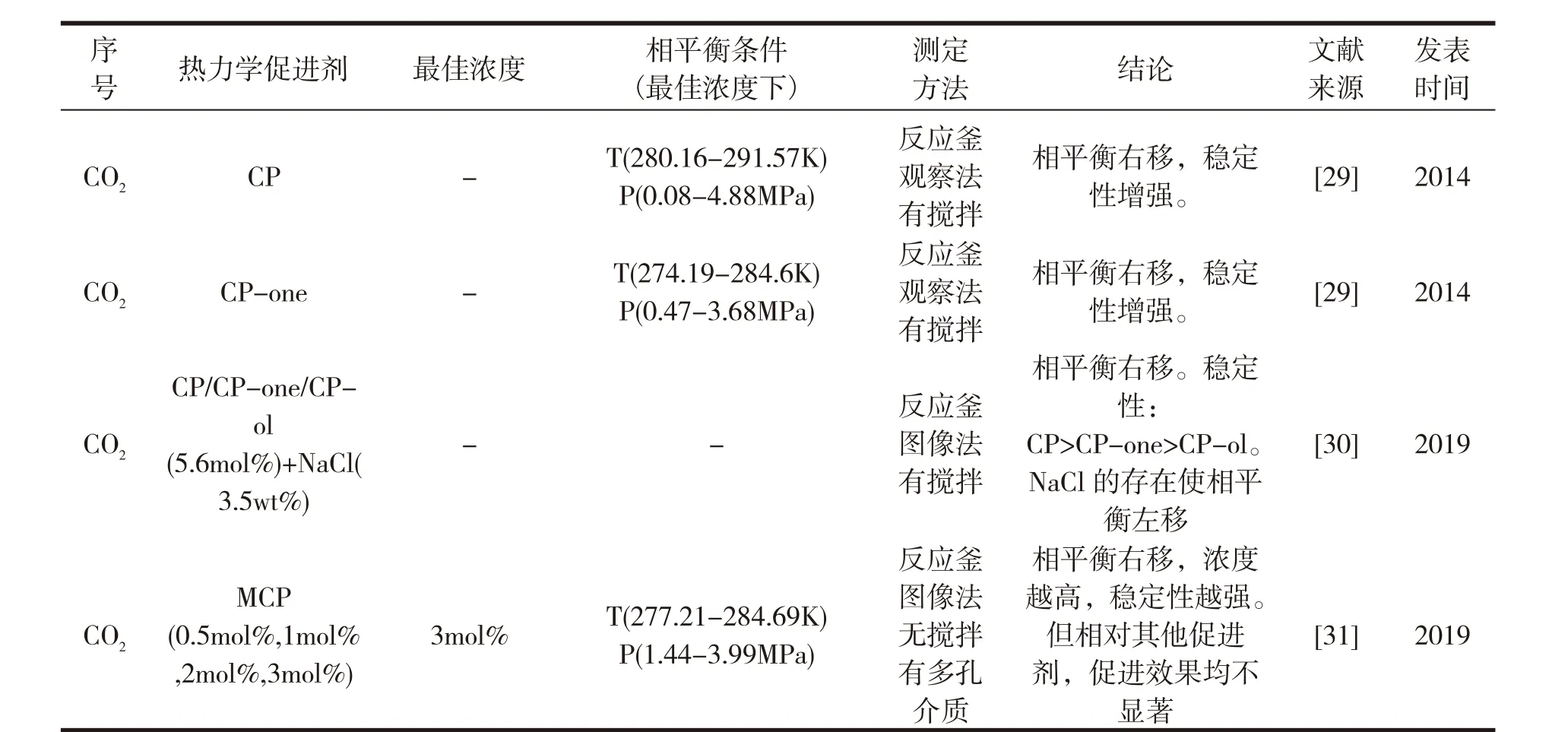
表1 CO 2气体水合物的相平衡研究
由表2可以看出,热力学促进剂对CO2水合物的相平衡条件具有显著影响,不同种类的热力学促进剂影响效果不尽相同。热力学促进剂一般存在一个最佳浓度,尽管种类不同,但是促使相平衡移动的原理类似,因此最佳浓度一般出现在水合物形成的化学计量比附近。目前关于相平衡的实验测定,大多是在有磁力搅拌的装置中进行的,或者在多孔介质存在的条件下进行。这是由水合物成核的随机性决定的,需要在外界扰动的作用下实现。因此,需要通过反应动力学的研究,揭示水合物成核成长的内在机制,从而减小外部能耗。
相平衡条件属于物质的固有属性,由于实验条件和实验手段不尽相同,尤其是采用观察法测定时,人为决定的因素相对较大,因此同一热力学促进剂对水合物相平衡条件的影响略有差异,但总体差别不大。相平衡数据还需要通过不同的测量方法完善和丰富,尤其是对于研究较少且作用显著的热力学促进剂。另外水合物相平衡实验法测定的压力范围有限,可以通过分子动力学模拟,扩大压力范围,丰富相平衡数据,修正根据实验结果拟合的相平衡模型。
?
2 CO 2水合物热力学稳定性研究
关于热力学稳定性,通常指水合物在不同温度、压力、客体分子及添加剂作用条件下,水合物笼形结构的稳定性,可以用氢键和相互作用能来表征。稳定性越好,水合物分解越困难,因此稳定性也可以通过微观条件下水合物的分解特性来表征。热力学促进剂能够形成II型水合物,降低体系自由能,改善相平衡条件,增强水合物的稳定性。
Kondori等运用Materials Studio模拟软件,对I型CO2- CH4二元水合物体系(3x3x3)进行分子动力学模拟,在NPT系综下,用径向分布函数RDF、均方位移MSD、晶格参数、密度、势能、扩散系数、序参数等表征水合物的热力学稳定性和分解特性。分析了不同温度、压力和晶穴占有率对水合物稳定性的影响,得出以下结论:I型CO2-CH4二元水合物的稳定性随着温度的升高而降低。当CO2完全占据大晶穴,CH4完全占据小晶穴时,系统最稳定[32]。梁海峰等运用Materials Studio模拟软件,对II型水合物进行分子动力学模拟,研究了环戊烷、四氢呋喃、四氢吡喃三种热力学促进剂对CH4水合物体系稳定性的影响,通过MSD、RDF和相互作用能就进行表征,结果表明,在热力学促进剂作用下,水合物可以在更温和的条件下稳定存在,稳定性排序为:环戊烷优于四氢呋喃,优于四氢吡喃,得出结论,当客体分子直径与晶穴直径差值越小,体系越稳定[33]。水合物的稳定性还可以通过自由能、化学势能和活化能进行表征[34]-[37],研究人员分别对不同系综条件下水合物体系的稳定性进行研究[38][39]。
气体水合物相平衡的条件及热力学稳定性的高低代表水合物的热力学特性,并不能反映水合物生成的性质,目前水合物合成过程存在过冷度大、诱导时间长、水合率低等问题,需要进一步从反应动力学的角度研究水合物的合成过程。关于气体水合物合成和分解的动力学研究也已经广泛开展,研究人员通过使用表面活性剂等[40]-[46]添加剂或纳米粒子[47]-[53]来促进水合物合成,但是通常是针对单一气体水合物,无法同时解决稳定性和相平衡压力较高的问题。因此,将表面活性剂和热力学促进剂复配,是进一步研究的主要方向。
3 结论与展望
(1)本文从宏观实验和微观分子动力学模拟的角度出发,综述了CO2水合物合成的相平衡条件、热力学稳定性及不同热力学添加剂作用下对水合物合成热力学作用效果及作用机理。
(2)关于CO2水合物的热力学特性机理较为明确,即热力学促进剂通过占据大晶穴的方式增强水合物的稳定性,降低体系的自由能。但是相平衡数据目前仍然较少,尤其是对于一些不太常见的热力学促进剂,比如环戊酮等。相比于环戊烷156mg/L的溶解度,环戊酮为9175mg/L,水溶性更好。而且环戊酮的极性较高,在水合物生成过程中诱导时间短,气体消耗量大,有望成为一种比较有价值的热力学促进剂。
(3)将热力学促进剂与表面活性剂和纳米粒子相结合,制备纳米流体或微乳液,探究不同添加剂的协同效应,从相平衡条件改善、动力学促进及传热传质的角度,利用实验和模拟,从宏观到微观,多方位寻找静态条件下促进CO2水合物在常压下快速合成的新方法。

