老年缺血性脑小血管病危险因素及早期预测模型建立
刘娜 王晓 王培芝 孟莉 王文婷
(河北医科大学第一医院 1神经内一科,河北 石家庄 050031;2神经内二科)
脑小血管病(CSVD)约占缺血性脑卒中的20%~25%,是脑血管病的重要亚型,其病因、发病机制繁杂〔1,2〕。多数研究认为本病是多种病因导致脑内小动脉、小静脉、微动脉、尾静脉及毛细血管病变后引起的脑深部灰质、脑白质、脑干损伤,继而出现一系列病理、神经影像学改变及认知功能障碍等临床综合征〔3,4〕。随着我国人口老龄化加剧及磁共振技术的不断发展,缺血性CSVD的检出率也明显增加,关于缺血性CSVD的临床研究也日益增多,尤其是研究缺血性CSVD危险因素类报道,多数研究认可年龄、血压与缺血性CSVD存在密切关联,其他血管危险因素对缺血性CSVD的影响仍未达成共识,且少见基于危险因素建立缺血性CSVD早期预测模型类报道〔5,6〕。鉴于此,本研究采集资料,拟通过对缺血性CSVD危险因素的探究,建立缺血性CSVD早期预测模型,为缺血性CSVD的早期诊治提供参考依据。
1 资料与方法
1.1一般资料 研究对象为河北医科大学第一医院自2017年2月至2019年12月收治的227例缺血性CSVD患者。纳入标准:①年龄60~80岁;②缺血性CSVD患者符合《中国脑小血管病诊治共识》〔7〕中CSVD诊断标准;③自愿参与研究,且临床资料能满足研究需求;④自愿签署知情同意书。排除标准:①脑出血者;②合并恶性肿瘤者;③合并免疫功能障碍者。另选取同期在本院门诊就诊,且影像学检查无异常的97例正常就诊者作为对照组。缺血性CSVD组年龄显著高于对照组,脑卒中史、高血压、蛋白尿、冠心病比例及舒张压显著高于对照组,差异有统计学意义(P<0.05),见表1。
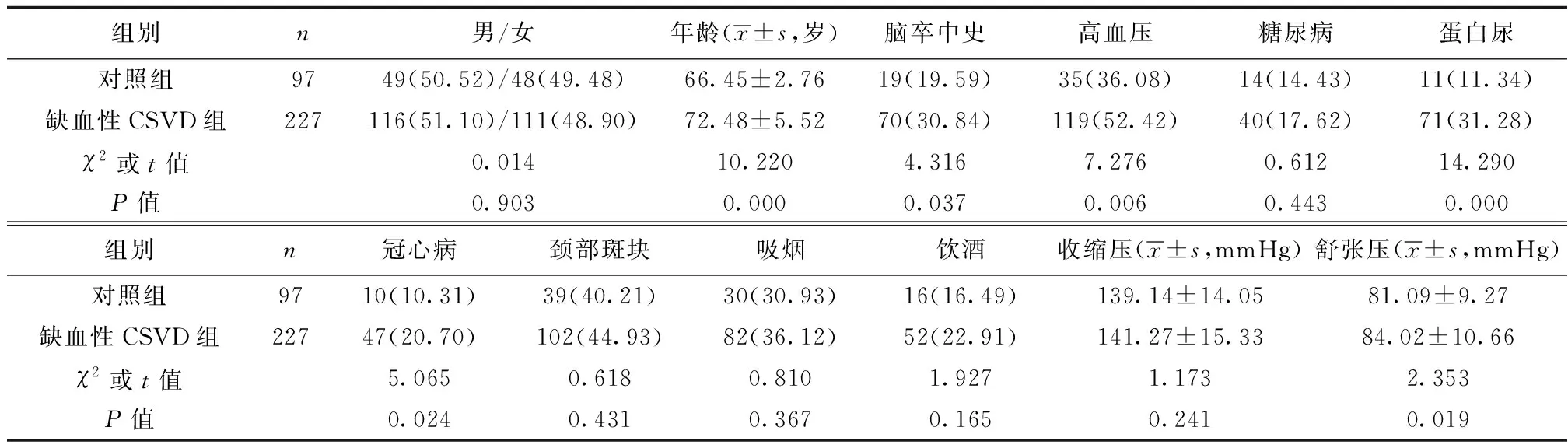
表1 两组一般资料比较〔n(%)〕
1.2方法 自制研究调查问卷或查阅临床病历采集以下指标。①一般资料:性别、年龄、脑卒中史、高血压、糖尿病、蛋白尿、冠心病、颈部斑块、吸烟、饮酒、收缩压、舒张压。②实验室指标:总胆固醇(TC)、三酰甘油(TG)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)、脂蛋白a〔Lp(a)〕、载脂蛋白(Apo)A1、同型半胱氨酸(HCY)、胱抑素(Cys)C、尿酸(UA)、血糖、超敏C反应蛋白(hs-CRP)、白细胞计数(WBC)、红细胞沉降率(ESR)、纤维蛋白原(Fig)、D-二聚体(D-dimer)、全血黏度低切、全血黏度高切、淋巴细胞计数(LYM)、血小板平均体积(MPV)、中性粒细胞/淋巴细胞比值(NLR)、血小板/淋巴细胞比值(PLR);③CSVD总负荷:采用文献〔8〕所使用的脑小血管总体负担评分,结合患者MRI检查结果,该评分包括以下几个方面:①腔隙病灶1分、②有深部脑出血灶1分、③深部脑白质病变开始融合、病变大面积融合或侧壁脑室旁白质病变出现不规则的脑室旁白质高信号并延伸至深部白质评1分,④周围血管间隙扩大数目为≥10个以上评1分,总分0~4分,即为脑小血管负荷评分;并依据脑小血管负荷评分分组。
1.3统计学方法 采用SPSS23.0软件进行t及χ2检验;Logistic回归分析危险因素并建立缺血性CSVD早期预测模型,Hosmer-Lemeshow检验模型拟合优度;缺血性CSVD早期预测模型对缺血性CSVD的预测价值采用受试者工作特征(ROC)曲线分析,以曲线下面积值(AUC)反映预测效能。
2 结 果
2.1实验室指标及CSVD总负荷比较 缺血性CSVD组TC、LDL-C、ApoA1、全血黏度低切、全血黏度高切显著低于对照组,Lp(a)、HCY、CysC、UA、hs-CRP、WBC、ESR、Fig、D-dimer、MPV、CSVD总负荷显著高于对照组,差异有统计学意义(P<0.05),其他指标差异无统计学意义(P>0.05)。见表2。

2.2老年缺血性CSVD的危险因素分析 经Logistic回归分析显示,年龄、高血压、蛋白尿、冠心病、UA、hs-CRP、ESR、CSVD总负荷均是老年缺血性CSVD的独立影响因素(P<0.05);建立缺血性CSVD早期预测模型方程式:Log(X)=-102.341+(0.407×年龄)+(0.724×高血压)+(1.303×蛋白尿)+(0.779×冠心病)+(0.047×UA)+(3.313×hs-CRP)+(2.423×ESR)+(3.385×CSVD总负荷),见表3。

表3 老年缺血性CSVD的危险因素分析
2.3缺血性CSVD早期预测模型对CSVD的预测价值 Hosmer-Lemeshow检验χ2=2.258,P=0.671;缺血性CSVD早期预测模型预测CSVD的AUC为0.846(95%CI:0.802~0.884),Z=16.498,P<0.001,约登指数0.572,敏感度、特异度分别为63.44%、93.81%,见图1。
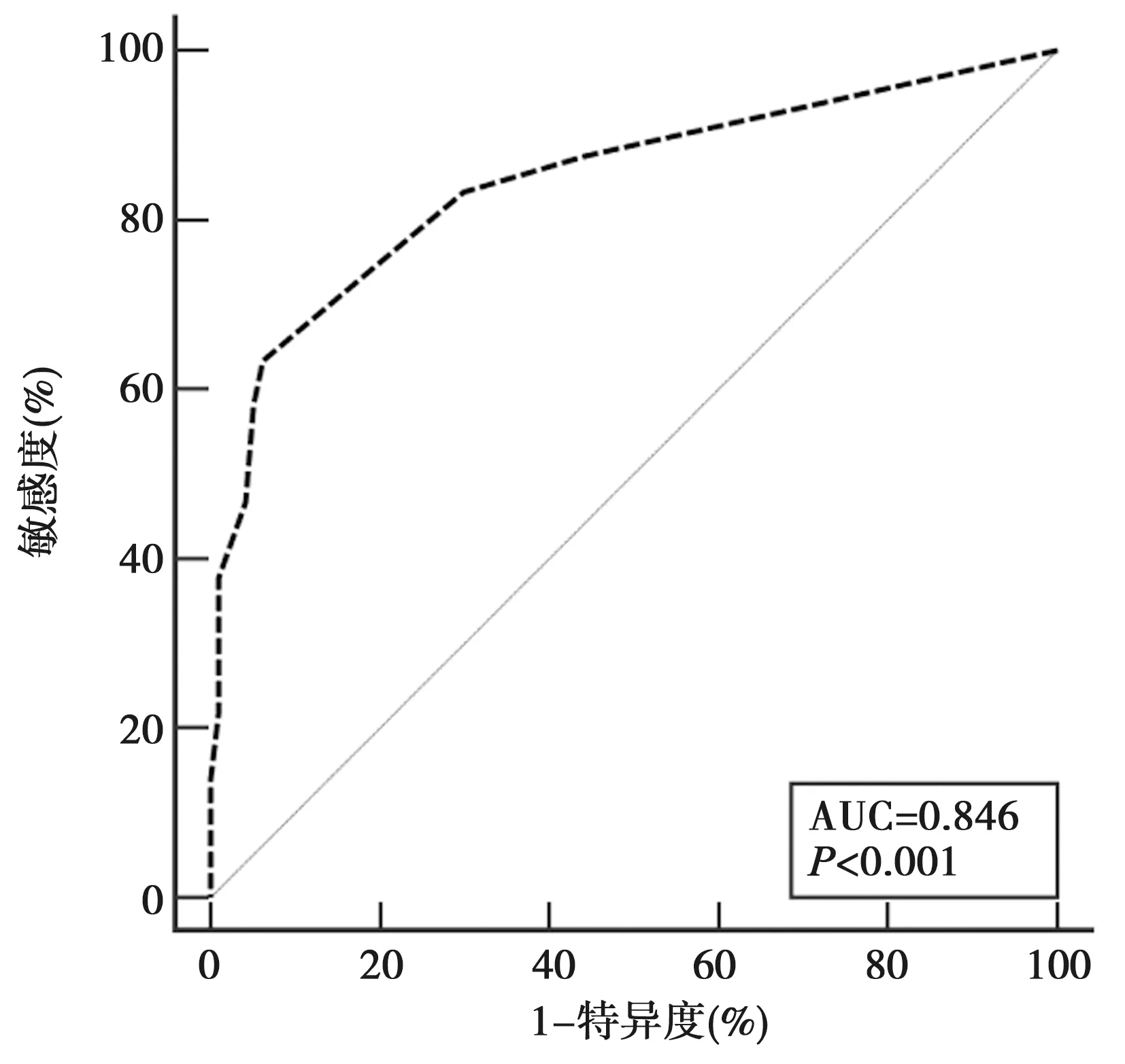
图1 缺血性CSVD早期预测模型对CSVD的预测ROC曲线分析
3 讨 论
研究指出,CSVD的主要发病机制为小动脉硬化,早期积极干预可获得良好预后,但若疾病发展至终末阶段则存在治疗难度,患者往往预后不良〔9〕。因此,早发现、早干预是CSVD患者获得良好预后的关键。现阶段研究CSVD患者相关危险因素的临床报道不在少数,但受研究对象、影响因素采集等多因素影响,CSVD的危险因素研究仍有极大深入探究空间。而本研究显示,仅年龄、高血压、蛋白尿、冠心病、UA、hs-CRP、ESR、CSVD总负荷是老年缺血性CSVD的独立危险因素,其中年龄、高血压与CSVD的关系相对明确。Gyanwali等〔10〕也报道,随着年龄增长,小动脉粥样硬化程度逐渐加重,因此具更高的CSVD风险;而长期的高血压可减弱脑内血管自动调节作用,导致小动脉硬化变性,并引起血管壁增厚、微小动脉透明变性、血管脆性增加等一系列病理改变,使小血管分布区域的脑组织缺血性改变,从而发生缺血性CSVD〔11〕。
蛋白尿是反映肾脏微循环病变的早期标志物,既往研究已证实其与冠脉疾病、脑卒中、心血管疾病预后存在密切关联〔12〕。马玉梅等〔13〕也报道,因肾脏微循环系统与大脑有着相似的解剖及血流动力学特征,蛋白质从肾小球渗漏的同时也可增加血脑屏障通透性,血浆中的蛋白成分也可渗漏至脑组织间隙而导致CSVD发生,蛋白尿是老年CSVD的独立危险因素之一。而冠心病作为基础血管危险因素,本研究显示其是CSVD的独立危险之一。但付胜奇等〔14〕报道结论冠心病与CSVD并无显著关联,这与本研究结论存在差异,这项研究显示年龄、高血压、UA、hs-CRP均是急慢性CSVD的独立危险因素,这与本研究结论相符。究其原因,当血UA上升时,水溶性UA结晶沉于血管壁,不仅损害血管壁,破坏线粒体、溶酶体功能,破坏血脑屏障;另UA增加还可促进脂质过氧化就平滑肌细胞增生,从而促进细胞凋亡;通过上述作用损伤小血管,增加血脑屏障通透性则导致CSVD发生〔15〕。而hs-CRP、ESR之所以是CSVD的独立危险因素,分析可能因炎症可通过介导内皮功能障碍破坏血脑屏障及紧密连接蛋白,引起血管反应性及在自动调节功能受损等多种直接或间接作用引起血管内皮损伤,从而增加CSVD风险〔16〕。CSVD总负荷则是基于MRI的描述CSVD基本情况的重要指标,是基于MRI影像学所获得的腔隙性脑梗死、脑白质疏松、脑内微出血等表现的累积分值,在CSVD诊断及预后评估中均发挥重要价值〔17,18〕。CSVD总负荷评分越高,患者腔隙性脑梗死、脑白质疏松、脑内微出血等表现越严重,因而CSVD风险越高。
本研究基于CSVD的危险因素分析建立CSVD早期预测模型,可用于CSVD的临床预测,并具较高的特异性,但其敏感度仍有欠缺。分析可能因CSVD种类较多,不同种类的CSVD在危险因素上也不尽相同,而本研究将所有CSVD患者作为一个整体,因而模型预测的敏感度有待提升,拟在下阶段针对性分析不同种类的CSVD相关危险因素,建立对应预测模型,以持续补充及完善CSVD的危险因素研究及早期预测。
综上所述,老年缺血性CSVD的因素涉及年龄、高血压、蛋白尿、冠心病、UA、hs-CRP、ESR、CSVD总负荷等多个方面,且依据上述危险因素所建立的早期预测模型预测CSVD虽敏感度有欠缺,但具较高的特异度。

