SUMO化修饰及其对信号通路的调控
肖云飞,王嘉宾,耿海刚,刘青娟
(河北医科大学 基础医学院 病理学教研室 河北省肾脏病重点实验室,河北 石家庄 050017)
蛋白质的翻译后修饰(post-translational modifications,PTMs)是一种强有力且快速的调控生物活性的关键机制,修饰形式十分多样,例如磷酸化、乙酰化、甲基化、泛素化和SUMO化等,且不同的修饰可相互影响。其中小泛素相关修饰物(small ubiquitin-related modifier, SUMO)是新近发现的一类蛋白质翻译后修饰因子,其分子质量约为11 ku[1]。近年来,SUMO化(SUMOylation)已成为蛋白质研究的焦点,在调节许多细胞过程中起关键作用。另外SUMO化修饰还是一种高度应激反应,是解决细胞损伤问题的关键中介,例如缺氧、热休克、基因毒性应激等[2]。而在许多细胞活动中,NF-κB信号通路、MAPK信号通路、TGF-β信号通路在胞内外信号传导方面具有关键作用。最近的研究显示,SUMO的多种亚型可对上述3种通路中许多重要蛋白进行修饰,从而发挥对多种生物细胞活动的调控作用,因此SUMO化修饰对许多疾病的治疗都是一个重要的潜在机制。本文综述了SUMO化与以上3种通路中某些蛋白的作用关系及对蛋白质生物活性的影响。
1 SUMO的家族成员和SUMO化修饰
SUMO家族成员至今发现有5种:SUMO-1、SUMO-2、SUMO-3、SUMO-4和SUMO-5(由于SUMO-2和SUMO-3的氨基酸序列非常接近,常合写成SUMO-2/3[3]),主要功能是对底物蛋白进行SUMO化修饰。SUMO-1、SUMO-2和SUMO-3在所有细胞和器官中广泛表达;而SUMO-4特异性的只在某些器官中表达,例如肾脏、淋巴结和脾脏;SUMO-5仅在部分组织中表达。SUMO-5在睾丸和造血系统中含量丰富[4]。
SUMO化修饰主要为蛋白质赖氨酸残基翻译后的动态修饰,即SUMO通过三级酶促级联反应与靶蛋白进行可逆的共价连接(图 1)[5]。激活酶(E1)、偶联酶(E2)和连接酶(E3)在此过程中必不可少,激活、结合和连接等步骤均需要SUMO参与[6]。首先成熟形式的SUMO在E1(在人类为SAE1/SAE2,在酵母中被称为AOS1/Uba2)和ATP参与下活化,随后活化的SUMO被转移到E2(现只发现一种即为Ubc9)上,Ubc9催化SUMO与底物蛋白结合,Ubc9被活化或Ubc9与底物蛋白的距离被拉近,因此更高效的将SUMO从Ubc9上转移到底物蛋白。动态性和可逆性是该修饰过程的特征,当特异性的蛋白将SUMO从底物蛋白中解离出来时,即为去SUMO化[7]。所以,维持底物正常生理功能的关键在于SUMO化与去SUMO化间的动态平衡,若此平衡失调则会使底物蛋白功能异常,从而可能导致炎性反应和肿瘤等疾病的发生。
SUMO化修饰对维持器官的稳态、调节细胞增值和分化等生物学功能至关重要,但针对不同的底物和不同的应激过程来说影响有所差异,导致的生物学效应也多种多样[8]。此外,许多含有与SUMO相互作用基序(SIMs)的蛋白质可以与SUMO进行非共价的相互作用,也可稳定蛋白质组装[9]。
2 SUMO化修饰在NF-κB信号通路中的作用
核因子 κB (nuclear factor-κB,NF-κB)信号通路现是目前得到公认的参与免疫应答和炎性反应的主要信号通路。而NF-κB 抑制蛋白(inhibitor of NF-κB, IκB)可抑制NF-κB信号通路的激活。IκB可掩盖 NF-κB 的核定位信号(nuclear localization signal, NLS),使NF-κB在静息状态下和IκB集合,在胞质以非活性形式存在,从而被阻止不能进入胞核参与核转录[10]。近年来研究显示,除IκBα的磷酸化、继之泛素化降解的经典激活途径和通过激活IKK的旁路激活途径外,与泛素化类似的PTM机制-SUMO化修饰也可对NF-κB信号通路进行调控。
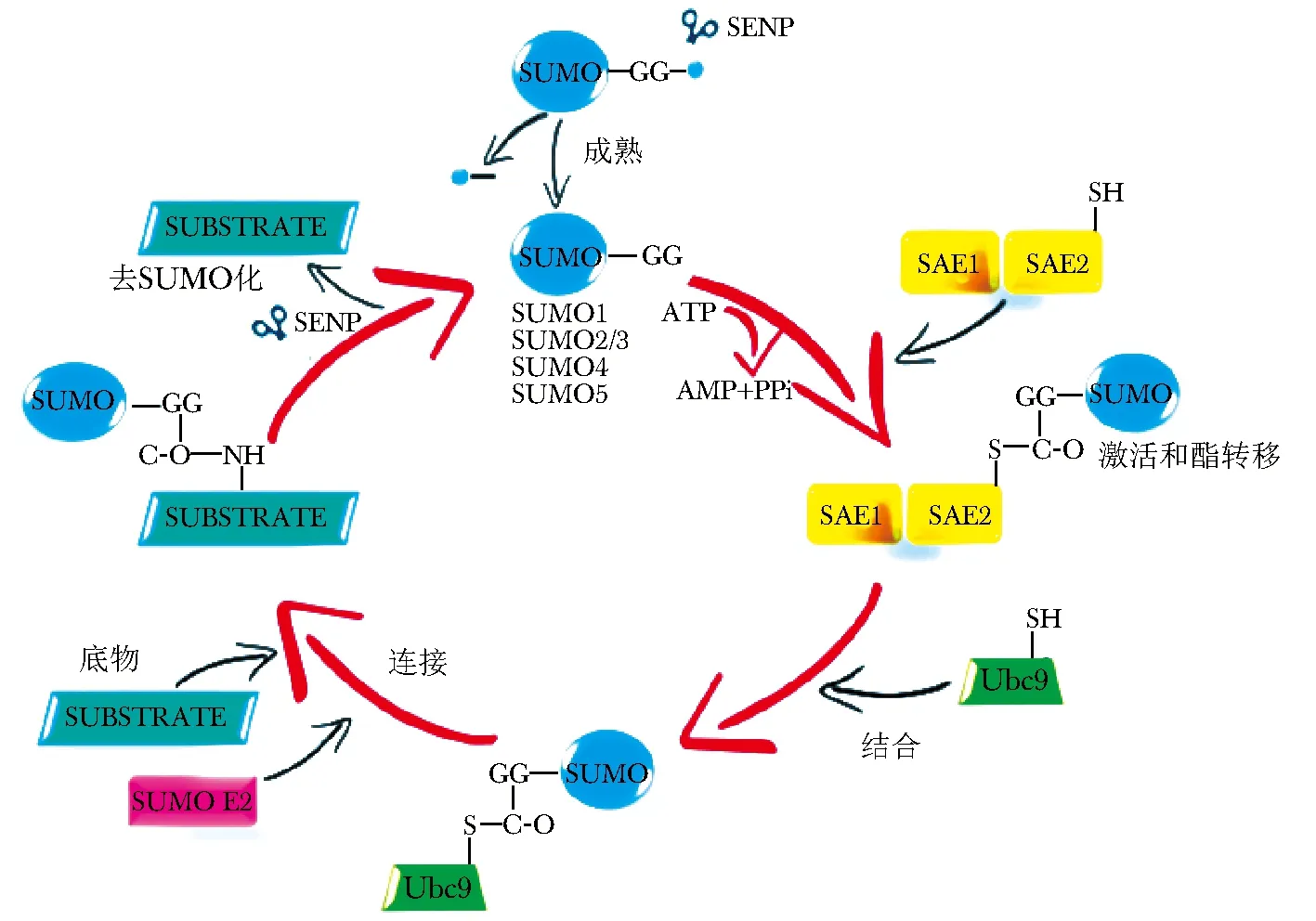
图1 小泛素相关修饰物(SUMO)偶联系统Fig 1 Small Ubiquitin-like Modifier (SUMO) conjugation system
IκB家族主要包含:传统的IκB蛋白(IκBα,IκBβ,IκBε),NF-κB前体蛋白(p100,p105)和核IκB(IκBζ, Bcl-3和IκBNS)。其中IκBα是在NF-κB信号通路中被第一个发现的发生SUMO修饰的蛋白。赖氨酸(Lys)结合位点K21是IκBα发生SUMO化修饰的主要位点,形成的SUMO-IκBα复合物可使IκBα更加稳定。由于IκBα发生SUMO化修饰的位点也正是泛素化修饰的位点,故可以与其竞争使IκBα不被泛素化降解,从而抑制了NF-κB进入胞核、NF-κB信号通路被激活等一系列过程。通过低氧-再给氧循环刺激腺苷信号时,可聚集大量的SUMO-1,并加剧IκBα-SUMO1化修饰,阻滞IκBα磷酸化和泛素化降解的出现,使通过NF-κB信号介导的基因转录减弱,这也使上述观点得到证实[11];但是,又得到相反的结论。SUMO-2/3通过对IκBα的Lys结合位点K21进行SUMO化修饰,使RelA(p65)从IκBα中被释放出来,激活NF-κB 信号通路[12]。由此也提示SUMO不同亚型在对IκBα相同位点进行修饰时,产生的生物学效应可能不同。
3 SUMO化修饰在MAPK信号通路中的作用
丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)信号通路是将胞外刺激转化成胞内信号的关键途径。MAPK信号通路是高度保守的三级级联激活模式已得到广泛认可,包括上游激活蛋白→MAPKK激酶(MAPKKK)→MAPK激酶(MAP-KK)→MAPK[13]。MAPK家族由4个不同的亚族构成,包括p38、胞外信号调节激酶(extracellular signal-regulated kinase,ERK)、ERK5和c-Jun氨基末端激酶(c-Jun N-terminal kinase, JNK)。目前发现,SUMO化修饰对MAPK信号通路中的不同亚族均有调控作用。
3.1 p38与SUMO化修饰
在静息状态下中,p38在胞质和胞核中均有分布,胞质内的p38蛋白在各种刺激下可向胞核内移位,以接近其核底物。因此,p38在胞内的再分布是其完成细胞功能的重要机制。p38上存在许多蛋白质都有的一种短且疏水的SUMO相互作用基序(SUMO-interacting motifs,SIMs)。而SIMs与SUMO之间具有中等的亲和力和特异性,最重要位点是SIM3(氨基酸289LVLD292)。当二者广泛结合并相互作用时,SUMO化修饰可以作为一种“分子胶水”来维持SUMO-SIMs蛋白质复合物的稳定。 最近许多研究发现,在幽门螺杆菌感染期间,通过敲低或过表达SUMO来影响p38的核转移,可分别导致细胞存活率的增加或减少。从而间接支持了通过这种非共价相互作用,进行p38核转移的观点,而现证实这种相互作用与磷酸化状态无关[14]。因此不难看出,在p38被SUMO化修饰后,其亚细胞定位被改变,从而对p38通路的信号传导产生影响。
3.2 ERK与SUMO化修饰
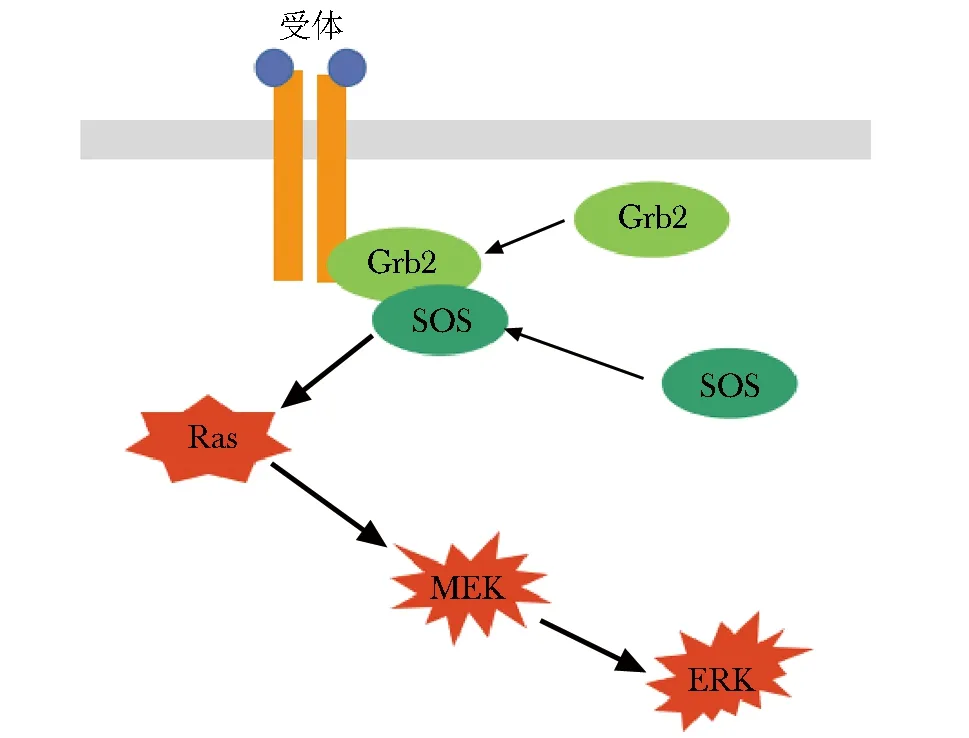
图2 Ras-MEK-ERK激活途径Fig 2 Activation of Ras-MEK-ERK pathway
胞外信号调节激酶(ERK)的信号传导途径是涉及调节细胞增殖、发育及分裂的信号网络的关键。而Ras蛋白作为Ras-MEK-ERK途径的上游蛋白,非常重要。Ras蛋白作为最早发现的小G蛋白,其激活与Grb2、SOS蛋白紧密相关。当胞外信号与受体结合后,胞内的生长因子受体结合蛋白2(Grb2)与被激活的受体结合,再与SOS(son of seven-less)的C端富含脯氨酸的序列相互作用,形成Grb2-SOS复合物,进而经过一系列过程激活Ras(图2)。因此,若Grb2发生SUMO化后,可影响Ras蛋白的激活,从而对ERK蛋白活性及其通路的信号传导产生调控作用。
Grb2发生SUMO化修饰的位点为Lys56(K56)。部分研究表明这种SUMO化修饰主要通过对SOS1的招募富集,来促进Grb2-SOS1复合物的形成,从而增强ERK活性和导致ERK/MAPK通路的激活,促进细胞的运动、转化和肿瘤发生等。但同时有部分研究认为,ERK活性的增强是由于Grb2的SUMO-1化修饰促进Grb2结合SOS1以外的其他蛋白质所引起的,如表皮生长因子受体、Shp2等。尽管Grb2在SUMO化后可影响Ras蛋白的激活,但其具体过程仍存在争议,有待进一步研究。
3.3 ERK5与SUMO化修饰
除Grb2可发生SUMO化修饰外,对ERK有影响的Shp2也能被SUMO化修饰。Shp2的端赖氨酸残基590 (K590)可与SUMO-1发生SUMO化修饰,促进Shp2-Gab1 (Grb2-associated binding-1)复合物的形成和ERK信号的激活,加速了肝细胞癌和其他肿瘤的生长[15]。由此可见,ERK通路相关蛋白SUMO化修饰可调控肿瘤发生,但也提示关于此问题可待研究的还很多,例如MEK、SOS等都可作为研究对象,为肿瘤提供更多元化的治疗。
胞外信号调节激酶5(ERK5,也称MAPK7)作为MAPK的4个最重要亚族之一,相比其他3种亚族来说受到关注较少。在4种亚族中,ERK5的不同之处在于具有独特结构和功能特性的C端,其赖氨酸残基6和22已被确定为SUMO修饰的靶向位点。而ERK5的C端SUMO化修饰与多种癌疾病发展密切相关,但具体机制尚未探明[16]。在高血糖、氧化应激和血液流动紊乱的诱导下,ERK5可发生SUMO化修饰抑制内皮细胞中ERK5的转录活性,导致内皮细胞功能障碍和炎性反应的发生。且该同一研究小组在对ERK5参与动脉粥样硬化的最新研究上也得到了相同的结论,SUMO特异性蛋白酶2(SENP2)的表达降低会增加ERK5 的SUMO化,从而加速小鼠的内皮细胞功能障碍以及炎性反应,一定程度上促进了动脉粥样硬化斑块的形成[17]。
4 SUMO化修饰在TGF-β信号通路中的作用
转化生长因子-β(TGF-β)信号通路可参与调节细胞增殖、分化、胞外基质重塑等,主要由于其可以将TGF-β信号从细胞表面传导到胞核中,而多种蛋白之间的协同作用至关重要。TGF-β配体通过与胞膜上特定的TGF-βⅡ型受体结合,激活的Ⅱ型受体不断募集TGF-βI型受体,并通过其丝氨酸/苏氨酸激酶结构域使其磷酸化,随后磷酸化的Ⅰ型受体与胞内受体调控的Smad蛋白(R-Smad)结合,将R-Smad的丝氨酸残基磷酸化,活化的R-Smads被释放到胞质溶胶中,这些蛋白再与Co-Smad 相互结合,形成异源寡聚复合物,随后该复合物从胞质内易位到胞核中,调控特定基因的表达(图 3)。可以看出,Smad在TGF-β信号通路中十分关键。而最新研究表明,TGF-β/Smad信号通路的成员、效应蛋白和调节剂除受磷酸化、泛素化和乙酰化等已被广泛接受的翻译后修饰外,还可受到SUMO化修饰。
4.1 Smad与SUMO化修饰
根据组成结构的不同,Smad蛋白家族主要由 3个亚家族构成,分别是R-Smad、Co-Smad和I-Smad。其中,Smad4不仅是Co-Smad亚家族中最重要的一种,而且也是如今在哺乳动物中唯一发现的Co-Smad蛋白[18]。在信号传导过程中,所有 R-Smads入核之前均需与Smad4结合。Smad4是肿瘤抑制因子中的一种。当Smad4被SUMO化修饰后,Smad4的蛋白表达和稳定性提高,使胞外信号通过TGF-β信号通路在胞内传导增强,从而特异性增强Smad4靶基因的转录活性,提高对肿瘤的抑制作用[19-20]。相反,之后在猴肾成纤维样细胞(COS-7)中发现,过表达的SUMO-Smad4融合蛋白或过表达的SUMO1和Ubc9在一定程度上抑制了TGF-β诱导的转录,这也表明SUMO化修饰有可能具有消极作用。但在对TGF-β信号通路产生相反作用时,Smad蛋白SUMO化修饰的确切定量现研究仍不清楚。
除了Co-Smad(Smad4)以外,其他R-Smad蛋白(如Smad3)、Smad核相互作用蛋白1(SNIP1)和Smad泛素化调节因子-2(Smurf2)等也可以发生SUMO化修饰。
有研究发现,E3连接酶PIASy通过与Smad3的相互作用并对其进行SUMO化修饰,抑制了TGF-β信号的传导[21]。之后的一些研究发现,E3连接酶PIASy和SUMO-1共同作用时还可通过影响Smad3的亚细胞定位从而使核内的Smad3出核[22]。这说明对不同作用的蛋白进行SUMO化修饰,也可能会产生相似或相同的生物学效应,这也为糖尿病、肿瘤等疾病的靶点治疗研究提供了新的方向。
以前认为SNIP1抑制TGF-β信号传导的机制是通过破坏Smad复合物的形成并减弱p300向Smad蛋白的募集实现的。但现发现,SNIP1也可直接与Smad2/4结合对其产生抑制作用。之后研究表明,SNIP1可被SUMO化修饰,修饰位点为3个赖氨酸残基:Lys5、Lys30和Lys108,其中Lys30是其主要的SUMO结合位点。进行SUMO修饰可使SNIP1失活,导致SNIP1失去抑制TGF-β信号通路的作用[23]。由此帮助认识到SNIP1被SUMO化修饰后,可使TGF-β信号传导能力增强,提高对肿瘤的抑制效应。
4.2 SnoN与SUMO化修饰
转录共抑制因子(SnoN)在TGF-β信号通路中可充当负性调节剂,提高TGF-β信号通路正常生理条件下传导的稳定性[24]。现发现,SnoN上存在SUMO共有基序,可进行SUMO化修饰,Lys50和Lys383是SnoN中SUMO化修饰的主要位点。SUMO E3连接酶PIAS1和转录中介因子1y(TIF1y)可促进SnoN的SUMO化修饰,抑制TGF-β诱导的EMT。另外,也发现PIAS1促进SnoN 的SUMO化修饰可抑制TGF-β诱导的3D乳腺癌细胞来源的类器官系统的侵袭性增殖[25]。这也使SnoN被SUMO化后,TGF-β信号通路传导的稳定性被破坏并被抑制这一假设得到验证。
5 问题与展望
综上所述,SUMO可对上述信号通路中多种蛋白进行修饰,故扮演着十分重要的角色。虽然SUMO相关研究取得较大进展,但仍有许多问题需要解决,例如上述3种通路中重要蛋白SUMO化修饰对去SUMO化是否会产生影响,及去SUMO化修饰对蛋白的SUMO化修饰是否有负向调控作用;在对Grb2的研究中,与其共同结合激活Ras的SOS是否也能发生SUMO修饰及其具体机制;Smad4进行SUMO修饰积累到何种程度时,会产生相反的消极作用?Smad4在发生SUMO修饰时,是否存在反馈通路?在MAPK家族中,除p38、ERK、ERK5外,JNK亚族本身是否也能发生SUMO修饰,抑制或促进通路传导的生物学效应?等等。因此,解决上述问题并对这3种通路中相关蛋白的SUMO化修饰进行更深入的研究,可能为肿瘤、纤维化和糖尿病等多种疾病的治疗提供了新的思路和药物靶点。
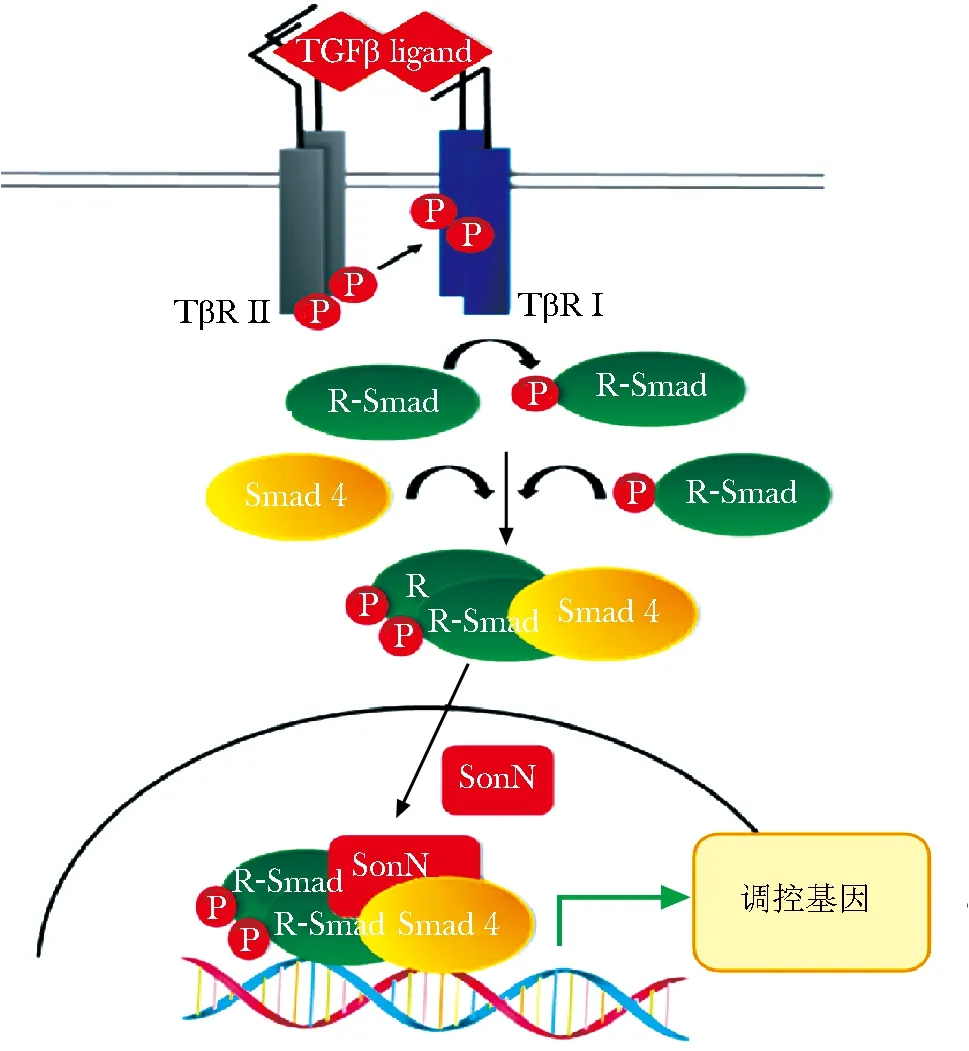
图3 转化生长因子β(TGFβ)-smad信号通路的激活Fig 3 Activation of transforming growth factor β(TGFβ)-smad signaling pathway
短篇综述

