循环肿瘤细胞的“旧语新说”
王砚春,杨晓蓉,郭 林,卢仁泉△
1.复旦大学附属肿瘤医院检验科,上海 200032;2.复旦大学上海医学院肿瘤学系,上海 200032
传统的组织活检作为肿瘤诊断的“金标准”,其侵入性取材的限制致使组织活检无法实时掌握肿瘤异质性的动态变化。液体活检技术的问世,摆脱了传统组织活检的取材束缚,受到临床的广泛关注。循环肿瘤细胞(CTC)作为液体活检技术的重要成员,能动态反映肿瘤的实时状态,在个体化治疗的疗效监测与预后评估中发挥重要作用,具有广阔的应用前景。
1 CTC概述
CTC是指从原发肿瘤中游离出来,进入血液或其他体液的肿瘤细胞[1]。虽然THIELE等[2]较早就提出了CTC的概念,但CTC在外周血中十分稀有,仅少量上皮间质转化细胞或侵袭性肿瘤细胞能够侵入血液,只占所有肿瘤细胞的0.000 000 1%[3]、外周血有核细胞的0.000 1%(1~10个细胞/mL)[2],所以通过常规检测方法几乎无法识别。
2 CTC的检测技术
随着检测技术的发展,经过分离、富集、标记、鉴定等步骤,捕获并检测体液中微量的CTC已得以实现。此外,CTC未经富集的直接检测技术[4]、体内置入的实时富集技术[5],也已转化为临床应用。
2.1CTC的分离与富集 CTC的分离与富集主要依据肿瘤细胞的物理性质和生物学特性进行,包括基于细胞大小、密度、电荷的细胞过滤法,密度梯度离心法,介电泳分离法,以及依赖细胞生物标志物的阳选与阴选策略等。
CellSearch检测系统是美国食品药品监督管理局(FDA)批准的首个CTC检测方法[6]。这项技术采用上皮细胞黏附分子抗体,捕获具有上皮间质转化特征的CTC[7]。无独有偶,我国CFDA也批准了Ⅲ类医疗器械CTC采样针CellCollector,其随着全身血液循环不断捕获细胞,提高了CTC的检测灵敏度[5]。近年来,与微流控技术相结合的CTC富集方法树立了CTC检测的新里程碑。微流控技术不仅可以保持CTC分离的效率和纯度,而且可以确保CTC的完整性和活性[8]。同时,新近兴起的其他CTC分离方法也大大提高了检测效率、降低了检测成本;但是,每种分离富集与方法均存在一定的局限性,见表1。
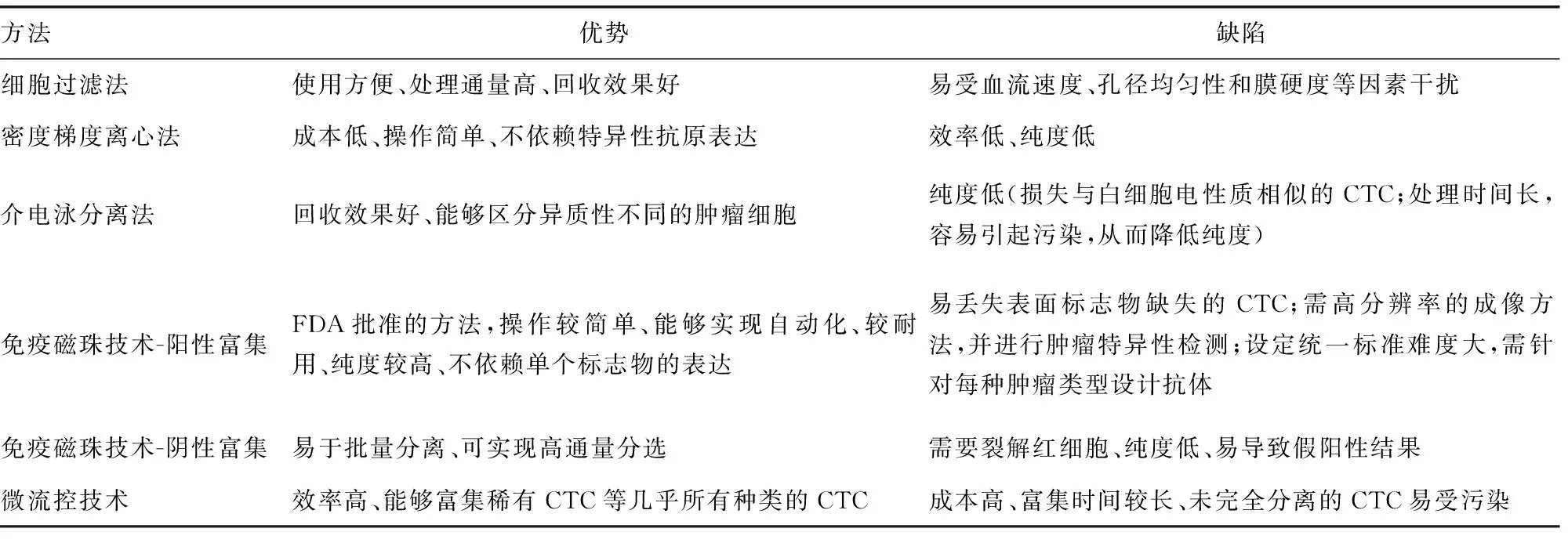
表1 CTC分离与富集方法比较
2.2CTC的标记与鉴定 分离与富集后的CTC需要进一步进行染色标记与鉴定,经典的标记鉴定方法包括细胞免疫荧光技术、PCR方法等;其中最常用的方法为细胞免疫荧光技术,通过荧光显微镜检测结果将角蛋白阳性,CD45阴性和4′,6-二脒基-2苯基吲哚阳性的细胞定义为CTC[9]。
美国FDA批准的CellSearch检测系统,就是以形态学与表面标志物为主要诊断依据,可用于监测转移性乳腺癌、前列腺癌和结直肠癌的预后[10]。这项技术如何结合核酸分子等进行特异性鉴定,全面获取肿瘤细胞的携带信息,避免干细胞假阳性污染,提高捕获效率与诊断性能,是CTC检测重返市场需要攻克的难关[10]。
近年来,采用叶酸受体免疫磁珠负向筛选联合靶向荧光定量PCR方法(国械注准20163400061),从一定程度上弥补了上述CellSearch检测CTC的缺陷,能够靶向并定量检测人全血中叶酸受体阳性的肿瘤细胞,可用于早期肺癌患者的辅助诊断及非小细胞肺癌患者的疗效监测[11]。
CTC测序技术能够精准反映肿瘤体细胞变异和基因表达变化,使全面检测分析CTC成为可能[12]。CHENG等[13]开发的Hydro-Seq平台,可以对CTC进行单细胞转录组分析,从分子层面分析CTC的基因表达图谱,不仅有助于CTC亚型分类、提供肿瘤异质性参数,而且通过雌激素受体(ER)、孕激素受体(PR)、人表皮生长因子受体2(HER2)等药物靶标的分析还为激素和靶向药物的使用提供依据,突显了CTC测序在精准医学中的潜在价值。
3 CTC的临床应用情况
在肿瘤诊断过程中,肿瘤异质性会带来检测对象的随机选择,肿瘤组织活检的细针抽吸对肿瘤肿块的部分取样,不能反映肿瘤组织的全貌。从原发肿瘤脱落的CTC,携带有肿瘤的全面信息,在肿瘤相对早期阶段即可从体液中分离出来,比发现原发肿瘤肿块或转移灶的常规检测方法更为灵敏,因此在肿瘤的临床诊疗中发挥着重要作用。
3.1CTC与肿瘤早期辅助诊断 肿瘤的早期辅助诊断一般依赖于影像学与肿瘤标志物的检查,但对于最大径小于5 mm的肿块,影像学难以发现[14];同时大部分肿瘤标志物的特异度不高,不能作为诊断的独立指标,目前肿瘤早期辅助诊断的方法仍具有一定的局限性。然而CTC的检测灵敏度相对较高,对肿瘤的早期发现有着重要价值。
ILIE等[15]发现,对慢性阻塞性肺疾病患者进行CTC检测并随访,检出CTC的患者在之后的随访期间均发现罹患肺癌,真正做到了肿瘤的早发现、早诊断。YIN等[16]使用叶酸受体富集CTC,对肺癌诊断的灵敏度为87.1%,相比常用的筛查方法——低剂量计算机断层扫描更加便捷、省时。CTC与传统的血清肿瘤标志物相比,也展现出在早期诊断方面的巨大潜力。吴方等[14]发现CTC诊断肺癌的灵敏度、特异度分别为77.1%、89.6%,均高于传统血清肿瘤标志物(神经元特异性烯醇化酶、糖类抗原125、糖类抗原153、细胞角蛋白19的可溶性片段、鳞状上皮细胞癌抗原等)。GUO等[17]使用带有阴性选择的定量PCR平台,对具有干细胞表型的CTC进行检测,发现对早期肝癌患者的诊断特异度为94.2%,诊断性能比血清甲胎蛋白更好。
当然,由于CTC捕获效率的差强人意,CTC检测仍面临着巨大挑战。CTC分离鉴定方法的局限性,易造成CTC的丢失或者误判,从而出现假阴性或假阳性结果。在基于核酸检测的技术中,虽然具有较高的灵敏度,但仍需要解决CTC损耗、纯度低、检测谱窄等问题[18]。近年来,不少新兴技术的出现为CTC检测具有更高的灵敏度和特异度提供了新方向,例如Ephesia CTC芯片将免疫磁珠技术与微流控技术相结合,可将CTC的捕获效率提高到90%~94%,检测特异度达到99.6%[19]。
此外,使用CTC和循环肿瘤DNA(ctDNA)相结合的检测方法,可以进一步提高液体活检的敏感性[20]。在一项针对多发性骨髓瘤患者的研究中发现,ctDNA与富集的CTC之间没有直接相关性,CTC和ctDNA具有不同的遗传突变谱[21]。因此,结合CTC和ctDNA的检测方法可以在不降低特异度的情况下相互补充,更灵敏地检测肿瘤特异性基因的改变,有助于肿瘤的精准检测。
3.2CTC与肿瘤疗效的关联 随着多种新辅助疗法的应用,以及肿瘤靶向治疗理念的革新,传统监测肿瘤疗效的方法已无法为临床提供及时准确的疗效信息[22],CTC检测在肿瘤疗效监测方面赋予了重要作用。首先,通过检测CTC的组分蛋白,有助于临床治疗方案的选择。例如,在乳腺癌患者中,CTC表面的HER2状态可以辅助指导靶向药物的使用,即使是原发肿瘤HER2阴性的患者,也可因为检测到HER2阳性的CTC,从而采取有效的靶向治疗并从中获益[23]。同样,FUJII等[24]在转移性乳腺癌患者中分析ER的表达,发现在原发肿瘤ER阳性的患者中,出现了ER阴性的CTC,能够解释ER靶向治疗失败的原因,得出监测CTC的ER表达可以优化乳腺癌治疗的结论。
CTC表面标志物也有助于免疫疗法的评估;CTC检测可能成为一种可靠的方法,反映肿瘤整体的生物学特性,对免疫治疗策略的抉择至关重要[25]。例如在胃肠道肿瘤中,CTC表面的PD-L1表达水平可作为筛查PD-1/PD-L1阻断疗法的预测指标,关注CTC的动态变化可监测免疫治疗的有效性[26]。此外,在晚期非小细胞肺癌患者的自然杀伤细胞治疗后,CTC数量的减少与治疗疗效密切相关,CTC也是评估自然杀伤细胞疗法疗效的标志物[27]。
其次,CTC计数和表面标志物是监测疾病进展、治疗的有力工具,其内部的核酸组分也具有提供临床治疗信息的巨大潜力[28]。一些研究表明,仅CTC计数不足以指导治疗决策,但对CTC进行核酸分析,可以辅助靶向治疗方案的确定[29]。例如通过筛选CTC中的鼠类肉瘤病毒癌基因、表皮生长因子受体、HER2、ER等基因突变,将CTC基因组与原发肿瘤基因组进行差异分析,能为靶向治疗动态监测提供新的见解[30]。对CTC进行RNA分析可用于耐药相关分子的鉴定。MIYAMOTO等[31]对前列腺癌患者外周血CTC进行单细胞RNA分析,发现CTC与原发肿瘤之间存在表达谱差异,相关信号通路的异质性是导致雄激素治疗无效的原因。在局部晚期直肠癌的CTC中,通过原位杂交检测胸苷酸合酶mRNA发现,胸苷酸合酶 mRNA表达的患者不存在病理完全缓解的情况,对新辅助化疗不敏感,提示CTC的核酸分析可准确预测病理完全缓解情况,从而免除根治性手术的可能[32]。
最后,CTC可作为探索肿瘤新生细胞和治疗策略研究的新手段[33]。从晚期肿瘤患者中分离出的CTC可制备异种移植物,进行功能表型和药理研究;制备离体培养物,进行药物筛选和全基因组、蛋白质组分析等[34]。ZHANG等[35]从间变性淋巴瘤激酶(ALK)阳性肺癌患者中获得CTC进行离体培养,并用2种ALK抑制剂:赛可瑞和色瑞替尼进行药物敏感性测试,发现色瑞替尼是一种更有效的ALK抑制剂。这种通过分离CTC建立体外模型、进行个体化药物治疗的研究,为CTC在疗效监测方面的转化应用打开了新的思路。
3.3CTC与肿瘤患者预后 通常情况下,CTC数量随着肿瘤远处转移的进展而增加,研究发现CTC计数与无进展生存期(PFS)和总生存期(OS)密切相关,可作为评估临床预后和复发风险的重要依据[36]。在早期前列腺癌、乳腺癌和结直肠癌中应用的CellSearch系统,每7.5 mL外周血中有≥5个CTC是PFS减少的有效预测指标[37]。
此外,CTC表面特异性标志物的变化对判断肿瘤的预后情况有重要价值。SPARANO等[38]在乳腺癌复发患者中发现,ER阳性CTC患者比ER阴性CTC患者的复发风险高13.1倍。WANG 等[39]发现在放疗后的转移性肺癌患者中,CTC PD-L1的表达增加与预后不良相关,PD-L1阳性的CTC可作为恶性肿瘤预后的标志物。
在核酸水平上,一项Meta分析发现,在非转移性结直肠癌中,通过PCR方法检测CTC阳性患者的OS和无病生存期(DFS)较CTC阴性患者明显缩短;并且CTC与许多预后不良指标相关,如淋巴结转移、血管侵犯、肿瘤分化程度低、TNM晚期等[40]。通过数字PCR方法检测胰腺癌患者CTC的基因表达,发现未经治疗的胰腺癌患者其CTC中具有较高的ALCAM、POU5F1B和SMO mRNA表达水平,这些患者的PFS和OS明显缩短[41]。HINZ等[42]使用CK20实时荧光定量PCR方法检测CTC,发现其是结肠癌的独立预后标志物,CTC阳性患者的复发风险明显升高。
早在2010年美国癌症联合委员会制订的《肿瘤分期指南》中,已把CTC列入TNM分期系统[43]。cM0(i+)微转移的分期概念出现在传统检测方法认定肿瘤尚未达到M1水平,但循环体液中却能检出CTC的肿瘤转移早期阶段。虽然这种分期在临床实践中很少使用,CTC能否作为可靠的分期标准还有待商榷,但是CTC作为肿瘤分期的重要工具,已受到广泛重视。例如在胃癌中,CTC≥4的患者比例随着肿瘤分期的增加而增加,胃癌患者处干肿瘤分期Ⅳ期时其比例可高达95.24%[44]。CRISTOFANILLI等[45]分析了2 436例复发转移性乳腺癌患者,将每7.5 mL 5个CTC设为临界值进行分层,CTC≥5被列为Ⅳaggressive期,CTC<5为Ⅳindolent期,并且使用Kaplan-Meier曲线和Log-rank检验分析发现前者的OS明显缩短(16.0个月vs.36.3个月,P<0.001),从而证明CTC是转移性乳腺癌Ⅳ期分层的理想标志物。
4 结语及展望
CTC检测作为液体活检技术的重要成员,在肿瘤诊疗方面发挥重要作用。CTC携带了原发肿瘤的异质性信息,可作为一种有效的生物标志物和模型工具。通过非侵入性活检、分离并鉴定的CTC,在肿瘤早期诊断、实时疗效监测和预后评估等方面得到广泛应用。但是,目前CTC检测在检测技术的优化、临床应用的完善上仍然有着较大的提升空间。一方面CTC检测技术仍在不断更新,新兴发展的检测技术需要充分验证,获得批准才能进入临床;另一方面,肿瘤异质性一直是肿瘤诊疗的一大难题,CTC异质性能否反映肿瘤全貌,在临床应用上仍然面临着挑战。
随着科技不断进步,在单细胞水平上对CTC进行基因组、转录组、蛋白质组分析,以及CTC体外模型的不断完善[46],可促进肿瘤研究的不断深入,为肿瘤诊断、治疗、预后、病因机制和药物开发等领域开拓新的视野。相信在不久的将来,随着技术的持续改进、标准化方案的制订、待解决难题的不断攻克,CTC检测将会为肿瘤临床诊疗带来更多便利。

