乙草胺胁迫下水位对湿地芦苇生长及土壤酶活性的影响
冯岚 严岩 闫兴成 韩建刚

摘 要:為揭示除草剂乙草胺胁迫下不同水位对湿地植物芦苇生长发育的影响及土壤酶的响应,为湿地生态恢复提供科学依据,本文通过室内模拟试验研究乙草胺胁迫下水位在0、 5、 10、15 cm时,对湿地芦苇生长发育及土壤酶活性的影响。结果表明:在水深15 cm时,除草剂乙草胺降解速率较快,乙草胺胁迫下水位波动对湿地芦苇的株高生长量、茎粗和干重无显著影响,湿地芦苇的生长不受影响,在生理特性方面水深10 cm时,芦苇叶片叶绿素含量最高,为0.36 mg/g,显著高于水深0 cm时的含量,而此时,可溶性糖含量最大为42.17 mg/g;在水深15 cm时,芦苇叶片可溶性糖含量较低,显著低于其他处理;乙草胺胁迫下随着水位的加深,土壤过氧化氢酶和碱性磷酸酶活性在各个处理水平间差异不显著,水深10 cm时,蔗糖酶活性最大,为0.19 mg/g。因此,除草剂乙草胺质量分数为139.88 μg/kg,水深10 cm时,土壤酶活性较高,可增强土壤中相关营养元素的转化效率,促进湿地芦苇生长发育。
关键词:水位;乙草胺;湿地;芦苇;土壤酶
中图分类号:S154; X52; X826 文献标识码:A 文章编号:1006-8023(2021)02-0024-06
Effects of Water Levels on Wetland Reed Growth and Soil
Enzyme Activities Under Acetochlor Stress
FENG Lan1,2, YAN Yan3*, YAN Xingcheng4, HAN Jiangang5,6,7
(1.College of Civil Engineering, Nanjing Forestry University, Nanjing 210037, China;2.Ecological Complexity and Modeling
Laboratory, Department of Botany and Plant Sciences, University of California, Riverside CA, 92521, USA; 3.Ecological Center,
Nanjing Institute of Environmental Sciences, Ministry of Ecology and Environment, Nanjing 210042, China; 4.Sorbonne Université,
UMR 7619 METIS, Paris 75005, France; 5.College of Biology and the Environment, Nanjing Forestry University, Nanjing 210037, China;
6.Co-Innovation Center for the Sustainable Forestry in Southern China, Nanjing Forestry University, Nanjing 210037, China;
7.National Positioning Observation Station of Hungtse Lake Wetland Ecosystem in Jiangsu Province, Hongze 223100, China)
Abstract:In order to reveal the effect of water level on the growth of wetland plant reeds and the response of soil enzymes under herbicide acetochlor stress, and to provide a scientific basis for wetland ecological restoration, this paper conducted indoor simulation experiments to studied the impact of different water levels on the growth of wetland reed and soil enzyme activity at the water depth of 0, 5, 10 and 15cm under acetochlor stress. The results showed that the degradation rate of acetochlor was fast at water depth of 15 cm. Under the stress of acetochlor with increasing water depths, the plant height, stem diameter and dry weight of reed were not significant, indicating the growth was not affected. In terms of physiological characteristics, chlorophyll content in reed leaves was the highest at water depth of 10 cm and was 0.36 mg/g higher than water depth of 0 cm. And soluble sugar content was 42.17 mg/g. The soluble sugar content in reed leaves at water depth of 15 cm was significantly lower than other treatments. However, effects of catalase and alkaline phosphatase activities in wetland soil were not significant between any treatments with the increase of water level under herbicide acetochlor stress. Sucrase activity was highest with 0.19 mg/g when water depth was 10 cm. Therefore, the concentration of herbicide
收稿日期:2020-10-24
基金项目:国家自然科学基金(42007151);国家重点研发计划课题(2017YFC0505803);江苏省高校自然科学研究面上项目(19KJB610015);南京林业大学青年科技创新基金(CX2017027);南京林业大学大学生实践创新训练计划项目(2019NFUSPITP0473)
第一作者简介:冯岚,博士,讲师。研究方向为工程环境和森林生态。E-mail: fenglan0108@126.com
通信作者:严岩,博士,助理研究员。研究方向为生态学。E-mail: jshayanyan@163.com
引文格式:冯岚, 严岩,闫兴成,等. 乙草胺胁迫下水位对湿地芦苇生长及土壤酶活性的影响[J].森林工程,2021,37(2):24-29.
FENG L, YAN Y, YAN X C, et al. Effects of water levels on wetland reed growth and soil enzyme activities under acetochlor stress[J]. Forest Engineering,2021,37(2):24-29.
acetochlor was 139.88 μg/kg at water depth of 10 cm, reed growth and soil enzyme activity in wetland were better, as well as enhance the conversion efficiency of related nutrients in soil and promote the growth and development of wetland reeds.
Keywords:Water level; acetochlor; wetland; reed; soil enzyme
0 引言
近年來,湿地生态需水研究已成为生态水资源研究的热点问题,湿地植物生长需水规律和湿地土壤环境受水质影响是湿地生态需水研究的重要组成部分。农田退水是湿地可利用水资源的重要补给方式之一[1-2],而农田在退水中的污染物是影响湿地水质的主要原因[3]。中国是水稻生产大国,水稻种植面积占全国耕地面积的23%[4]。为了提高作物单产,农药的施用量逐年增加,在此过程中除草剂的残留尤为严重,它们通常会通过大气干湿沉降和农田退水等方式进入湿地中,威胁着湿地生态安全[5]。
水是湿地生态系统中最为敏感的环境因子,其中水位的变化影响着湿地空间分布和植物生长[6],以及湿地土壤酶活性的变化[7]。受自然汛期和农田退水等因素影响,湿地水域的水位及水体常常表现为时间和空间上的梯度性和斑块性[8]。但针对除草剂胁迫下不同水位变化对湿地植物生长及土壤酶活性的影响鲜有报道。除草剂乙草胺是一种苗前选择性除草剂,多用于清除一年生禾本科杂草及部分阔叶杂草,因此使用范围广泛[9],目前已有研究表明乙草胺对一些植物和水生生物有致命性风险[10-11]。芦苇作为典型且分布广泛的湿地优势植物种群,具有良好的生态功能和广泛的抗逆性,同时具有良好的经济价值。本文研究乙草胺胁迫下水位变化对湿地植物芦苇生长发育及土壤酶的影响,有助于评价农田在退水中除草剂在湿地不同水位下对湿地植物和土壤的生态风险,也可以为生态环境保护与恢复退化湿地生态系统提供科学理论基础。
1 材料与方法
1.1 试验材料
试验试剂为99.9%乙草胺乳油(大连越达农药化工有限公司)。甲醇为色谱级,购于J.T Baker (美国)。
1.2 试验方法
本实验的采集地为洞庭湖湿地,在芦苇湿地土层中采集0~20 cm土壤,并将其中的植物残体去除,而后将新鲜土样风干,过2 mm筛后均匀混合待用。供试验的土壤分别放置在试验桶中,并确保无除草剂乙草胺残留。
在实验室将芦苇种子育苗,芦苇株高长至5 cm时移栽到试验桶中,每个试验桶中存放10 kg已筛选好的土壤。待芦苇株高长势稳定并到达统一高度时施用乙草胺,质量分数为139.88 μg/kg。设置不同的淹水深度,分别为0 cm(水面与土面持平且保持表面湿润,形成气生环境)、5 cm(形成挺水环境)、10 cm(形成沉水环境)、15 cm(形成沉水环境),共4个处理水平,每个处理重复3次。
试验安排在常德职业技术学院的温室大棚,试验从2018年9月10日至10月1日,在此期间芦苇一直保持设定的淹水深度,且保证生长条件一致。
1.3 测定项目与方法
(1)有关芦苇生长指标的测定。
株高:在每个试验桶中随机选择3株芦苇并标记其株高,待试验结束时计算每个试验桶中芦苇的增长量。
茎粗:用游标卡尺测量芦苇的基部茎粗。
干质量:试验结束后将试验桶中的芦苇采集,装入信封袋进行105 ℃进行1 h杀青,再80 ℃干燥24 h,最后称取质量。
(2)叶绿素含量的测定。采用分光光度法[12]。
(3)可溶性糖含量的测定。采用蒽酮比色法[12]。
(4)土壤酶活性的测定。土壤碱性磷酸酶采用磷酸苯二钠比色法[13],土壤蔗糖酶采用3,5-二硝基水杨酸比色法[14],土壤过氧化氢酶采用高锰酸钾滴定法[14]。
(5)乙草胺的测定。
采用高效液相色(HPLC)谱法测定[15],对样品量取 100 mL 水样,用滤纸过滤入500 mL 分液漏斗中,在滤液中加入10%NaCl 水溶液100 mL,加入0.5 mL 6 mol/L 盐酸,分别用40、40、20 mL二氯甲烷萃取3 次,二氯甲烷液经无水硫酸钠脱水后,在40 ℃下减压蒸干,用10 mL 甲醇定容,供液相色谱测定。色谱柱为Hypersil ODS 4.6 mm×250 mm;流动相为甲醇∶水为40∶60;检测波长为220 nm;流速为1.0 mL/min;柱温为30 ℃;进样量为20 μL。
1.4 数据处理
本文研究中试验结果的显著性分析,采用邓肯氏新复极差多重比较法(DMRT);数据分析、作图采用SPSS 13.0和Origin 7.5。
2 结果与分析
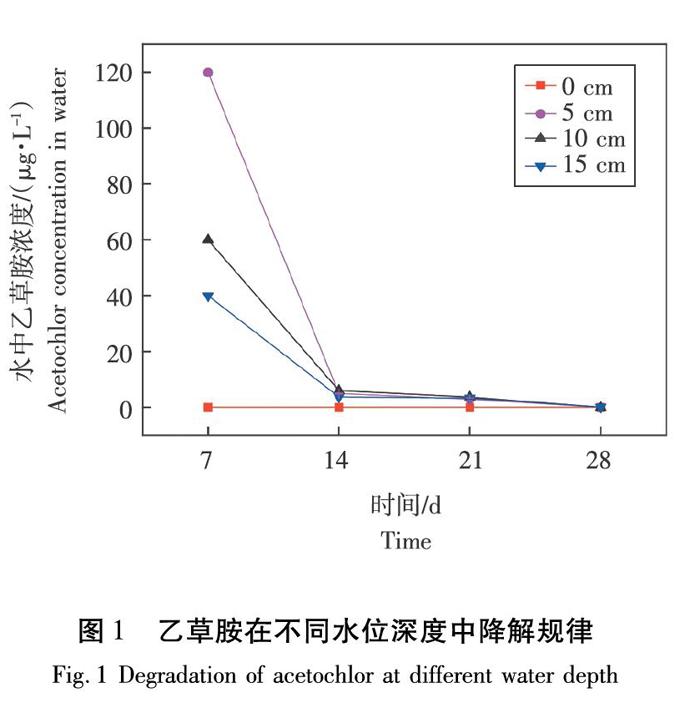
2.1 乙草胺在不同水位深度中的降解规律
由图1可知,试验初期(7 d),乙草胺在不同水位深度下降解速率较快,在5、10、15 cm不同水位深度下乙草胺的降解速率分别为98.87%、89.99%、90.74%。随着时间的增加,乙草胺在不同水位深度下降解速率趋于平稳,试验结束时(28 d),不同水位深度下均无乙草胺检出。
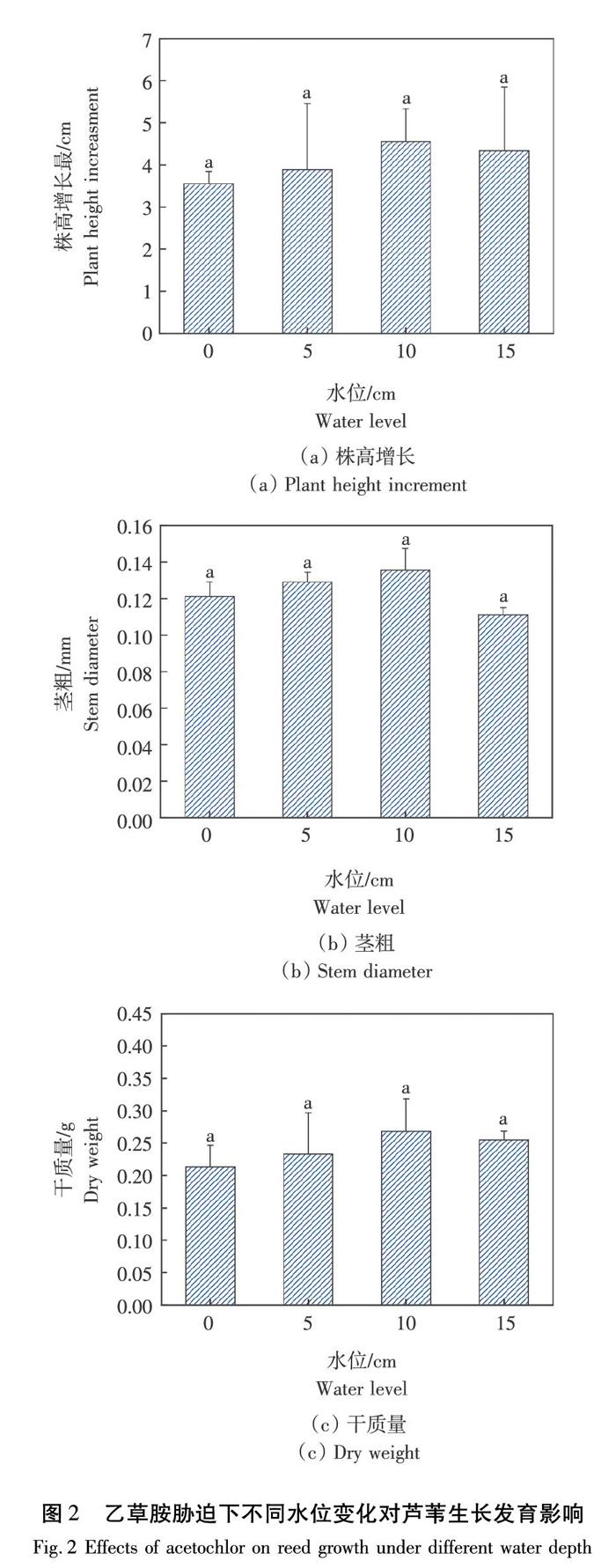
2.2 乙草胺胁迫下不同水位深度对湿地芦苇生长发育的影响
本研究中,随着水位不断加深,芦苇株高呈现出先增长后降低的趋势。由图2(a)可知,在水深10 cm时,芦苇株高增长量出现最大值,为4.55 cm,但与各个处理水平间未达到显著差异水平(P>0.05)。由图2(b)可知,芦苇茎粗在5 cm和10 cm水深下显著高于其他水位深度处理,且10 cm时芦苇茎粗最大。由图2(c)可知,随着水位深度的增加,芦苇干质量呈先增加后降低的趋势,在10 cm深度时干质量最高为0.26 g,但各个处理水平间未达到差异显著水平(P>0.05)。
2.3 乙草胺胁迫不同水位深度对湿地芦苇生理的影响
乙草胺胁迫下水位深度对湿地芦苇叶片叶绿素含量的影响如图3(a)所示,随着水位不断加深,芦苇叶片的叶绿素含量出现了与株高一样的发展趋势,呈先增加后降低的趋势。在5 cm和10 cm水深时叶绿素含量高于0 cm水深,高出的值分别为0.27 mg/g和0.36 mg/g,且在水深10 cm时叶绿素含量最高。由图3(b)可知,芦苇可溶性糖含量呈先增加后减小的趋势,在15 cm水深时显著低于其他处理,且10 cm水深时最大值是42.17 mg/g。
2.4 乙草胺胁迫下不同水位深度对湿地土壤酶的影响
乙草胺胁迫下不同水深对湿地土壤酶的影响如图4所示。由图4(a)可知,土壤过氧化氢酶随着水位深度的增加呈先增加后减少的趋势,且10 cm水深时,土壤过氧化氢酶活性显著高于其他处理水平(P<0.05)。由图4(b)可知,0 cm水深时碱性磷酸酶活性最大为0.12 mL/g,但各个处理水平间差异不显著(P>0.05)。由图4(c)可知,土壤蔗糖酶活性在5 cm和10 cm水深时显著高于其他水深处理(P<0.05),且10 cm时蔗糖酶活性最大为0.19 mL/g。
3 讨论与结论
水文过程是湿地的基本生态过程,水位的变化会对湿地植物生长发育产生明显的影响[16]。湿地植物对水位变化的响应可以直观地反映在植物的地上部分,随着水位的不断增加,植物裸露在水面以上的部分就会逐渐减少,随着植物的光合作用就会受到抑制,同样也会阻碍其正常生长[16]。挺水植物大多会分配更多的生物量到地面上的部分,增加株高以伸出水面[17],从而自身获取更多有利的光合条件或生存条件[18-19]。本研究中乙草胺胁迫下湿地芦苇随着水深的增加,株高增长量和茎粗呈增加趋势,但各处理水平间差异不显著。水位深度增加会促进植物体内乙烯迅速聚集[20-21],促使植物增加节长度和减少分枝数等方式来增加株高和提高光能利用率,与此同时,植物体内乙烯能够提高叶绿素酶基因表达和酶活性,从而降低自身叶绿素含量[22],这是湿地植物受到水深胁迫的策略。植物体中可溶性糖是光合作用的主要产物,乙草胺胁迫下水深最深时,芦苇叶片可溶性糖含量最低,而芦苇叶片叶绿素含量则呈现先增加后降低的趋势,这两种物质含量的变化也是植物自身生理过程与外在环境条件综合作用的结果。作为电子传递链的抑制剂与解偶联剂,乙草胺对一年生禾本科植物及某些闊叶植物的光合作用会产生一些影响[23],但本研究显示乙草胺胁迫下不同水深对芦苇的生理特性并无显著影响,主要原因可能是乙草胺在湿地中降解速度较快。
湿地土壤酶活性是湿地生态功能的重要指标[24],土壤过氧化氢酶能很好地抑制土壤及生物体内新陈代谢过程中产生的过氧化氢,并使土壤与生物体免受于其威胁。但在乙草胺胁迫下不同水位深度使得湿地土壤过氧化氢酶活性呈现先增加后降低的趋势,这与已有的研究结果一致[25-26]。土壤碱性磷酸酶可以帮助土壤中的有机磷化物转化为植物可吸收的无机磷酸盐,因此对于植物生长具有重要作用。本研究中,乙草胺胁迫下不同水位对湿地土壤碱性磷酸酶活性未表现出抑制作用,这与淹水条件下酰胺类除草剂对土壤碱性磷酸酶的影响效果相似[27]。乙草胺胁迫下在水深10 cm时,湿地土壤中蔗糖酶活性偏高,这与已有的研究结果相反,初步推断产生这一结果的原因可能是在不同生境下,酰胺类除草剂可能对土壤微生物种群结构产生了不同的影响[28],另外,这一结果也有可能与土壤中微生物的种群数量有关[29-32]。乙草胺胁迫下不同水深对湿地土壤酶活性的影响并不相同,这是由于同一底物对不同酶的响应不同,除草剂有可能成为最适宜底物,而在另外一种酶中扮演着天然抑制剂角色。
芦苇湿地系统在乙草胺的胁迫下,对不同水位深度变化的生态响应是一个复杂过程,其中涉及许多物质代谢和激素调节等生理生化过程。本文对乙草胺胁迫下不同水深对湿地芦苇生长发育、生理生化及土壤酶活性影响开展研究,而其对湿地芦苇分子生物学特性的影响还有待进一步研究。
【参考文献】
[1]JIA Z, LUO W, XIE J, et al. Salinity dynamics of wetland ditches receiving drainage from irrigated agricultural land in arid and semiarid regions[J]. Agricultural Water Management, 2011, 100(1): 9-17.
[2]SCHOCK N T, MURRY B A, UZARSKI D G. Impacts of agricultural drainage outlets on great lakes coastal wetlands[J]. Wetlands, 2014, 34(2): 297-307.
[3]MAGNER J, ALEXANDER S C. Drainage and nutrient attenuation in a riparian interception-wetland: southern Minnesota, USA[J]. Environmental Geology, 2007, 54(7): 1367-1376.
[4]刘珍环,杨鹏,吴文斌,等.近30年中国农作物种植结构时空变化分析[J].地理学报,2016,71(5):840-851.
LIU Z H, YANG P, WU W B, et al. Spatio-temporal changes in Chinese crop patterns over the past three decades[J]. Acta Geographica Sinica, 2016, 71(5):840-851.
[5]章光新.东北粮食主产区水安全与湿地生态安全保障的对策[J].中国水利,2012,62(15):9-11.
ZHANG G X. Measures for securing water safety of main grain production base and wetland ecological safety in Northeast China[J]. China Water Resources, 2012, 62(15): 9-11.
[6]李文,王鑫,潘艺雯,等.不同水淹深度对鄱阳湖洲滩湿地植物生长及营养繁殖的影响[J].生态学报,2018,38(9):3014-3021.
LI W, WANG X, PANG Y W, et al. Effects of different water depths on the growth and vegetative reproductive characteristics of wetland vegetation in Lake Poyang[J]. Acta Ecologica Sinica, 2018, 38(9): 3014-3021.
[7]万忠梅,宋长春,郭跃东,等.毛苔草湿地土壤酶活性及活性有机碳组分对水分梯度的响应[J].生态学报,2008,28(12):5980-5986.
WAN Z M, SONG C C, GUO Y D, et al. Effects of water gradient on soil enzyme activity and active organic carbon composition under Carex lasiocarpa marsh[J]. Acta Ecologica Sinica, 2008, 28(12): 5980-5986.
[8]STEINMAN A D, OGDAHL M E, WEINERT M, et al. Influence of water-level fluctuation duration and magnitude on sediment water nutrient exchange in coastal wetlands[J]. Aquatic ecology, 2014, 48(2): 143-159.
[9]TOMLIN C D S. The e-Pesticide manual. 15th edition. Version 5.2[M]. Hampshire, U.K.: BCPC, 2011.
[10]羅娜,刘欣.除草剂乙草胺的毒性及其内分泌干扰活性研究进展[J].环境科学导刊,2010,29(6):10-13.
LUO N, LIU X. Progress on toxicity and endocrine disrupting activity of herbicide acetochlor[J]. Environmental Science Survey, 2010, 29(6): 10-13.
[11]TAN W, LI Q L, ZHAI H. Photosynthesis and growth responses of grapevine to acetochlor and fluoroglycofen[J]. Pesticide biochemistry and physiology, 2012, 103(3): 210-218.
[12]张志良、李小方.植物生理学实验指导.5版.[M].北京:高等教育出版社,2016.
ZHANG Z L, ZHANG X F. Plant physiology experiment guide (The 5th edition)[M]. Beijing: Higher Education Press, 2016.
[13]严昶升.土壤肥力研究方法[M].北京:农业出版社,1988.
YAN C S. Soil fertility research methods[M]. Beijing: Agricultural Press, 1988.
[14]关松荫.土壤酶及其研究法[M].北京:农业出版社,1986.
GUAN S Y. Soil enzymes and their research methods[M]. Beijing: Agricultural Press, 1986.
[15]蓝月,胡月,王琰,等.界面聚合制备乙草胺微胶囊及其杂草控制效果和环境残留[J].中国农业科学,2017,50(14):2739-2747.
LAN Y, HU Y, WANG Y, et al. Preparation of acetochlor microcapsules by interracial polymerization and the environmental behavior and control efficacy[J]. Scientia Agricultura Sinica, 2017, 50(14): 2739-2747.
[16]徐金英,陈海梅,王晓龙.水深对湿地植物生长和繁殖影响研究进展[J].湿地科学,2016,14(5):725-732.
XU J Y, CHEN H M, WANG X L. A review on water depth effect on the growth and reproduction of plants in the wetlands[J]. Wetland Science, 2016, 14(5): 725-732.
[17]WANG P, ZHANG Q, XU Y S, et al. Effects of water level fluctuation on the growth of submerged macrophyte communities[J]. Flora, 2016, 223: 83-89.
[18]BAI X, CHEN K N, ZHAO H G, et al. Impact of water depth and sediment type on root morphology of the submerged plant Vallisneria natans[J]. Journal of Freshwater Ecology, 2015, 30(1): 75-84.
[19]ZHANG X K, LIU X Q, DING Q Z. Morphological responses to water-level fluctuations of two submerged macrophytes, Myriophyllum spicatum and Hydrilla verticillata[J]. Journal of Plant Ecology, 2012, 6(1): 64-70.
[20]CAO J J, WANG Y, ZHU Z L. Growth response of the submerged macrophyte Myriophyllum spicatum to sediment nutrient levels and water-level fluctuations[J]. Aquatic Biology, 2012, 17(3): 295-303.
[21]古勇波,潘艷文,陈方圆,等.水位和氮浓度对三江藨草幼苗生长和生物量分配的影响[J].生态学杂志,2019,38(8):2302-2309.
GU Y B, PAN Y W, CHEN F Y, et al. Effects of water level and nitrogen concentration on growth and biomass allocation of Scirpus nipponicus seedlings[J]. Chinese Journal of Ecology, 2019, 38(8): 2302-2309.
[22]YIN X R, XIE X L, XIA X L, et al. Involvement of an ethylene response factor in chlorophyll degradation during citrus fruit degreening[J]. The Plant Journal, 2016, 86(5): 403-412.
[23]LAWRENCE B H, BOND J A, EDWARDS H M, et al. Effect of fall-applied residual herbicides on rice growth and yield[J]. Weed Technology, 2018, 32(5): 526-531.
[24]XIAO Y, HUANG Z, LU X. Changes of soil labile organic carbon fractions and their relation to soil microbial characteristics in four typical wetlands of Sanjiang Plain, Northeast China[J]. Ecological Engineering, 2015, 82: 381-389.
[25]季淮,韩建刚,李萍萍,等. 洪泽湖湿地植被类型对土壤有机碳粒径分布及微生物群落结构特征的影响[J]. 南京林业大学学报(自然科学版), 2021, 45(1): 141-150.
JI H, HAN J G, LI P P, et al. Effects of different vegetation types on soil organic carbon particle size distribution and microbial community structure in Hongze Lake Wetland[J].Journal of Nanjing Forestry University (Natural Science Edition), 2021, 45(1): 141-150.
[26]荆瑞勇,王丽艳,王彦杰,等.乙草胺对土壤微生物数量和酶活性的影响[J].中国生态农业学报,2010,18(6):1302-1305.
JING R Y, WANG L Y, WANG Y J, et al. Effect of acetochlor application on soil microorganism number and enzymes activities[J]. Chinese Journal of Eco-Agriculture, 2010, 18(6): 1302-1305.
[27]RASOOL N, RESHI Z A, SHAH M A. Effect of butachlor (G) on soil enzyme activity[J]. European Journal of Soil Biology, 2014, 61: 94-100.
[28]张仕颖,夏运生,肖炜,等.除草剂丁草胺对高产水稻土微生物群落功能多样性的影响[J].生态环境学报,2013,22(5):815-819.
ZHANG S Y, XIA Y S, XIAO W, et al. Effects of butachlor on the functional diversity of microbial communities in high-yield paddy soil[J]. Ecology and Environment Sciences, 2013, 22(5): 815-819.
[29]刘宇彤,霍璐阳,李志国,等.不同处理方式对土壤酶活性的影响[J].森林工程,2019,35(2):21-26.
LIU Y T, HUO L Y, LI Z G, et al. Effects of different treatments on soil enzyme activity[J]. Forest Engineering, 2019, 35(2):21-26.
[30]閆德仁,张胜男,黄海广,等.沙地樟子松人工林土壤养分和酶活性变化研究[J].西部林业科学,2019,48(3):10-15.
YAN D R, ZHANG S N, HUANG H G, et al. Changes of soil nutrients and enzyme activities for Pinus sylvestris var. mongolica plantation in sandy land[J]. Journal of West China Forestry Science, 2019, 48(3):10-15.
[31]曹越,赵洋毅,王克勤,等.滇中坡改梯不同种植方式对土壤酶活性的影响[J].西部林业科学,2020,49(4):91-98.
CAO Y, ZHAO Y Y, WANG K Q, et al. Effects of different planting methods on soil enzyme activity in central Yunnan Province[J]. Journal of West China Forestry Science, 2020, 49(4):91-98.
[32]刘莹莹,苏妮尔,赵彩鸿,等.落叶松凋落叶水提液对苗圃土壤微生物数量和土壤酶活性的影响[J].森林工程,2020,36(5):24-33.
LIU Y Y, SU N E, ZHAO C H, et al. Effects of larch litter water extract on soil microorganism quantity and soil enzyme activity in nursery[J]. Forest Engineering, 2020, 36(5):24-33.

