岩藻寡糖的制备及其抗氧化与益生活性
曹声生,朱本伟,高 翔,王剑朋,杜媛媛,周婉婷,姜进举,周明柱,姜 帅
(1.南京工业大学 食品与轻工学院,江苏 南京 211800;2.青岛明月海藻集团有限公司,山东 青岛 266400;3.宿迁市南京工业大学新材料研究院,江苏 宿迁 223800)
岩藻多糖是一种天然杂多糖,是海带(Laminariajaponica)、裙带菜(UndariapinnatifidaSuringar)等大型褐藻门植物细胞间组织的主要成分,其结构上是由L-岩藻糖作为主链骨架,并通过1,2或者1,3及1,4糖苷键与其他多种糖残基(甘露糖、鼠李糖、葡萄糖醛酸和木糖等)及硫酸基结合形成[1]。研究发现,岩藻多糖具有多种生物活性:Silva等[2]发现来源于Padinagymnospora的岩藻多糖具有显著的抗凝血活性,其结构中的4-α-L-岩藻糖单元C3位置的硫酸酯含量对其抗凝血活性具有重要作用;Rocha等[3]研究发现,来源于Spatoglossumschroederi的岩藻多糖在体外实验中未表现出抗凝血活性,但是在形成血栓的动物模型中却表现出显著的抗血栓形成作用。硫酸化的多糖例如岩藻多糖、卡拉胶等在实验中都表现出了抗病毒活性:Hayashi等[4]研究发现来源于Undariapinnatifida的岩藻多糖可以抑制单纯疱疹病毒(HSV)的增殖,并能增强其免疫功能来抵御HSV病毒的侵染;Hidari等[5]研究发现岩藻多糖可以有效抑制登革热Ⅱ型病毒的侵染,通过与DEN2颗粒进行特异性地结合来达到抑制病毒与细胞合体的形成。此外,岩藻多糖还表现出显著的抗肿瘤活性:Alekseyenko等[6]发现岩藻多糖可以有效抑制小鼠肺腺癌细胞的转移;Hyun等[7]研究发现,利用岩藻多糖处理HCT-15结肠癌细胞后,部分细胞出现DNA断裂等细胞凋亡现象,可有效抑制结肠癌细胞的生长和转移。另外,岩藻多糖还具有多种免疫调节活性:Tissot等[8]研究证实岩藻多糖可以抑制正常人血清中的补体蛋白,以此来抑制细胞中补体的激活;Mizuno等[9]发现岩藻多糖可以刺激RAW264.7细胞产生肿瘤坏死因子,从而抑制细胞中白介素mRNA的表达。
综上,岩藻多糖具有多种生物活性,受到了越来越多的来自于药物研发、功能食品开发等领域研究者的重视与关注,但是有关岩藻多糖益生等活性的研究却鲜有报道。此外,岩藻多糖存在分子量大、吸收性差、难以通过血脑屏障及吸收率低等缺点,其应用受到了一定限制[10]。作为岩藻多糖的降解产物,岩藻寡糖(FOS)具有分子量小、水溶性和吸收性好、生物利用度高等多种岩藻多糖所不具备的优点,克服了多糖在应用过程中受到的种种限制,在功能食品开发、新型保健品开发等领域具有很好的应用前景。因此,通过适当的方法将岩藻多糖的分子量降低,将其降解成小分子的寡糖是目前岩藻多糖及其产品开发亟待解决的问题。
本研究中,笔者以岩藻多糖为原料,采用酶法降解的方式制备了不同聚合度的岩藻寡糖混合物,通过电喷雾质谱对其结构进行表征,并采用多种方法对降解得到的岩藻寡糖的抗氧化及益生活性进行研究,以期为岩藻多糖资源的开发奠定基础。
1 材料与方法
1.1 材料与试剂
岩藻多糖(来源于海带Laminariajaponicia),山东结晶集团;ABTS+·、DPPH·,美国Sigma公司;透析袋(分子量100),索莱宝公司;植物乳杆菌(Lactobacillusplantarum,BIO-097551)和嗜酸乳杆菌(Lactobacillusacidophilus,BIO-099454),中国工业微生物菌种保藏中心;岩藻多糖降解酶,实验室自制;无水乙醇、浓H2SO4、苯酚、水杨酸、丙酮、石油醚、NaCl、氯仿、正丁醇和抗坏血酸等化学试剂均为市售分析纯。
1.2 仪器与设备
Wtherm-B5型开口加热循环浴槽、C410型防腐蚀隔膜真空泵,德国Wiggens公司;Scientz-18N型压盖型冷冻干燥机,宁波新芝生物科技公司;Allegra64R型高速台式冷冻离心机,美国贝克曼公司;Ultrospec 7000型紫外可见光分光光度计,美国GE公司;LTQ XL线性离子阱质谱分析仪,美国赛默飞公司。
1.3 实验方法
1.3.1 岩藻寡糖的酶法制备
称取20 g岩藻多糖,溶于2 L去离子水中,加入适量岩藻多糖降解酶进行水解反应,反应温度为30 ℃,反应48 h后,用二硝基水杨酸(DNS)法测定不同反应时间的还原糖含量[11],将反应体系加热到100 ℃来终止反应。将反应得到的产物冷冻干燥,得到岩藻寡糖粉末。
1.3.2 岩藻寡糖的电喷雾质谱分析
取少量降解得到的寡糖,用透析袋除去里面的无机盐等小分子杂质,冻干后得到样品,溶于水和乙腈1∶ 1体积比的混合液中,得到样品液,取2 mL,用LTQ XL线性离子阱质谱分析仪对样品进行负离子模式分析,条件如下:电源电压4.5 kV,毛细管温度275~300 ℃,管内电压250 V,鞘内气体30 AU。扫描范围150~2 000m/z。
1.3.3 岩藻寡糖的体外抗氧化活性分析
1)ABTS+·清除能力计算。参照文献[12]中的方法,将7.0 mmol/L ABTS+·溶液和2.45 mmol/L过硫酸钾溶液等体积混合,室温条件下避光反应16 h,用磷酸盐(PBS)缓冲液(pH 7.4)稀释25倍,使其在734 nm处吸光值为0.700±0.050,即得ABTS+·工作液。取不同质量浓度(0.2、0.4、0.6、1、2、4、8和10 mg/mL)的寡糖溶液0.2 mL,加入0.8 mL ABTS+·工作液,振摇充分混合,避光静置15 min后,在734 nm波长处测定吸光值,每组实验做3个平行,以相同浓度梯度的维生素C作为对照。计算见式(1)。
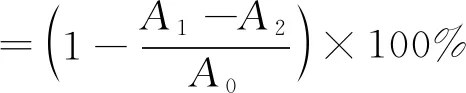
(1)
式中:A1为样品反应后的吸光值;A2为ABTS+·工作液由等体积的PBS缓冲液代替的吸光值;A0为样品溶液由等体积纯水代替的吸光值。
2)DPPH·清除能力计算。参照文献[13]中的方法,吸取1.0 mL不同浓度的岩藻寡糖溶液,加入 1.0 mL的0.2 mmol/L 的DPPH·乙醇溶液,充分混匀后在室温下避光反应,分别在0.5、6和12 h后测定波长515 nm处的吸收值,每组实验做3个平行。计算见式(2)。
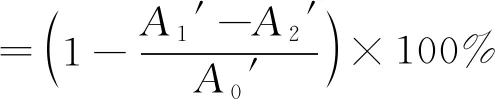
(2)
式中:A1′为样品反应后的吸光值;A2′为DPPH·溶液由等体积的无水乙醇溶液代替的吸光值;A0′为样品溶液由等体积纯水代替的吸光值。以岩藻寡糖浓度与对应的清除率做显性回归方程,以此计算清除率为50%时的寡糖浓度,即为半清除浓度IC50。
3)·OH清除能力计算。按照文献[14]中的方法,在4 mL离心管内依次加入0.25 mL 9 mmol/L FeSO4溶液,0.25 mL 9 mmol/L 水杨酸-乙醇溶液,3 mL不同浓度(0.2、0.4、0.6、1、2、4、8、10 mg/mL)的寡糖溶液和0.25 mL 8.8 mmol/L H2O2溶液,充分混匀后在室温下静置1 h,然后在510 nm处测定吸光值,每组实验平行3次,以相同浓度梯度的维生素C作为对照。计算见式(3)。
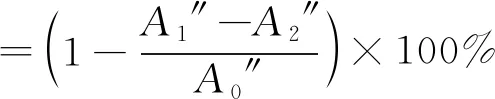
(3)
式中:A1″为样品反应后的吸光值;A2″为不加H2O2改由等体积纯水代替的吸光值;A0″为样品溶液由等体积纯水代替的吸光值。以岩藻寡糖浓度与对应的清除率做显性回归方程,以此计算清除率为50%时的寡糖浓度,即为半清除浓度IC50。
1.3.4 岩藻寡糖的益生活性分析
参照文献[15]中的方法,将植物乳杆菌(Lactobacillusplantarum)和嗜酸乳杆菌(Lactobacillusacidophilus)分别接入MRS液体培养基,37 ℃(嗜酸乳杆菌需厌氧)培养48 h,之后经两次转管复壮后备用。配制MRS液体培养基(不加葡萄糖),调节pH至6.8。分别称取50 mg的葡萄糖(glucose)和岩藻寡糖,加入菌种瓶中,每个样品做一组平行对照(blank)。然后将配制好的液体培养基分装入瓶中,分装体积为5 mL,这样培养基中碳水化合物(即糖含量)的质量分数为1%。另外,用不加糖的培养基作为对照组。将培养基在121 ℃灭菌20 min,冷却后接入200 μL复壮好的植物乳杆菌和嗜酸乳杆菌菌种,37 ℃(嗜酸乳杆菌需厌氧)培养,每隔2 h测一次OD值,绘制菌的生长曲线。
1.4 数据统计分析
分析结果以平均值±标准偏差(Mean ± SD)表示,采用SPSS 13.0软件对数据统计,每组实验设置3个平行实验。
2 结果与讨论
2.1 岩藻寡糖的制备与结构鉴定
2.1.1 岩藻多糖水解的还原糖曲线
为了监测岩藻多糖水解过程进行的程度,采用DNS法测定反应体系中不同时间的还原糖含量,并以此绘制了岩藻多糖的降解曲线,结果如图1所示。由图1可知:在反应的初始阶段,还原糖的含量迅速上升,当反应时间为10 h时,反应体系中的还原糖达到24 mg/mL;随着反应时间的进一步延长,反应体系中的还原糖含量趋向于稳定,当反应进行到48 h后,测得反应体系中的还原糖为27 mg/mL。
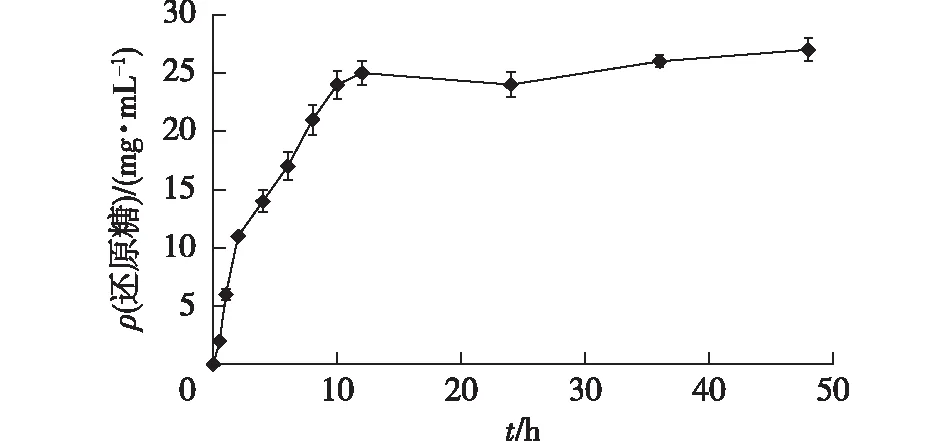
图1 岩藻多糖降解过程中的还原糖曲线Fig.1 The curve of reducing sugars during the degradation procedure of fucoidan
2.1.2 岩藻寡糖的结构鉴定
采用电喷雾质谱对降解得到的寡糖产物进行鉴定,结果如图2所示。由图2可知:寡糖混合物中主要包括单硫酸化([Fuc1SO3Na-Na]-、[Fuc2SO3Na-Na]-、[Fuc3SO3Na-Na]-、[Fuc4SO3Na-Na]-)、二硫酸化([Fuc2(SO3Na)2-Na]-、[Fuc4(SO3Na)2-Na]-、[Fuc5(SO3Na)2-Na]-)、三硫酸化([Fuc4(SO3Na)3-Na]-、[Fuc5(SO3Na)3-Na]-)和四硫酸化([Fuc4(SO3Na)4-Na]-、[Fuc5(SO3Na)4-Na]-)的岩藻糖及岩藻寡糖,分子量范围为243~1 133,说明酶通过内切模式作用于岩藻多糖底物,产生一系列具有不同聚合度的岩藻寡糖。
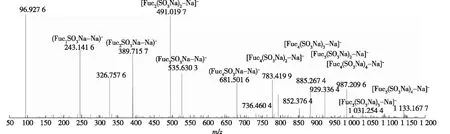
图2 岩藻寡糖的ESI-MS分析Fig.2 ESI-MS analysis of fucoidan oligosaccharides
2.2 岩藻寡糖的体外抗氧化活性
2.2.1 岩藻寡糖的ABTS+·清除能力
ABTS+·被广泛应用于测定样品的抗氧化能力。ABTS+·经氧化形成相对稳定的蓝绿色自由基,在734 nm处有吸收峰。当加入具有抗氧化能力的样品时,溶液会褪色,吸光值降低。图3为岩藻寡糖对ABTS+·的清除结果。由图3可知:岩藻寡糖具有显著的清除ABTS+·的能力,且清除率与浓度呈良好的剂量效应关系。当质量浓度为10 mg/mL时,岩藻寡糖对ABTS+·的清除率高达98.83%,接近于维生素C对ABTS+·的清除率。
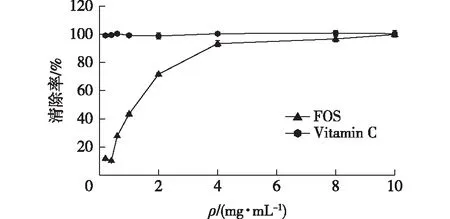
图3 岩藻寡糖对ABTS+·的清除能力Fig.3 Scavenging ability of fucoidan oligosaccharides on ABTS+· radicals
2.2.2 岩藻寡糖的·OH清除能力
·OH是细胞中最活泼的自由基,它可引发组织细胞的病变,导致各种疾病发生和加速机体衰老。岩藻寡糖对于·OH清除能力如图4所示。由图4可知:随着寡糖浓度的提高,·OH的清除率也随之上升,呈现出一定的量效关系,IC50为6.02 mg/mL。当岩藻寡糖质量浓度为10 mg/mL时,岩藻寡糖对·OH的清除率高达70.49%,而岩藻多糖对于·OH的清除率与浓度的关系未呈现出明显的量效关系。张加幸等[16]研究发现,在岩藻多糖质量浓度达到1.0 mg/mL时,清除能力不再随浓度增加出现明显变化,达到44.69%。因此可知,岩藻寡糖对于·OH的清除能力要优于岩藻多糖。
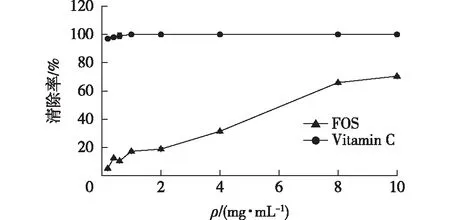
图4 岩藻寡糖对·OH的清除能力Fig.4 Scavenging ability of fucoidan oligosaccharides on ·OH radicals
2.2.3 岩藻寡糖的DPPH·清除能力
DPPH·是一种稳定的有机自由基,常用来测定样品是否具有抗氧化活性。考察岩藻寡糖的DPPH·清除能力,结果如图5所示。由图5可知,岩藻寡糖对DPPH·的清除率随着时间延长而增大。当反应时间为0.5 h、岩藻寡糖为0~10 mg/mL时,对DPPH·的清除率与寡糖浓度呈剂量关系,岩藻寡糖的IC50为6.46 mg/mL;当岩藻寡糖的质量浓度为10 mg/mL时,DPPH·的清除率达到81.94%。当反应时间为6 h、岩藻寡糖为0~10 mg/mL时,对DPPH·的清除率与寡糖浓度也呈剂量关系,IC50为3.02 mg/mL;当反应时间进一步延长到12 h、岩藻寡糖的质量浓度为10 mg/mL时,IC50为2.01 mg/mL,DPPH·的清除率达到94.91%。张加幸等[16]研究发现,岩藻多糖在2 mg/mL的质量浓度下,对DPPH·的清除率仅达到63.97%。因此,岩藻寡糖对DPPH·的清除能力远远高于岩藻多糖对DPPH·的清除能力,其原因可能是多糖在被酶法降解的过程中产生的寡糖含有很多不饱和键。
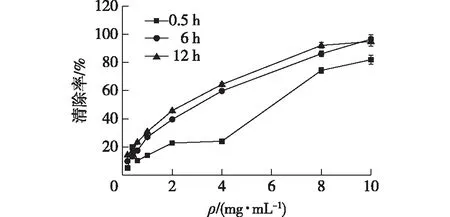
图5 岩藻寡糖对DPPH·自由基的清除能力Fig.5 Scavenging ability of fucoidan oligosaccharides on DPPH· radicals
2.3 岩藻寡糖的益生活性
2.3.1 岩藻寡糖对于植物乳杆菌的益生活性
笔者以植物乳杆菌(Lactobacillusplantarum)为研究对象,通过绘制菌株生长曲线的方法来测定岩藻寡糖的益生活性,结果如图6所示。由图6可知:岩藻寡糖和葡萄糖在菌株生长初期就显示出很好的促进菌株生长的能力,在菌株培养8 h时,菌液密度(OD600)就达到了1.36,与相同浓度的葡萄糖效果相似;但是随着培养时间的进一步延长,相同浓度的岩藻寡糖促进植物乳杆菌生长的效果要优于葡糖糖。因此,岩藻寡糖具有较好的益生活性。
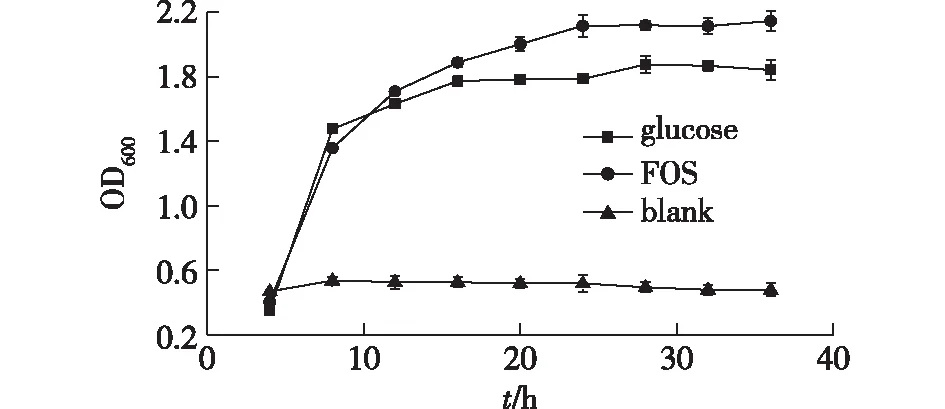
图6 岩藻寡糖对植物乳杆菌生长的影响Fig.6 Effects of fucoidan oligosaccharides on Lactobacillus plantarum
2.3.2 岩藻寡糖对于嗜酸乳杆菌的益生活性
笔者以嗜酸乳杆菌(Lactobacillusacidophilus)为研究对象,考察岩藻寡糖对于嗜酸乳杆菌的促生长作用,结果如图7所示。由图7可知:岩藻寡糖和葡萄糖在菌株生长初期就显示出很好的促进菌株生长的能力;与葡萄糖为对照的结果相比,在菌株生长初期,岩藻寡糖对于菌株的生长并未表现出明显的促进作用,但是随着培养时间的延长,岩藻寡糖开始表现出了促生长作用,菌株生长的速度明显加快且高于对照的结果,最终菌液密度(OD600)达到了1.43。
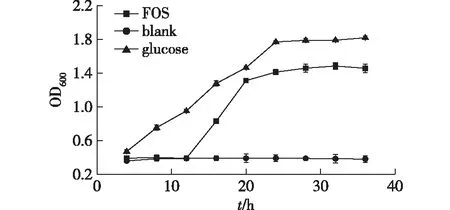
图7 岩藻寡糖对嗜酸乳杆菌生长的影响Fig.7 Effects of fucoidan oligosaccharides on Lactobacillus acidophilus
目前尚无有关岩藻多糖的益生活性的报道,因此无法与之进行比较,但有研究报道海洋寡糖如琼胶寡糖、壳寡糖等均具有显著的促进有益菌的生长和增殖作用,例如胡斌[17]发现1%添加量的新琼寡糖可以促进嗜酸乳杆菌(Lactobacillusacidophilus)的生长,并且可以缩短菌株的适应期。同样地,岩藻寡糖可以缩短植物乳杆菌(Lactobacillusplantarum)的适应期,其具体机制有待于进一步验证和分析。
3 结论
笔者以岩藻多糖为原料,利用酶法制备了不同聚合度的岩藻寡糖,并系统研究了其体外抗氧化活性和益生活性,研究结果表明岩藻寡糖具有较好的自由基清除能力,能够显著促进两种肠道有益菌的生长,具有进一步开发为新型益生元的应用潜力。以上研究结论将有助于进一步丰富对岩藻寡糖结构和活性的认识,并为海洋藻类多糖资源的深加工应用奠定理论基础。

