甘油葡萄糖苷αGG抗氧化性能及其对UV致细胞损伤保护修复的研究
陈 思,徐 铮,李梁斐,李 莎,徐 虹
(1.南京工业大学 食品与轻工学院 材料化学与工程国家重点实验室,江苏 南京 211800;2.江苏省先进生物与化学制造协同创新中心,江苏 南京 211800)
甘油葡萄糖苷(2-O-(α-D-glucopyranosyl)-sn-glycerol,αGG[1-2]),是一种糖苷化合物,由葡萄糖基和甘油基以糖苷键连接而成,是沙漠植物细胞在外界胁迫条件下合成的一种渗透压调节剂(osmolyte)。它可以保护细胞免受高渗、高温、干旱和紫外线等恶劣环境的破坏[3]。在日本清酒、味增和米醂中,也发现含有活性成分αGG[4-5]。由于低吸水性、高保湿性等特点,αGG可用作化妆品原料,提高皮肤保湿效果[6-7]。另外,αGG还是一种良好的化妆品添加剂,具有保湿、抗氧化和抗衰老等功效[8-9],可以消除化妆品洁面后的皮肤紧绷感[10]。
海藻糖(Tre)是一种安全、可靠的天然糖类,它是由2个葡萄糖分子以1,1-糖苷键构成的非还原性糖,有3种异构体,并对多种生物活性物质具有非特异性保护作用。卷柏作为一种复苏植物,其抗氧化系统在复苏过程中启动其保护酶防御机制抵抗水分胁迫,而海藻糖在卷柏保护生物分子过程中发挥着重要作用[11]。因此,在本研究中,笔者将海藻糖与αGG对3种自由基的清除效果作对比,并建立紫外辐射对L929细胞的损伤模型,研究αGG对受紫外损伤细胞的保护及修复作用[12-13],希望为αGG在抗衰老型化妆品领域的产品开发提供相关依据。
1 材料和方法
1.1 材料与仪器
αGG(分析纯,AR),德国Bitop AG公司;海藻糖(食品级),德州汇洋生物科技有限公司;焦性没食子酸(邻苯三酚)、浓盐酸、H2O2、七水合硫酸亚铁、水杨酸、乙醇均为分析纯AR,中国医药(集团)上海化学试剂公司;三羟甲基氨基甲烷(Tris)、1,1-二苯基-2-三硝基苯肼(DPPH)、DMEM高糖培养基、青链霉素、胰酶-EDTA、磷酸缓冲盐溶液(PBS)、3-(4,5-二甲基噻唑-2)-2 (MTT)均为生物试剂BR,上海化学试剂公司;小牛血清,杭州四季青生物工程有限公司;DCFH-DA荧光探针,南京建成生物工程研究所;去离子水,实验室自制。
752 S型紫外可见分光光度计,上海棱光技术有限公司;Multiskan GO型酶标仪、Heracell 150i型细胞培养箱、Lumina荧光分光光度计,Thermo Scientific公司;HH-3A型数显恒温水浴锅,国华电器有限公司;KQ 5200型超声波清洗器,南京实验仪器厂;BSA 224S型分析天平,上海天平仪器厂;SW-CJ-1B标准型净化工作台,苏州净化设备厂;紫外光辐照计,北京师范大学光电仪器厂 。
1.2 抗氧化活性测定
1.2.1 清除DPPH自由基(DPPH·)的能力测定
DPPH·是一种比较稳定的自由基,被广泛用于测定多糖样品的抗氧化能力[14-15]。配制DPPH的乙醇标准溶液,分别加入20、10、5、4、2、1和0.5 mg/mL的αGG及海藻糖溶液,摇匀,室温静置20 min,在517 nm处使用酶标仪测定吸光值A1。不同浓度的αGG及海藻糖溶液与体积分数95%乙醇溶液混合测得吸光值A2,蒸馏水与150 μL DPPH溶液混合后的吸光度A0为对照。平行测定3次,取平均值,计算见式(1)。
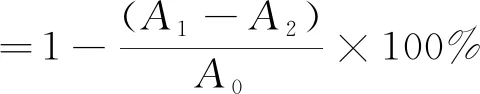
(1)
式中:A0为50 μL蒸馏水+150 μL DPPH溶液的吸光值;A1为50 μL样品溶液+150 μL DPPH溶液的吸光值;A2为50 μL样品溶液+150 μL 95%乙醇溶液的吸光值。
1.2.2 清除羟基自由基(·OH)的能力测定
选用Fenton反应法测定·OH清除率[16]。配制9 mmol/L的水杨酸-乙醇标准溶液,先加入9 mmol/L FeSO4,再分别加入20、10、5、4、2、1和0.5 mg/mL的αGG及海藻糖水溶液,最后加入8.8 mmol/L H2O2启动反应,摇匀,置于37 ℃中水浴反应30 min,以去离子水为空白对照,在510 nm下测定各待测样品的吸光值。考虑到样品本身的吸光值,以9 mmol/L FeSO4和9 mmol/L水杨酸-乙醇溶液100 μL、不同浓度的抗坏血酸样品溶液100 μL和100 μL去离子水作为样品调零。平行测定3次,取平均值,计算见式(2)。
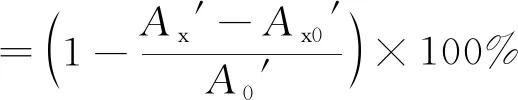
(2)
式中:A0′为空白对照组的吸光值;Ax′为样品组的吸光值;Ax0′为未加显色剂样品组的吸光值。

(3)
式中:A0″为空白对照组的吸光值;Ax″为样品的吸光值。
1.3 αGG对L929细胞活力影响的检测方法
采用MTT(methylthiazole-trazolium)法[19]检测αGG对小鼠成纤维细胞的活力影响。一定浓度条件下,细胞可摄取MTT,并被线粒体脱氢酶(主要是琥珀酸脱氢酶)氧化形成蓝紫色的难溶性颗粒,而死细胞无此功能;该颗粒在培养液中不溶解,用二甲基亚砜(DMSO)溶解颗粒,然后用酶标仪测定吸光值,其吸光值与细胞活力成正比[20]。
L929以2×104每孔的密度种于96孔板中,分为4组,每组5个孔,实验分组情况:对照组(CK)、αGG及海藻糖质量浓度分别为20、10和5 mg/mL。培养24 h后,每孔加入50 μL MTT溶液,在37 ℃、5% CO2的生化培养箱孵育4 h,将MTT还原为甲月臜。取出后,吸取上清液,每孔加入200 μL DMSO溶解甲月臜,振荡10 min。在490 nm处检测吸光值,细胞存活率以RT/C表示,具体计算见式(4)。
(4)
式中:T为处理过的细胞吸光值,C为正常对照细胞的吸光值。
1.4 紫外保护模型和修复模型的建立
紫外保护模型的建立:将L929细胞接种到96孔培养板中,分成8组(标记为A1、A2、B1、B2、B3、C1、C2和C3),每组5个平行。其中,A组不加样品,B组加不同浓度αGG样品,C组加不同质量浓度海藻糖样品(20、10和5 g/L),在细胞培养箱中培养24 h,弃上清液,经PBS溶液清洗后,加入等体积PBS溶液,细胞培养板在距离紫外灯10 cm处辐照30 min(辐照剂量5 J/cm2),其中A1组用锡箔纸覆盖以阻隔紫外辐射。紫外辐照结束后,弃去PBS,加入37 ℃预热过的DMEM完全培养基培养24 h。取出孔板观察细胞形态。弃上清液,通过MTT法测定各孔的吸光度。然后使用吖啶橙/溴化乙锭双荧光染色法(AO/EB)对细胞进行染色,并在荧光显微镜下进行观察[21]。
紫外修复模型的建立:将L929细胞接种到96孔培养板中,分成8组(标记为A1、A2、B1、B2、B3、C1、C2、C3),每组均加入DMEM完全培养基,5个平行,在细胞培养箱中培养24 h。弃上清液,经PBS溶液清洗后,加入等体积PBS溶液,进行紫外辐照(A1组用锡箔纸覆盖),细胞培养板在距离紫外灯10 cm处辐照30 min(辐照剂量5 J/cm2)。辐照结束后弃去PBS,清洗后在每孔中加入培养基,其中,A组不加样品,B组加不同浓度αGG样品,C组加不同质量浓度海藻糖样品(20、10、5 g/L),再培养24 h。取出孔板观察细胞形态。弃上清液,通过MTT法测定各孔的吸光度。然后使用吖啶橙/溴化乙锭双荧光染色法(AO/EB)对细胞进行染色,并在荧光显微镜下进行观察。
2 结果与讨论
2.1 抗氧化活性测定
2.1.1 清除DPPH·的能力结果
抗氧化剂通过转移传递电子或氢原子给DPPH·来中和其自由基,对DPPH·的清除效果可以反映抗氧化剂的供氢能力。本实验中,DPPH·用来考察αGG样品清除质子的能力,结果如图1所示。由图1可知:αGG、海藻糖对DPPH·均具有一定的清除能力,在试验质量浓度内,DPPH·清除率呈现一定的剂量依赖性。αGG质量浓度越高,DPPH·清除率越强;相同质量浓度时,αGG、海藻糖对于DPPH·的清除率由大到小为αGG、海藻糖;当其质量浓度均为20 mg/mL时,αGG以及海藻糖对于DPPH·清除率分别为29.8%和9.2%。因此,αGG对DPPH·的清除能力远优于海藻糖。
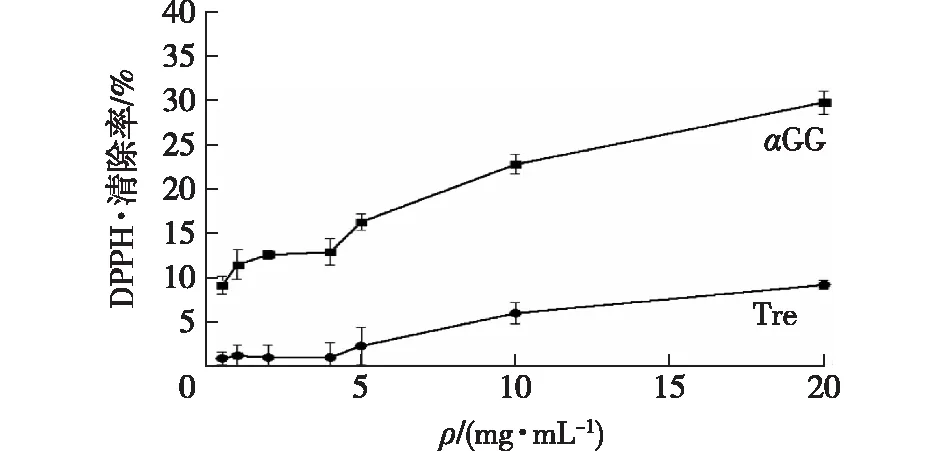
图1 αGG和海藻糖清除DPPH·的能力Fig.1 DPPH· scavenging properties of αGG and trehalose
2.1.2 清除·OH的能力
羟基自由基被认为是最有害的自由基,是造成氧化伤害的主要原因。本实验中,利用水杨酸捕捉H2O2与Fe2+混合产生·OH的方法,检测αGG对·OH的清除作用,以抗坏血酸作为清除·OH的标准品对照,结果如图2所示。由图2可知:αGG、海藻糖对·OH均具有一定的清除能力,在试验质量浓度内,·OH清除率呈现一定的剂量依赖性,αGG质量浓度越高,·OH清除率越强。当其质量浓度均为20 mg/mL时,αGG以及海藻糖对于·OH清除率分别为80.0%和87.2%。因此,αGG对·OH的清除能力稍弱于海藻糖。
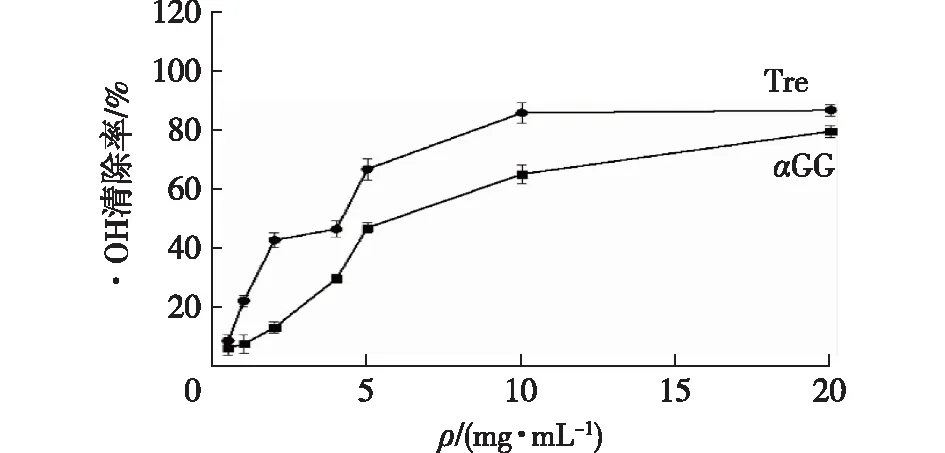
图2 αGG和海藻糖清除·OH的能力Fig.2 ·OH scavenging properties of αGG and trehalose
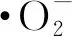
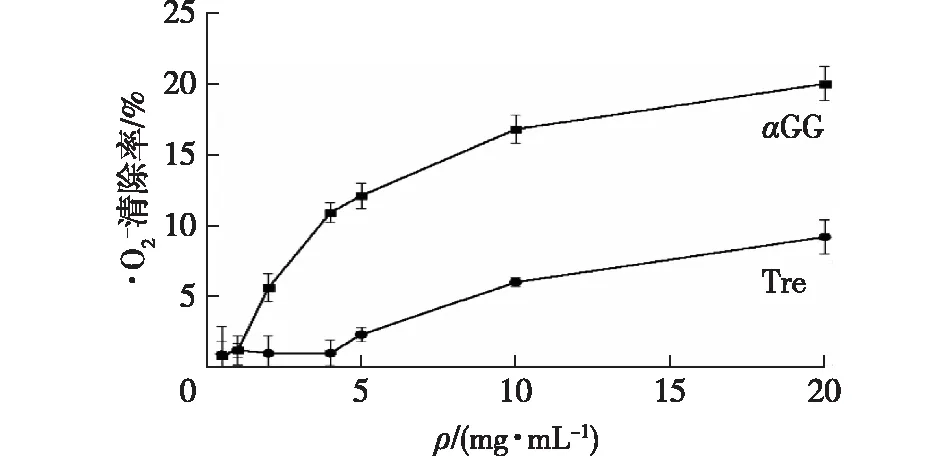
图3 αGG和海藻糖清除的能力 scavenging properties of αGG and trehalose
2.2 αGG对L929细胞活力的影响
**表示P<0.01 vs CK图4 αGG和海藻糖对L929细胞存活率的影响Fig.4 Effects of αGG and trehalose on L929 cell viability
在L929细胞培养过程中加入不同质量浓度的αGG或海藻糖溶液,考察培养24 h后αGG和海藻糖对细胞生长的影响,结果如图4所示。由图4可知:当培养基中加入海藻糖时,随着海藻糖浓度的增加,吸光度未发生显著性下降,说明在0~10 g/L范围内,海藻糖对细胞无抑制作用,当质量浓度达到20 g/L时,细胞存活率略有下降,但L929细胞增殖也未受到抑制。同样,培养基中加入αGG对细胞正常生长没有影响,且细胞数量随αGG质量浓度的增加而增多。当αGG达到10 g/L时,细胞存活率已经较对照组增加到128.7%,当αGG增加到20 g/L时,细胞存活率从对照组的100%增加到129%。结果表明,一定浓度的海藻糖和αGG对L929细胞的生长都无抑制作用,且大于10 g/L的αGG极大地促进L929细胞的生长;而浓度逐步提高时,海藻糖对L929细胞增殖未有抑制作用,且促生作用有限。
2.3 αGG对受紫外损伤细胞的保护及修复能力
紫外照射会严重损伤真皮层中的成纤维细胞,皮肤成纤维细胞的增殖能力对皮肤的正常修复起着决定性作用。笔者分别测定了不同质量浓度的αGG和海藻糖对紫外照射后L929细胞的保护与修复作用,其中保护作用是指先加保护剂再进行辐照,修复作用是指先进行辐照再添加保护剂,并分别对细胞存活率以及细胞形态进行研究。
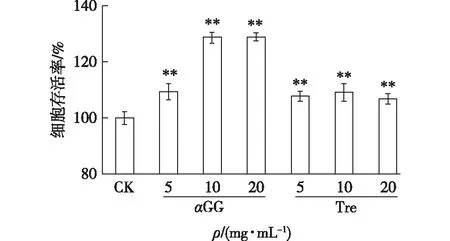
图5 αGG和海藻糖对受紫外损伤细胞的保护作用Fig.5 Protection effects of αGG and trehalose on UV damaged cells
利用建立的L929细胞紫外辐射模型,考察αGG对紫外辐射损伤细胞的保护作用,结果如图5所示。由图5(a)可知:当αGG达到20 g/L时,经过辐照的L929细胞存活率达到90.5%;而培养基未添加αGG的L929细胞存活率仅为56.7%,添加海藻糖的L929细胞存活率也仅为52.5%。因此,αGG具有保护紫外辐照后L929细胞活性的作用。由图5(b)可以看出:未经紫外辐照的L929细胞,经染色后呈现绿色荧光,当L929细胞经紫外辐照30 min后,经染色后出现红色荧光;然而,当在L929细胞中添加5~20 g/L的αGG,再经30 min的紫外辐照后,相比未添加αGG仅辐照组,其红色荧光明显减少,海藻糖组红色荧光没有显著变化,这与MTT分析结果相符合。说明αGG具有保护紫外辐射后的细胞活性作用。
利用建立的L929细胞紫外修复模型,考察αGG的紫外修复作用,结果如图6所示。由图6(a)可知:当αGG达到20 g/L时,经过辐照的L929细胞存活率达到87.6%,而培养基未添加αGG的L929细胞存活率仅为56.7%,添加海藻糖的L929细胞存活率也仅为48.6%。因此,αGG具有修复紫外辐照后L929的细胞活性的作用。由图6(b)可知:当在L929细胞经过紫外辐照之后添加含有5~20 g/L的αGG培养基,相比未添加αGG仅辐照组,其红色荧光明显减少,海藻糖组红色荧光没有显著变化,说明αGG具有修复紫外辐射后的细胞活性作用。

图6 αGG和海藻糖对受紫外损伤细胞的修复作用Fig.6 Repair effects of αGG and trehalose on UV damaged cells
3 结论
本文中,笔者通过酶法制得的αGG开展了抗氧化性能以及抗紫外损伤细胞修复、保护作用工作,得到了如下结论:
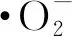
②αGG对L929细胞生长存在一定程度的增殖作用。当其质量浓度达到20 mg/mL时,细胞存活率相对提高29.0%。
③αGG对L929细胞抗紫外损伤具有一定程度的修复及保护作用。对于预添加αGG的细胞,存活率较未添加的细胞,从56.7%提高至90.5%,提高了59.6%,说明αGG对于L929细胞抗紫外损伤存在保护作用。对于后添加αGG的细胞,存活率较未添加的细胞,从56.7%提高至87.6%,提高了54.5%,说明αGG对L929细胞抗紫外损伤存在修复作用。
目前,αGG作为天然的保湿剂,在食品、药品以及化妆品中尚未得到有效开发,本文的研究工作有望为αGG在保湿、抗衰老化妆品以及药品添加剂等方面提供相关依据。

