奶粉中沙门氏菌盲样考核结果与分析
惠利娜,冯 晖,徐 星,王瑞国,许育民
(河南省食品工业科学研究所有限公司,国家轻工业食品质量监督检测郑州站,河南郑州 450000)
沙门氏菌在自然界中的分布十分广泛,沙门氏菌可以在水中生存2~3 周,在粪便中存活1~2 个月,是一种常见食源性致病菌[1]。沙门氏菌是无荚膜、无芽孢的革兰氏阴性肠道杆菌,大多有鞭毛[2]。沙门氏菌是人畜共患的病原微生物[3],人畜主要是通过食用了被沙门氏菌污染的食物导致中毒,症状主要是恶心、呕吐、腹痛、腹泻等,是许多国家食物中毒事件的元凶。
微生物实验室质量控制包括室间质量控制和内部质量控制。盲样考核是室间质量控制的一种形 式[4],同时也是保证国家食品安全风险监测和评估工作质量的一种手段[5]。评价机构通过制定的规则和标准评价参加者的能力[6],盲样考核的结果会体现检测机构的检测能力和技术水平[7]。实验室参加由中国食品药品检定研究院负责实施的乳粉中沙门氏菌检验的盲样考核活动,为了满足食品安全风险监测工作的需要,同时锻炼和提高实验室沙门氏菌的检测能力。
1 材料与方法
1.1 试验样品和标准菌株
10 份沙门氏菌样品,样品编号为CODE 1 ~CODE 10,样品为白色球状西林瓶装,包含阴性样本和阳性样本;10 份奶粉样品,每份样品25 g,编号为CODE 1 ~CODE 10。每个相同编码的沙门氏菌样品和奶粉样品为1 份样品进行检测,共10 份盲样考核样品。标准菌株为鼠伤寒沙门氏菌(ATCC 14028,广东环凯微生物科技有限公司提供) 作为阳性对照,大肠埃希氏菌(ATCC 25922,广东环凯微生物科技有限公司提供) 作为阴性对照。
1.2 试剂与仪器
1.2.1 培养基和试剂
缓冲蛋白胨水(BPW)、四硫磺酸钠煌绿(TTB)增菌液、亚硒酸盐胱氨酸(SC) 增菌液、亚硫酸铋(BS) 琼脂、木糖赖氨酸脱氧胆盐(XLD)、琼脂、沙门氏菌属显色培养基、三糖铁(TSI) 琼脂、营养琼脂(NA)、沙门氏菌生化鉴定盒、SWARM 琼脂,北京陆桥生物技术有限公司提供;沙门氏菌诊断血清(60 种),兰州生物科技公司提供;沙门氏菌诊断血清(60 种),宁波天润生物药业有限公司提供;沙门氏菌诱导血清(丹麦SSI)。所用试剂和培养基均已按照GB 4789.28 中的规定进行验收。
1.2.2 仪器和材料
无菌均质袋,北京陆桥生物技术有限公司产品;500 型恒温培养箱(36±1 ℃)、500 型生化培养箱(42±1 ℃),山东潍坊精鹰医疗器械有限公司产品;立式压力蒸汽灭菌器,上海博讯实业有限公司产品;HR40-II A2 型生物安全柜,青岛海尔特种设备电器有限公司产品;BEPU-40B 型拍击式均质器,无锡德谱仪器制造有限公司产品;漩涡混合仪,天根生化科技(北京) 有限公司产品;SL-203 型电子天平,上海民桥精密科学仪器有限公司产品;BCD-220 型冷冻冷藏箱,TCL 集团股份有限公司产品。
1.3 试验方法
1.3.1 样品的处理
在生物安全柜内将沙门氏菌样品瓶打开,将2 mL无菌增菌液加入到样品瓶中,使样品小球充分溶解,加入到无菌均质袋中。再将无菌增菌液加入到样品瓶中反复吹打,重复数次,尽量使西林瓶内的所有微生物都洗脱下来。然后,将与西林瓶相同编码的奶粉样品加入到BPW增菌液中,均质混匀。以该方法分别对10 份样品进行处理。另外,取2 瓶225 mL 灭菌BPW稀释液分别加入到2 个无菌均质袋中,依次接种1 mL浓度为103CFU/mL 标准菌株ATCC 14028 作为阳性对照,1 mL 浓度为103CFU/mL 标准菌株ATCC 25922作为阴性对照,灭菌的225 mL BPW 作为空白对照。
1.3.2 前增菌
将编码CODE 1~CODE 10 的样品均质液、阳性对照、阴性对照和空白对照一起置于36±1 ℃的恒温培养箱中静置培养18 h。
1.3.3 选择性增菌
培养后的样品混合物轻摇混合均匀,用移液器移取1 mL 接种于10 mL TTB 中,同时另取1 mL 接种于10 mL SC 中,将TTB 置于42±1 ℃恒温培养箱中培养18~24 h,将SC 置于36±1 ℃恒温培养箱中培养18~24 h。阳性对照、阴性对照和空白对照按照上述步骤进行操作。
1.3.4 分离划线
培养后的TTB 和SC 增菌液先用涡旋混匀器混合均匀,分别接种于3 种选择性培养基(BS、XLD、沙门显色培养基) 上,划线后的平板置于适宜温度相应的培养箱中培养需要的时间。阳性对照、阴性对照和空白对照也进行同样的操作。培养结束后观察并记录不同培养基上的菌落形态。
1.3.5 纯化
在每个分离培养基上分别挑取2 个或以上不同形态的菌落,包括典型菌落、疑似菌落和非疑似菌落,在NA 平板进行纯化,置于36±1 ℃下恒温培养箱中培养18~24 h。
1.3.6 生化鉴定
挑取NA 平板上的单菌落接种TSI,再选取NA平板上的单菌落制备菌悬液(0.5 麦氏比浊浓度),用移液器吸取菌悬液加入到赖氨酸脱酸酶、尿素酶、靛基质、KCN 这4 种微量生化管内,对沙门氏菌进行初筛。接种后用封口膜封口。赖氨酸脱酸酶和KCN 接种后还需要用无菌液体石蜡液封。将三糖铁和上述4 种生化反应管置于36±1 ℃恒温培养箱中培养18~24 h 后观察记录结果。氰化钾试验若培养24 h 时仍为阴性,可延长培养至48 h。根据结果判断是否为沙门氏菌,根据生化反应类型,再进行甘露醇、山梨醇、靛基质、卫矛醇、水杨苷、ONPG、丙二酸盐的接种培养。
1.3.7 血清学分型
参照GB 4789.4—2016[8]的方法血清凝集试验的要求进行自凝性检查、多价O 抗原凝集试验和多价H 抗凝集试验。
被A~F 多价O 血清凝集者,依次用O 抗原因子进行血清凝集试验,判定O 群。O 群确定之后,根据GB 4789.4—2016[8]和《Antigenic Formulae of the Salmonella serovars》 中的沙门氏菌抗原表,验证H抗原。确定H 抗原的第一相之后,再验证H 抗原的第二相。如果第二相不凝集,可以用位相变异用简易平板法进行诱导后,再次验证。
2 结果与分析
2.1 选择性培养基培养
样品CODE 1~CODE10、阳性对照、阴性对照和空白对照经过前增菌、选择性增菌和划线分离培养后,结果CODE 2,CODE 5,CODE 6 和阳性对照在3 种选择性培养基上菌落形态基本一致,均出现可疑或典型菌落;而CODE 1,CODE 3,CODE 4 在3 种选择性培养基上出现的菌落形态一致,均未发现疑似或典型菌落,可以初步判定为非沙门氏菌;CODE 7,CODE 8,CODE 10 在3 种选择性培养基上出现的菌落形态一致,无疑似或典型菌落可以初步判定为非沙门氏菌,同时在显色培养基上都出现蓝绿色菌落,与阴性对照上的菌落形态一致,可以初步判定CODE 7,CODE 8,CODE 10 样品里添加有大肠菌群;CODE 9与空白对照结果一致,无菌落生长。
沙门氏菌在选择性培养基上的菌落特征见表1。
2.2 生化鉴定

表1 沙门氏菌在选择性培养基上的菌落特征
为了保证结果准确,取上述选择性培养基上非疑似菌落、疑似菌落、典型菌落经纯化培养后,取纯菌落先接种三糖铁琼脂、赖氨酸脱酸梅、尿素酶、靛基质、KCN,进行初筛,符合沙门氏菌反应的再选用沙门氏菌生化鉴定盒进行生化鉴定。
沙门氏菌生化试验初步鉴定结果见表2。
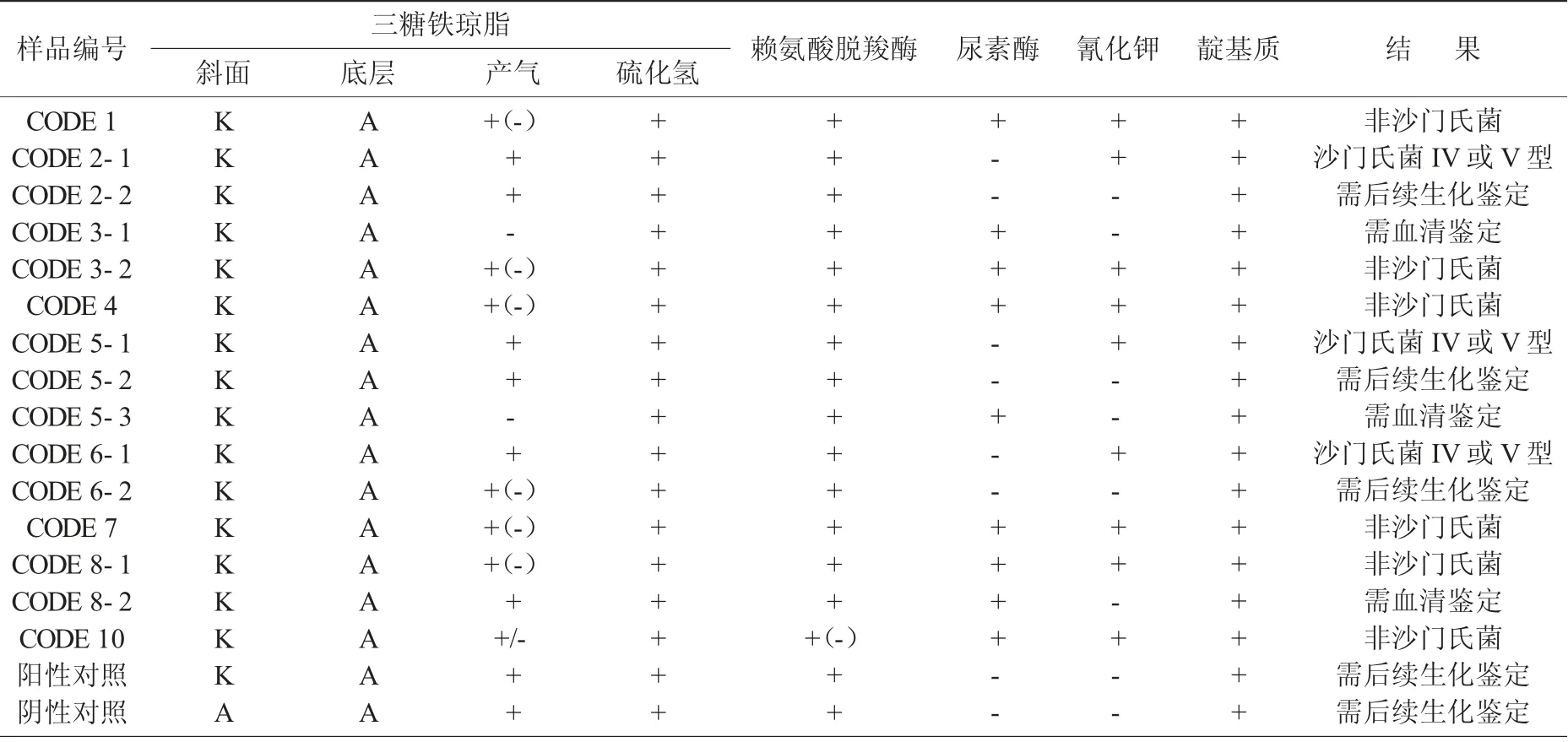
表2 沙门氏菌生化试验初步鉴定结果
由表2 可知,编号CODE 1,CODE 3,CODE 4的样品的生化反应初步鉴定结果不符合反应序号A1,A2,A3,即不符合典型沙门氏菌生化反应特征,可报告25 g 样品中未检出沙门氏菌,与选择性培养基鉴定结果基本一致,故无需进行后续生化鉴定和血清凝集试验。样品CODE 2,CODE 5,CODE 6,阳性对照和阴性对照符合反应序号A2,需补做甘露醇和山梨醇试验,试验结果符合后还需要继续进行血清凝集试验。样品CODE 3,CODE 8 大多数非疑似菌落初步生化反应不符合反应序号A1,A2,A3,但是个别非疑似菌株生化反应初步判断符合沙门氏菌个别变体,需要结合血清鉴定结果判断。
沙门氏菌属生化群的鉴定结果见表3。
2.3 血清学分型

表3 沙门氏菌后续生化鉴定结果
样品CODE 3,CODE 8 和阴性对照经A~F 多价O 血清试验均不凝集,可以判定为非沙门氏菌。参照GB 4789.4—2016 附录B[8]和盲样考核作业指导书中提供的沙门氏菌抗原表[9],发现样品CODE 2,CODE 5,CODE 6 中分离出的菌株均能与O 多价血清凝集,同时生理盐水对照并未发生凝集现象;样品CODE 2 分离出S. Colindale,样品CODE 5 分离出S. Agona,样品CODE 6 分离出S. Liverpool 和Salmonella II。阳性对照经血清学分型是S. Typhimurium与鼠伤寒沙门氏菌(ATCC 14028) 结果一致。
血清学分型结果见表4。
2.4 判定

表4 血清学分型结果
对上述鉴定结果综合分析,可判定10 份中样品有3 份样品中含有沙门氏菌,并且分离出4 种沙门氏菌,检测结果和血清分型结果与中国食品药品检定研究院反馈的报告相符。
3 结论
盲样考核是国家及各省级监督部门评价检测机构的检验能力的重要手段之一[10]。开展盲样考核可以锻炼和提高检测人员的操作技能,提高检验检测机构的技术水平。
盲样考核的关键在于必须控制好检测过程的每个环节。总结如下:
(1) 操作时要认真核对样品编号,避免混淆样品导致结果出错。
(2) 必须保证无菌操作,避免来自人员和环境的污染。试验产生的废弃物和生物安全事项必须严格《GB 19489—2008 实验室生物安全通用要求》执行[11],避免人员感染。
(3) 对所有试剂进行验收,验收合格以后才能使用[12]。
(4) 在生物安全柜内打开样品瓶,首先将样品小球溶解,溶解后反复吹打、多次润洗,尽量使西林瓶内的所有微生物都洗脱下来。
(5) 盲样考核过程中需要用阳性对照、阴性对照、空白对照对培养基、试剂和操作进行监控。
(6) 沙门氏菌划线分离时用的选择性培养基要全面,培养后的菌落形态判断需要一定的经验积累。菌落形态的判定是后续试验操作的关键。这次盲样考核的干扰菌可能有变形杆菌、弗氏柠檬酸杆菌和大肠菌群等,这些菌在XLD、BS 等平板上的菌落形态都类似于沙门氏菌,而沙门氏菌显色培养基可以将其有效分离。沙门氏菌显色培养基的特异性和敏感性较高,可有效排除这些菌的干扰[13]。沙门氏菌显色培养基的原理是利用沙门氏菌代谢出的辛酯酶与培养基中的特异性显色底物结合,游离出产色基因使培养基显示特定颜色[14]。但显色培养基也有缺点,由于某些杂菌也具有同样的酶,从而出现个别的假阳性现象。
(7) 为避免出现漏检的情况,选择生化试验的菌落形态要全面,尽可能多地挑取可疑菌。此次试验过程中每种平板上选择典型菌落2~3 个,疑似菌落2~3 个,非疑似菌落2 个进行生化试验,总计共进行了80 组生化鉴定,保证鉴定结果的全面性。进行生化试验时,一定要注意在要求的培养时间内观察记录结果,否则会造成生化结果的偏差。
(8) 有些非疑似菌落在生化试验过程中也会呈现和沙门氏菌相同的反应,所以血清学鉴定在沙门氏菌的分离鉴定过程中显得尤为关键。沙门氏菌血清学分型操作复杂且工作量大,试验过程需要认真细心,结果判断需要经验积累。O 抗原的鉴定相对好操作,凝集效果明显。但是,H 抗原的鉴别难度相对较大,对菌株的要求校高。在利用血清诱导鉴别H 抗原时,要避免挑取接种的中心部位,容易造成血清凝集不明显,影响结果的判读[15]。血清的质量对于血清分型结果至关重要[16],此次试验采用了2 种沙门氏菌诊断血清进行试验,相互验证,保证结果的准确性。

