单纯机械治疗对慢性牙周炎患者龈下菌群微生态的影响
王延峰, 曾佳骏, 袁乔, 栾庆先
1. 北京大学口腔医学院·口腔医院牙周科,口腔数字化医疗技术和材料国家工程实验室,口腔数字医学北京市重点实验室,北京(100081); 2. 北京大学口腔医学院·口腔医院第二门诊部,口腔数字化医疗技术和材料国家工程实验室,口腔数字医学北京市重点实验室,北京(100101)
牙周炎是以牙菌斑中的致病微生物为始动因素,宿主免疫反应等多因素共同作用导致的感染性疾病[1]。龈下菌群微生态的失调,以及牙周致病相关微生物的出现,在牙周炎的发生和发展过程中起到了关键性作用[2]。牙周治疗的主要方法围绕减少或消除相关致病因素为目的,机械治疗包括龈上洁治、龈下刮治及根面平整,作为牙周序列治疗的第一步,已被证明可以有效清除菌斑和牙石,缓解局部炎症,促进牙周组织健康[3]。牙周炎的治疗效果需要维持长期的稳定,作为基础治疗手段,仅机械治疗是否可以改善龈下菌群微生态的失调状态并维持其长期稳定值得关注。DNA 分子杂交技术[4]可以实现对特异DNA 序列的定量检测,但是只能检测已知序列的微生物,无法提供菌群的全面信息。基于细菌16S rRNA 的高通量测序技术将未知菌的序列与基因库进行相似性比对,在进行半定量分析的同时,极大程度提高了对龈下菌群微生态的检测深度和全面性[5]。既往研究中,高通量测序技术多用于比较牙周炎患者与健康人群龈下菌群微生态的差异来寻找牙周致病相关微生物,除了牙龈卟啉单胞菌(Porphyromonas gingivalis)、齿垢密螺旋体(Treponema denticola)和福赛坦氏菌(Tannerella forsythia)等经典牙周致病菌红色复合体外,发现龈沟产线菌(Filifactor alo⁃cis)、牙髓卟啉单胞菌(Porphyromonas endodontalis)等多个菌种为牙周致病相关微生物,而副流感嗜血杆菌(Haemophiluspara influenzae)、内氏放线菌(Actinomyces naeslundii)等菌种为牙周健康相关微生物。目前采用高通量测序技术比较牙周治疗前后龈下菌群微生态差异的研究,多集中于侵袭性牙周炎且观察时间不超过3 个月[6⁃8]。本研究采用16S rRNA 高通量测序技术,对慢性牙周炎单纯机械治疗前及之后6 个月内龈下菌群微生态以及临床指标的变化进行探讨,为牙周炎的病因学研究以及机械治疗的长期疗效提供依据。
1 资料和方法
本研究的研究方案通过北京大学口腔医院生物伦理委员会审核(伦理审批号:PKUSSIRB⁃201839128),符合赫尔辛基宣言伦理原则,并已在中国临床试验注册中心注册(注册号:ChiC⁃TR2000029831)。所有受试者纳入研究前均已签署知情同意书。
1.1 研究对象
本研究中,在北京大学口腔医院牙周科就诊的患者中筛选根据1999 年关于牙周病分类的国际研讨会[9]诊断为广泛型中重度慢性牙周炎的患者。本研究共纳入12 名受试者(6 名男性,6 名女性),平均年龄(40.75 ± 9.1)岁,全部完成复查并进入最终分析。纳入标准:①全口牙中有附着丧失和骨吸收的位点占总位点数> 30%,为广泛型慢性牙周炎;②临床附着丧失≥3 mm 为中重度。排除标准:①吸烟者;②女性处于怀孕或哺乳期;③有全身系统性疾病,如高血压病、糖尿病、心血管疾病等;④近半年口服或局部使用抗生素;⑤近半年接受过任何牙周治疗;⑥除去第三磨牙后,全口可保留牙少于20 颗。随机纳入受试者除去第三磨牙和无望保留患牙的上颌单侧区段,基线探诊深度(probing depth,PD)≥4 mm 的患牙及位点。
1.2 临床指标
PD 每颗牙均记录6 个位点(颊侧远中、中央、近中及舌侧近中、中央、远中),使用尖端直径为0.5 mm 的Williams 牙周探针,采用标准力量以适宜的角度插入袋内,遇到阻力之后停止,龈缘所在刻度为PD,取最接近的毫米刻度。出血指数(bleed⁃ing index,BI,Mazza,1981)和菌斑指数(plaque in⁃dex,PLI,Silness & Loöe,1964)每颗牙记录两个位点(颊侧、舌侧),记录指数分别为0~5 和0~3。
1.3 临床操作流程
受试者纳入研究后,接受口腔卫生宣教,并同时进行龈上洁治。龈上洁治后1 周复诊,由检查者记录基线临床指标并采集龈下菌斑,受试者随后转至治疗者对PD ≥4 mm 的位点在局麻下进行龈下刮治及根面平整,首先超声龈下刮治去除大块牙石,再进行手工龈下刮治及根面平整,至根面光滑坚硬,最后进行每颗牙约1 min 的超声龈下刮治,治疗时间约为30 min。治疗后3 个月和6 个月,检查者对受试者进行复查,记录临床指标并采集龈下菌斑。若在3 个月复查时仍有PD ≥4 mm 位点,转至治疗者继续进行每颗牙1 min 的超声龈下刮治。
1.4 龈下菌斑采集及16S rRNA V3⁃4 区测序
根据基线临床指标,在受试者研究区段前磨牙或第一磨牙区选择PD ≥4 mm 的最深位点,避开存在根分叉病变位点,采用纸尖法进行龈下菌斑取样。在去除龈上菌斑、软垢并进行隔湿后,将30号吸潮纸尖轻柔地插入牙周袋内,遇到阻力时停止,30 s 后取出放入Eppendorf 管,放置于-80 ℃冰箱内保存。所有样本送至北京奥维森基因科技有限公司进行微生物16S rRNA V3⁃4 区测序分析。采用PowerSoil 微生物基因组提取试剂盒(MoBio Laboratories 公司,美国),按照说明书对样本中的细菌DNA 进行分离提取,随后利用Illumina MiSeq 平台进行16S rRNA V3⁃4 区测序,引物序列(338F:5′⁃GTACTCCTACGGGAGGCAGCA⁃3′;806R:5′⁃GTG⁃GACTACHVGGGTWTCTAAT⁃3′)。测序后对有效序列进行过滤并去除嵌合体,得到可以用于后续分析的优质序列。利用Qiime 软件对优质序列按照相似度97%为阈值进行聚类,获得可操作性分类单元(operational taxonomic units,OTUs),并与人类口腔微生物数据库(human oral microbiome data⁃base,HOMD)进行比对,对每个OTU 进行注释,获得分类学信息。
1.5 统计学分析
采用Statistical Product and Service Solutions 23.0 软件(IBM 公司,美国)进行数据分析。临床指标采用均值± 标准差的形式表示。对于所有纳入位点,不同时间点两两比较采用的是配对样本的t检验;对于取样位点,不同时间点两两比较采用的是Wilcoxon 符号秩检验;P < 0.05 为差异具有统计学意义。
微生物Alpha 多样性指数采用Mothur 计算,Turkey 检验比较不同时间点间指数差异;Beta 多样性分析采用Qiime 软件进行基于Unifrac 的主成分分析(principal coordinates analysis,PCoA),不同时间点微生物菌群差异的比较采用ANOSIM 相似性分析;微生物门水平、属水平和种水平相对丰度的比较采用Wilcoxon 符号秩检验;在组间具有差异的微生物基础上,通过线性判别分析效应(linear dis⁃criminant analysis effect size,LEfSe)寻找各组样本间差异最明显的生物标志物,阈值设定3;P < 0.05为差异具有统计学意义。数据分析采用R 语言(Stats 包)处理。
2 结 果
2.1 临床指标
相较于基线,治疗后3 个月和6 个月临床指标PD、BI、PLI 均明显降低,差异具有统计学意义(P<0.05)(表1)。

表1 慢性牙周炎患者治疗前后临床指标的变化Table 1 Changes in the clinical parameters of patients with chronic periodontitis before and after treatment
相较于治疗后3 个月,治疗后6 个月所有研究位点的PD 稍有增加,组间差异具有统计学意义(P < 0.05);取样位点趋势相同,但组间差异无统计学意义。
2.2 微生物Alpha 多样性及Beta 多样性分析
对采集样本进行筛选,共有30 个样本符合测序要求,基线水平及治疗后3 个月各有12 个样本,治疗后6 个月有6 个样本。所有满足测序要求的样本共产生1 682 483 条优质序列,经过聚类后抽平共获得700 个OTUs,平均每个样本获得258.1 个OTUs。
对各时间点样本微生物Alpha 多样性进行分析,Chao 1 指数反映群落的丰富度,用以估计群落中的OTU 数目;Observed species 指数反映群落的丰富度,为物种的数量;Shannon 指数反映群落的多样性,基线水平、治疗后3 和6 个月的各组样本之间差异均无统计学意义(P>0.05)(表2)。

表2 治疗前后龈下菌斑样本的微生物多样性指数Table 2 Microbial richness and diversity of subgingival samples before and after mechanical debridement
Beta 多样性的主成分分析,每个点代表单个样本,图中点与点之间的bray⁃curtis 距离反映样本微生物群落组成的相似性,距离越近说明差异越小。基线与治疗后3 个月的样本多位于不同象限(图1),治疗后3 个月与基线的样本微生物群落结构差异具有统计学意义(P=0.014);治疗后6 个月的样本散落在上述两组样本之间(图1),与基线、治疗后3个月的微生物群落结构差异均无统计学意义。

Figure 1 Principal coordinates analysis of subgingival samples before and after treatment图1 机械治疗前后龈下菌斑样本的主成分分析
2.3 微生物群落特征分析
2.3.1 门水平的差异分析 基线时,样本中的优势菌门(相对丰度>1%)依次为拟杆菌门(Bacteroide⁃tes)、变 形 菌 门(Proteobacteria)、厚 壁 菌 门(Fir⁃micutes)、梭杆菌门(Fusobacteria)、螺旋体门(Spiro⁃chaetes)和放线菌门(Actinobacteria);治疗后3 个月,样本中的优势菌门依次为变形菌门、拟杆菌门、厚壁菌门、梭杆菌门、放线菌门、螺旋体门和Saccharibacteria TM7;治疗后6 个月,样本中的优势菌门依次为变形菌门、梭杆菌门、拟杆菌门、厚壁菌门、放线菌门和螺旋体门,具体如图2 所示。

Figure 2 Mean relative abun⁃dance of dominant phyla before and after treatment图2 治疗前后微生物群落优势菌门相对丰度图
治疗后3 个月,样本中的螺旋体门(11.57% vs.2.19%)和 互 养 菌 门(Synergistetes)(0.33% vs.0.27%)的相对丰度显著降低(P < 0.05),而Ab⁃sconditabacteria SR1 的相对丰度显著升高(0.02%vs.0.08%,P< 0.05)。治疗后6 个月,样本中上述优势菌门的相对丰度与基线水平和治疗后3 个月的差异均无统计学意义。
2.3.2 属水平的差异分析 在各时间点样本中平均相对丰度排名前25 的菌属如图3a 所示。
基线时,按照相对丰度排序前5 依次为卟啉单胞菌属(Porphyromonas)15.96%、梭杆菌属(Fuso⁃bacterium)14.81% 、密 螺 旋 体 属(Treponema)11.57%、链球菌属(Streptococcus)7.2%和奈瑟氏菌属(Neisseria)6.74%。
治疗后3 个月,按照相对丰度排序前5 依次为梭杆菌属11.11%、嗜血杆菌属(Haemophilus)10.81%、奈瑟氏菌属10.0%、链球菌属8.62%和卟啉单胞菌属6.06%。
治疗后6 个月,排序前5 依次为梭杆菌属18.75%、奈瑟氏菌属15.94%、链球菌属6.66%、放线菌属(Actinomyces)6.50%和卟啉单胞菌属5.79%。在各时间点平均相对丰度排名前25 的菌属中,卟啉单胞菌属、密螺旋体属、坦纳氏菌属(Tannerella)在治疗后3 个月时样本中的相对丰度显著降低,产线菌属(Filifactor)在治疗后3 个月和6 个月时均显著降低(P < 0.05);二氧化碳噬纤维菌属(Capnocy⁃tophaga)和金氏菌属(Kingella)在治疗后3 个月和6个月时相对丰度均显著升高,而奥托氏菌属(Ot⁃towia)在治疗后3 个月时较基线水平相对丰度显著升高,而在治疗后6 个月时较基线显著降低(P <0.05)。
治疗前后样本中相对丰度发生显著性变化(P<0.05)的菌属如图3b 所示。
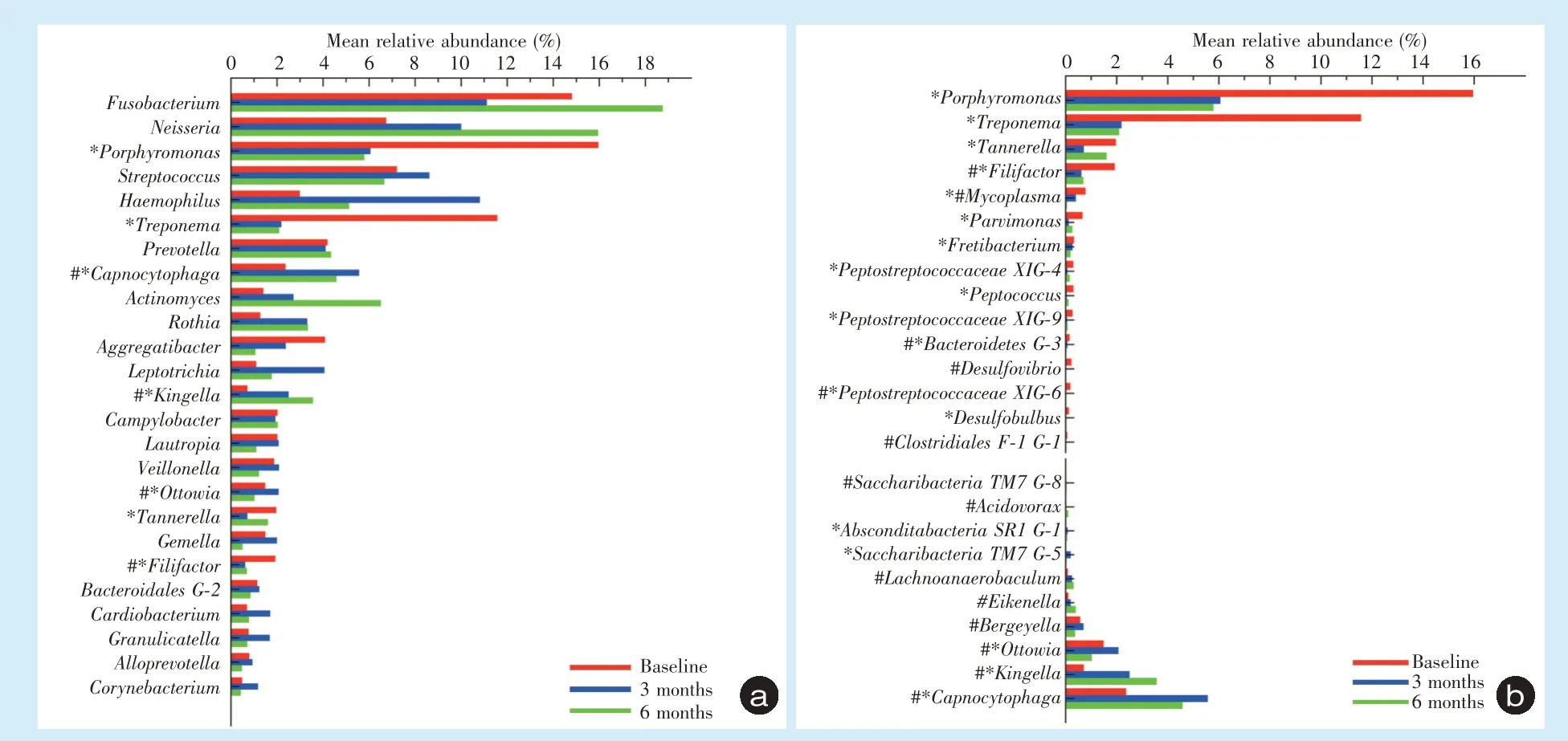
Figure 3 Mean relative abundance at the genus level before and after treatment图3 治疗前后微生物群落菌属水平相对丰度图
治疗后3 个月共有13 个菌属的相对丰度显著降低,4 个菌属的相对丰度显著升高;治疗后6 个月共有7 个菌属的相对丰度显著降低,其中伯杰氏菌属(Bergeyella)在治疗后3 个月时稍有升高,有7个菌属的相对丰度显著升高。治疗后6 个月与治疗后3 个月相比,样本中未发现上述菌属的相对丰度发生显著性变化。
2.3.3 种水平的差异分析 各时间点样本中平均相对丰度排名前25 的菌种如图4a 所示。基线时,按照相对丰度排序前5 依次为具核梭杆菌(Fuso⁃bacterium nucleatum)14.81%、牙龈卟啉单胞菌8.26%、牙髓卟啉单胞菌4.23%、嗜沫聚集杆菌(Ag⁃gregatibactera phrophilus)3.87%和Streptococcus 071 3.71%。
治疗后3 个月,按照相对丰度排序前5 依次为具核梭杆菌11.11%、副流感嗜血杆菌8.81%、Strep⁃tococcus 071 7.66%、黏液奈瑟菌(Neisseria mucosa)3.47%、天空罗氏菌(Rothiaaeria)3.19%。
治疗后6 个月,排序前5 依次为具核梭杆菌18.75%、内氏放线菌6.22%、黏液奈瑟菌6.15%、Streptococcus 071 5.18%和浅黄奈瑟菌(Neisseria sub⁃flava)4.78%。
在平均相对丰度排名前25 的菌种中,牙龈卟啉单胞菌、牙髓卟啉单胞菌、齿垢密螺旋体、龈沟产线菌在治疗后3 个月和6 个月时样本中的相对丰度均显著降低,福赛坦氏菌和中间链球菌(Strep⁃tococcus intermedius)仅在治疗后3 个月时显著降低(P<0.05);口金氏菌(Kingella oralis)在治疗后3 个月时在样本中的相对丰度均显著升高,牙龈二氧化碳噬纤维菌(Capnocytophaga gingivalis)在治疗后6 个月时相对丰度显著升高,Ottowia 894 在治疗后3 个月时较基线水平显著升高,但在治疗后6 个月时较基线显著降低(P<0.05)。
治疗前后样本中相对丰度发生显著性变化(P<0.05)的菌种如图4b、4c 所示,治疗后3 个月共有23 个菌种的相对丰度显著降低,18 个菌种的相对丰度显著升高;治疗后6 个月共有11 个菌种的相对丰度显著降低,11 个菌种的相对丰度显著升高。治疗后6 个月时与3 个月时相比,上述菌种中Desulfovibrio fairfieldensis、Granulicatella elegans 和非典型韦荣菌(Veillonella atypica)的相对丰度显著降低,而中间链球菌相对丰度显著升高。

Figure 4 Mean relative abundance at the species level before and after treatment图4 治疗前后微生物群落菌种水平相对丰度图
2.4 生物标志物
在治疗前后各水平微生物差异分析的基础上,通过LEfSe 分析各组样本间差异最明显的微生物作为生物标志物(图5)。
治疗前,样本龈下菌群的生物标志物包括齿垢密螺旋体、Treponema 258、嗜麦芽密螺旋体(Treponema maltophilum)及其所在的属、科、目(Spi⁃rochaetales)、纲和门,牙龈卟啉单胞菌、牙髓卟啉单胞菌,Peptostreptococcaceae XIG⁃9 brachy 及其所在的属、Peptostreptococcaceae XIG⁃4 369 及其所在的属、龈沟产线菌及其所在的属、以上3 个菌属所在的Peptostreptococcaceae XI 科,微小微单胞菌(Parvimo⁃nas micra)及其所在的属及其与Peptostreptococcace⁃ae XI 科所在的梭菌目(Clostridiales)和梭菌纲(Clos⁃tridia),咽支原体(Mycoplasma faucium)及属、科、目和纲,中间链球菌,昭和弯曲菌(Campylobacter showae),脱硫弧菌目(Desulfovibrionales)及其所在的δ⁃变形菌纲(Deltaproteobacteria),Bergeyella 907。
治疗后3 个月时样本中的生物标志物包括Leptotrichia hofstadii、Leptotrichia 219,副流感嗜血杆菌,反硝化金氏菌(Kingella denitrificans)、Granulica⁃tella elegans,Capnocytophaga 336 及其所在的科、目和纲,Ottowia 894 及其所在的属,Commamonadace⁃ae 科。治疗后6 个月时样本中的生物标志物包括Neisseria 020 及其所在的科和目,金氏菌属及其与奈瑟氏菌门共同所在的β⁃变形菌纲(Betaproteo bacteria);Treponema pectinovorum 虽然为生物标志物,但在所有样本中仅1 次检出。
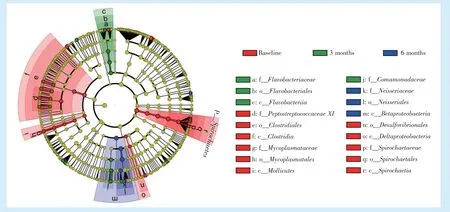
Figure 5 Microbial analysis based on LEfSe method图5 线性判别分析效应图
3 讨 论
牙周炎是以菌斑生物膜为始动因素,宿主免疫反应等多因素共同作用导致的感染性疾病,菌群失调是其发生发展的关键因素。在健康人群中,龈上及龈下菌斑的量相对较低,主要由共生菌构成,其通过宿主免疫反应可以被有效调节。当菌斑不断堆积,引起牙周组织的慢性炎症,致病微生物的数量增加,宿主免疫反应失调,并在局部因素的刺激下,形成由致病微生物主导的微生态,促进牙周组织破坏。
Socransky 等[4]的 研 究 通 过DNA 分 子 杂 交 技术,将龈下菌斑中的32 个菌种划分为5 个微生物复合体,其中红色复合体包括牙龈卟啉单胞菌、齿垢密螺旋体和福赛坦氏菌与牙周炎紧密相关,橙色复合体包括梭杆菌属、普雷沃氏菌属(Prevotel⁃la)、微小微单胞菌(Parvimonas micra)、弯曲菌属(Campylobacter)等与牙周炎紧密相关的核心群,红色复合体和橙色复合体均被认为是经典的牙周致病菌。虽然DNA 分子杂交技术可以实现对不可培养菌种的检测,但是需要提前设计相应的引物,无法获得龈下菌群微生态的全貌。随着检测技术的发展,基于细菌16S rRNA 保守性基因片段中9 个变异区的高通量测序,以未知菌的序列与基因库中的已知序列进行对比,根据相似性进行分类鉴别,可以对菌斑中的所有细菌进行检测,提供了龈下菌群的全面信息[10],本研究中微生物检测采用的便是基于16S rRNA 的Illumina MiSeq 平台第二代测序技术。
本研究中纳入广泛型中重度慢性牙周炎患者,在治疗前即基线,所有位点的PD 均值为5.28 mm,BI 均值为2.73,牙周炎症程度较重;PLI 均值为0.87,多数位点牙面存在菌斑附着,口腔卫生控制不佳。同时,微生物结果显示红色复合体和橙色复合体及其所在属、门为菌群中的主要成分,与既往研究的结果相一致[8,11],同时,其它牙周致病相关微生物如牙髓卟啉单胞菌、龈沟产线菌及其所在的产线菌属、嗜沫聚集杆菌及其所在的聚集杆菌属(Aggregatibacter)等的相对丰度均较高(位于菌属或菌种相对丰度排名前25)[12]。
治疗后3 个月,Alpha 多样性指数分析结果显示龈下菌群中微生物丰富度和多样性均无明显变化,但与治疗前相比,主成分分析图示样本分别位于不同的象限,ANOSIM 相似性分析显示组间差异具有统计学意义,提示在治疗后3 个月时菌斑生物膜已经发生了再植,但是其群落组成却发生了明显的变化,目前相关研究的观察时间多较短,但部分长达3 个月的研究中也观察到了相似的结果[6,13]。治疗后3 个月,螺旋体门相对丰度都显著降低,而其在菌群失调过程中发挥着重要作用[14]。在属水平和种水平,红色复合体所在的卟啉单胞菌属、密螺旋体属、坦纳氏菌属,橙色复合体所在的微单胞菌属(Parvimonas)及属内多个致病相关菌种的相对丰度均显著降低,如牙龈卟啉单胞菌的相对丰度从8.26%降至0.68%、齿垢密螺旋体的相对丰度从2.55%降至0.54%、福赛坦氏菌的相对丰度从1.83%降至0.48%、微小微单胞菌的相对丰度从0.66%降至0.12%,同时龈沟产线菌、Peptostreptococcaceae XIG⁃4 369 及其所在属、Myco⁃plasma faucium 及其所在属、Peptostreptococcaceae XIG⁃9 brachy、Fretibacterium 360 及其所在属等牙周致病相关微生物也显著降低[5,15⁃16],经LEfSe 分析这些致病相关微生物为基线样本菌群的生物标志物。治疗后3 个月,二氧化碳噬纤维菌属及其下菌种如Capnocytophaga 336 等、金氏菌属及其下菌种如口金氏菌、反硝化金氏菌(Kingella denitrificans)、Granulicatella elegans、Leptotrichia hofstadii 等既往研究中[17]报道的牙周健康相关微生物相对丰度显著升高。治疗后3 个月,菌群微生态中牙周炎致病相关微生物的比例下降,占主要成分的为嗜血杆菌属、奈瑟氏菌属、链球菌属等牙周健康相关微生物。值得注意的是,梭杆菌属在治疗前后相对丰度无明显变化,这可能与其在菌斑生物膜中的作用密切相关,梭杆菌属下的菌种具核梭杆菌(Fuso⁃bacterium nucleatum)作为共生菌,既可以与早期定植菌如链球菌属等,也可以与晚期定植菌如牙龈卟啉单胞菌等共聚[18⁃19],这也与既往研究结果相似[6,13]。与龈下菌群微生态的变化相一致,无论是在所有纳入位点还是取样位点,PD、BI 和PLI 等临床指标均得到了显著改善。
治疗后6 个月的临床指标,所有位点的PD 稍有回升,与3 个月时相比差异具有统计学意义,对于取样位点也观察到了一样的趋势,但是差异无统计学意义。对样本进行ANOSIM 相似性分析的结果显示,治疗后6 个月与基线的群落组成差异无统计学意义。门水平分析也未发现与基线的显著性差异,属水平分析红色复合体所在卟啉单胞菌属和密螺旋体属的相对丰度与3 个月时相近,但与基线比较无显著性差异,而坦纳氏菌属(Tannerel⁃la)的相对丰度稍升高,同样与基线无显著性差异。产线菌属、支原体(Mycoplasma)和Peptostrepto⁃coccaceae XIG⁃6 等与牙周炎相关的菌属以及与牙周健康相关的大部分菌属仍保持与基线水平的显著性差异[9]。种水平分析可以观察到6 个月时,虽然牙龈卟啉单胞菌、齿垢密螺旋体、龈沟产线菌等菌种仍较基线显著减低,但部分牙周致病微生物相关菌种与基线的显著性差异消失,福赛坦氏菌的相对丰度从0.48%上升至1.21%,微小微单胞菌的相对丰度从0.11%上升至0.26%。与治疗后3 个月相比,Granulicatella elegans 和非典型韦荣菌等牙周健康相关微生物的相对丰度显著降低,而中间链球菌显著升高,优势菌种中Streptococcus 071 的相对丰度为5.18%,这些菌种均为牙周致病相关微生物[17,20],同时生物标志物中牙周健康相关微生物减少。Haffajee 等[21]的研究中提到非手术治疗对临床指标和龈下菌群微生态改善效果最显著的时间为治疗后3 个月,之后可能会因致病微生物的再次定植引起牙周炎症的复发。需要说明的是,本研究中研究对象为广泛型中重度慢性牙周炎患者,其牙周炎症程度较重,单纯机械治疗具有局限性,尤其是对于深牙周袋内或解剖因素复杂的位点,可能无法完全清除菌斑牙石等致病因素,同时部分牙周致病菌可以进入牙周组织内,这些均可能导致治疗后的致病微生物的再植[22⁃23],在本研究中也可以看到治疗后3 个月和6 个月Saccharibacteria TM7 的相对丰度较高,SaccharibacteriaTM7 G⁃5 及其下Saccharibacteria TM7 G⁃5 356 在治疗后3 个月显著升高,而其根据既往研究与牙周炎症密切相关[15⁃16]。本研究在治疗后6 个月时仅有6 个样本产生的序列符合测序要求,虽然其检验效能可能受到影响,需要增加样本量进一步证实,但上述结论仍提示仅单纯机械治疗对于慢性牙周炎临床指标和龈下菌群微生态维持长期稳定可能存在局限性,而药物治疗及手术治疗对于龈下菌群微生态的改善是否具有更加显著的效果需要未来研究验证。

