三维可视化技术用于肝癌三维重建与术后测量的一致性分析
蔡明月 江凯 徐蒙莱 蒋骏麟
目前临床上仍以手术切除作为治疗原发性肝癌的首选手段,而术前影像学精确评估是实现精准肝切除的必要条件[1-2]。但普通二维影像学检查难以准确反映肝内复杂Glisson系统分布情况,加上手术中经常发现胆管、血管变异现象,而肝脏肿瘤生长部位各异,可能并发血管侵犯及血管内癌栓状况[3]。近年来,有研究表明,数字医学经三维可视化技术实现肝脏三维重建,可直观、清晰观察肿瘤组织,判断肝内血管解剖结构,明确肿瘤与肝内脉管系统的毗邻关系,获得更为精确的术前评估,经虚拟手术反复试验,达到指导手术目的[4]。但目前临床上多侧重于分析该技术用于巨块型肝癌可切除性评估中的作用,鲜有报道分析利用该技术实现肝癌术前三维重建模拟手术与实际手术情况的一致性[5]。
资料与方法
一、 一般资料
2016年8月至2019年8月无锡市第五人民医院收治的原发性肝癌患者144例,男90例,女54例,年龄为(58.6±10.2)岁。入选标准:①入院后确诊[6];②肿瘤直径≤10 cm,均行肝切除术;③肝功能Child-Pugh分级为A~B级;④吲哚菁绿15 min滞留率≤10%;⑤临床资料完整。排除标准:①其他部位恶性肿瘤;②严重凝血功能障碍;③腹腔肿瘤转移和远处转移;④门静脉癌栓形成、肝内转移性子灶。患者签署知情同意书,获医院医学伦理委员会批准。
二、方法
(一)术前CT检查 术前均接受上腹部螺旋CT平扫联合增强检查。检查前患者禁食4 h以上,训练呼吸憋气,尽可能控制呼吸运动所致伪影。先行常规上腹部平扫联合增强扫描,取患者仰卧位,选择头足方向,自膈顶至平脐为扫描范围。管电压选择120 KV,选择自动适应管电流(旋转0.5 s/w),矩阵512 mm×512 mm,视野 60~70 cm,螺距0.2。以日本东芝公司生产的Aquilion One 320排螺旋CT行肝胆胰脾CT检查,先执行平扫扫描。结束平扫期后经肘静脉注入碘帕醇(国药准字H20053388,上海博莱科信谊药业)75 mL,注射速度为4 mL/s。扫描过程中瞩患者屏住呼吸,注入对比剂延迟27 s行动脉期扫描,延迟60 s时予以门静脉期扫描。结束增强扫描后每期层厚切薄至1 mm,数据采集后以DICOM文件格式存储。所有CT结果示肝癌,未发现门静脉癌栓形成、肝内转移性子灶及腹腔肿瘤转移和远处转移影像学表现。
(二)肝脏三维模型重建 (1)CT图片导入:原始CT平扫期、动脉期、静脉期数据以DICOM文件格式导入三维重建系统数字医学影像诊断软件(Youktal)中,可在屏幕中分屏显示原始CT横截面图列、矢状切面和冠状切面图列。于其中一个图列中执行某点定位时可同时在另外两个图列中找到该点另一切面CT图对应位置,以三条互相垂直且不同颜色直线交点表示。(2)图像分析及重建:软件中肝脏模型建立采用三维重建器官切割方法进行,在CT值与正常肝脏组织同样位置上构建种子点若干,阈值范围适当调整后诱导所有种子点呈充填生长,且占满整个肝脏模型。经比较不同图列(冠状切面和横截面图列),分析种子点是否占满肝脏模型,后经计算机三维计算实现三维肝脏模型重建。以同法实现肝脏占位,胰腺、脾脏、胆囊等器官三维模型的重建。后选择增强动脉期CT数据,在某条动脉上经通用分割算法设置种子点若干,经阈值分析行与动脉期血管接近的CT阈值范围区间计算。同法选择静脉期及门静脉CT数据,实施肝静脉及门静脉三维管道模型重建。若重建过程中数据量庞大,出现计算机无法计算状况,可经软件中数据采集框行计算感兴趣区域采集,将采集框以外CT数据屏蔽。(3)后期加工:经软件工具(包括剪裁、选择连通区域等工具)剔除非该脏器组织,后整合所有单个模型,还原肝脏和病变三维立体面貌,显示各器官及肿瘤病变所在。
(三)肝脏三维重建术前评估 重建模型行360°多轴向旋转,缩小或放大图像,并对重建器官模型行透明化处理,基于清晰显示肝脏情况下观察肝脏内管道走行状况,多角度分析肿瘤形态、大小及肿瘤与肝脏各重要血管的比邻关系,明确有无血管侵犯及癌栓形成等情况。同时,于三维重建软件中显示所有经三维重建后模型的体积,根据患者有无肝硬化及肿瘤侵犯范围,于三维重建模型图中拟定适合肝切除方式,经软件工具行模拟肝切除。同样,于屏幕中显示直接重建模型中切除后剩余肝体积值,并计算剩余功能肝体积百分比。
三、统计学方法

结 果
一、手术情况分析
144例患者均成功通过三维重建肝脏及肝内血管模型,通过术前评估,虚拟手术后有5例因肿瘤侵犯下腔静脉而无法耐受手术,行肝动脉造影+化疗栓塞术;其余患者均成功实施肝切除术,其中肝左外叶切除手术74例,第Ⅳ肝段切除术5例,第Ⅵ肝段切除15例,第Ⅶ、Ⅷ肝段切除术15例,右半肝切除术5例,左半肝切除术10例,不规则肝切除15例。手术时间为(260.5±148.0)min,术中出血量为(196.7±90.7)mL。图1,图2为2例患者术前影像学表现。

A:术前CT检查动脉期,红色箭头处为肿瘤;B:术前CT检查,黄色箭头处为肿瘤供血动脉;C:术前CT检查静脉期,红色箭头处为肿瘤,肝左静脉位于其下方;D:术前肝脏三维重建,肿瘤与供血动脉关系;E:术前肝脏三维重建,肝脏与肿瘤3D可视化全景图,绿色为肿瘤;F:术前肝脏三维重建,容积再现,体现肝脏肿瘤与肝动脉关系,红色箭头处为肿瘤

A:术前CT检查动脉期,红色箭头处为肿瘤;B:术前CT检查静脉期,红色箭头处为肿瘤;C:术前肝脏三维重建,肝脏与肿瘤3D可视化全景图,粉红色箭头处为肿瘤;D:术前肝脏三维重建,容积再现,肝脏肿瘤与肝动脉的关系,红色箭头处为肿瘤;E:术前肝脏三维重建,虚拟肝脏可视化,预切除平面为黄色箭头所示处
二、术后切除肿瘤与术前三维重建计算所得结果比较
139例肝切除患者术前基于三维可视化技术下测得全肝体积为(1500.5±447.9)mL,虚拟肝切除体积为(507.8±184.4)mL,标准功能肝体积比值(剩余肝体积/功能全肝体积)为52%~74%,平均为(64.0±8.5)%。术后将切除的肝组织置入装有水的量筒中,经水测法获取实际肝切除体积为(523.0±175.8)mL。虚拟肝切除体积与实际肝切除体积差异无统计学意义(χ2=0.703,P=0.482),经Pearson′s相关性分析显示二者呈正相关(r=0.949,P<0.01)。见图3。
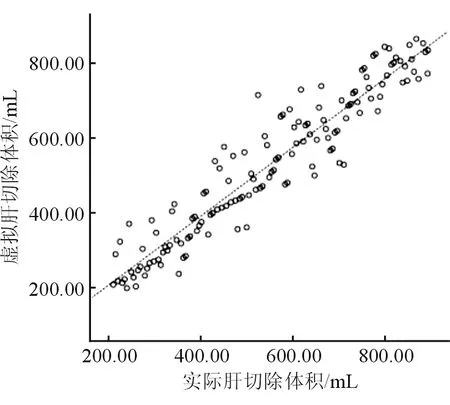
图3 虚拟与实际肝切除体积的线性相关图
三、预后情况分析
所有肝切除者术后住院时间为(9.0±2.0)d。术后出血3例,通过输血和止血等治疗后均成功止血;胆漏2例,分别通过充分引流7、9 d后痊愈;双侧胸腔积液2例,通过实施右侧胸腔穿刺抽液后痊愈出院;急性心机梗塞2例,待转入心内科继续治疗后好转出院。随诊3月发现所有患者均未出现肿瘤复发及转移情况。
讨 论
肝脏肿瘤巨大或肿瘤与第一、二、三肝门邻近时,会增加手术难度,引起术中出血和术后肝衰竭,故术前掌握肝内脉管系统解剖、准确评估残肝体积尤为重要[7]。以往肝切除术前评估常规采用二维影像学检查方法(如MRI、CT等),无法精确显示肝内脉管结构及其与肿瘤的毗邻关系[8]。
近年来,基于CT技术的可视化三维图像重建技术在肝胆外科领域应用广泛。利用该技术重建的肝脏三维模型可自任意角度透过脏器进行全面观察,方便术者对肿瘤与肝内脉管系统的毗邻关系进行直观分析,利于术者准确把握肿瘤可切除性及切除范围;同时,可采用MI-3DVS进行仿真手术,经反复预切除,提高术者手术预见性,进而熟悉手术过程,确保切缘阴性同时尽可能保留残肝解剖结构完整,缩短手术时间,预防重要血管损伤[9-11]。本研究中1例第Ⅳ肝段切除术患者,术前重建显示肿瘤与肝中静脉上方紧贴,因术前准备充分,术中该处谨慎操作,未发现损伤情况,可见若术前未掌握变异血管走行、类型,术中易引起血管损伤,增加术中出多,延长手术时间。有5例肝右叶上段肿瘤患者术前三维重建后发现肿瘤侵犯下腔静脉而选择肝动脉造影+化疗栓塞术,避免了下腔静脉损伤风险;其余患者均成功实施手术,实际手术过程中出血量少,手术时间较短,证实了可视化三维图像重建技术在肝脏切除术中具有良好指导性及准确预测性。
以往术前主要通过CT/MRI影像粗略计算肝脏体积,或通过PACS系统二维影像获取全肝体积、剩余肝脏体积,所得结果精确度欠缺,可能与二维CT或MRI影像计算肝体积不精确、肝脏病变情况下单位体积内肝脏功能并不一致有关[12]。而基于二维CT数据的可视化三维图像重建技术,经术前准确判断肝脏切除手术所致剩余肝体积缺血或淤血状况,可确保肝切除手术的安全性及精确性[13-15]。本研究中,139例肝切除患者术前基于三维可视化技术下测得全肝体积、虚拟肝切除体积、标准功能肝体积比值,术后切除肿瘤获取实际肝切除体积,发现虚拟与实际肝切除体积无显著变化,但二者呈正相关,与既往报道[16]相符,证实术前三维重建具备计算肝脏体积的精准性与提高虚拟切除技术的可行性。本研究中,术后13例患者存在并发症,经对症治疗后好转,且随诊无肿瘤复发及转移病例,证实可视化三维图像重建技术在改善手术预后方面具有重要意义。
综上,利用三维可视化技术实现肝癌术前三维重建模拟手术与实际手术情况存在一致性,术前经三维可视化技术重建可精确评估手术风险,精确计算肿瘤体积及剩余肝脏体积,明确最佳手术方案。但本文属单中心研究,而计算机行虚拟肝切除的操作体验与实际手术存在一定距离,故今后期望扩大样本量,经投映方式重建器官后术者可直接在投映假象中操作行虚拟手术。

