Gd-EOB-DTPA MRI联合超声造影对肝硬化背景<2 cm肝癌的诊断
陈育锋 朱泽远 程影 祁良
肝细胞癌(HCC)是常见消化系统恶性肿瘤,外科手术是治疗HCC的主要方式,通常认为对于直径<2 cm HCC即小肝癌(SHCC)是易于手术切除的,且预后较为理想,临床早期确诊HCC特别是SHCC在患者的临床管理中至关重要[1-3]。HCC发生是一个复杂、多步骤过程,包含肝硬化结节、异常增生病灶、早期肝癌和肝癌等阶段,国内多数HCC病例发生在严重肝硬化患者中,给影像评估添加难度。增强扫描肝脏病变的供血表现是判别HCC的主要依据,研究称Gd-EOB-DTPA MRI、超声造影(CEUS)是诊断SHCC最为有效的影像学检查方式[4-7]。Gd-EOB-DTPA是近年来应用于肝脏病变检查的新型特异性造影剂,它可以经肾脏或胆道系统从人体内排泄出来,具有小病灶检出率高、肝胆期敏感度高、图像信息丰富等优点,有利于对肝脏病变检测及定性诊断[8-9]。CEUS能实时监控血供情况,而病灶血供动脉化是HCC发展的必要经过[10]。先前的研究表明Gd-EOB-DTPA MRI、CEUS对SHCC诊断表现评价不一,研究称仅有33% SHCC病灶能够同时在Gd-EOB-DTPA MRI、CEUS增强扫描时被显示出来,而这也难以满足临床中对SHCC的诊断要求[11]。本研究旨在分析Gd-EOB-DTPA MRI联合CEUS对肝硬化背景下SHCC诊断的临床价值。
资料与方法
一、研究对象
2015年1月~2019月12月HCC高危风险的局灶性结节(<2 cm)患者52例(男36例、女16例),年龄(56.8±9.0)岁。要求:有肝硬化并接受Gd-EOB-DTPA MRI和CEUS检查,间隔时间<4周;通过Gd-EOB-DTPA MRI、CEUS检测出病灶;经Gd-EOB-DTPA MRI测量病灶直径<2 cm。研究为回顾性的分析,放弃患者知情同意。
二、研究方法
(一)Gd-EOB-DTPA MRI Siemens公司(德国)3.0T磁共振系统检查。接受T1WI、T2WI、同反相位序列及多b值DWI成像。造影剂为Gd-EOB-DTPA(Schering公司,德国)。
(二)CEUS GE公司(US)Logiq L9型超声仪检查。探头C5-1,频率2~5 MHz。造影剂为SonoVue(Bracco公司,意大利),注入剂量2.4 mL,具体操作参见Gd-EOB-DTPA。
(三)图像分析 影像读片医师对患者资料进行盲法处理,运用软件SPSS 19.0做统计分析,绘制ROC曲线评价Gd-EOB-DTPA MRI、CEUS的诊断效能。α=0.05。
结 果
一、影像特征
52例患者共70个结节,其中54个结节为SHCC,16个为异型增生结节(DN)。SHCC、DN在除门脉期廓清表现中无明显差异外,其他影像表现均存有显著差异(P<0.05,表1)。
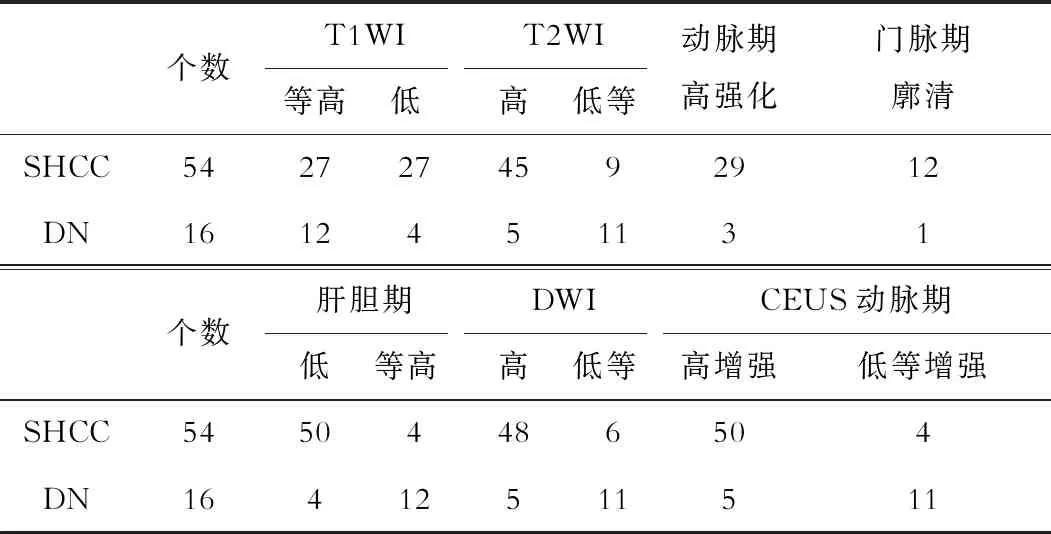
表1 SHCC病灶在Gd-EOB-DTPA MRI、 CEUS中影像表现[n(%)]
二、诊断效能
由表2可知,CEUS动脉期高增强、肝胆期低信号及DWI高信号诊断SHCC时AUC均分别高于T1WI低信号、T2WI高信号及动脉期高强化(P<0.05),联合诊断时敏感度、特异度及准确度为95.5%、96.3%及96.2%。
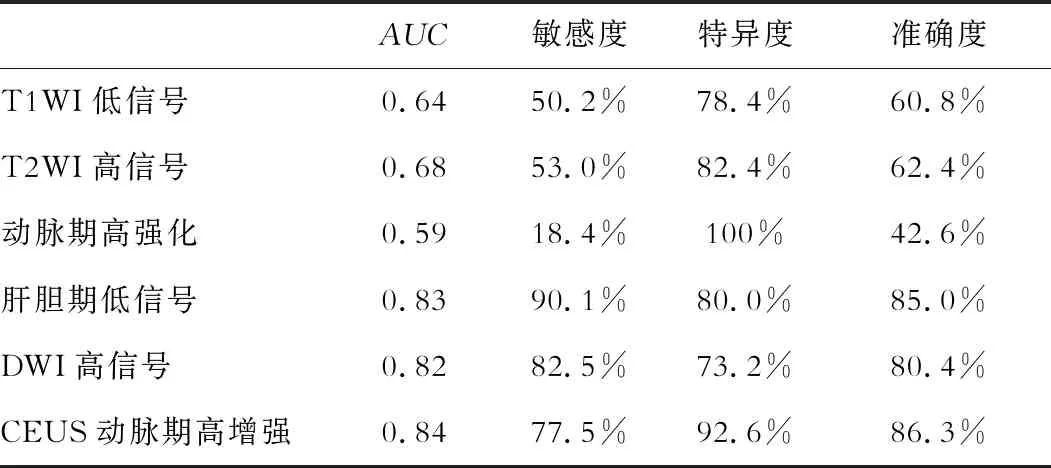
表2 Gd-EOB-DTPA MRI、CEUS诊断SHCC病灶效能表现
讨 论
CEUS、Gd-EOB-DTPA MRI是诊断HCC常用的影像学方法,但随着目标病灶直径的减小,诊断效能也在不断下降,比如De Martino等[12]报道其诊断SHCC敏感度、特异度为77%、84%,效能表现差强人意。此外,Tsurusaki et al表示对于<2 cm、>2 cm HCC病灶,Gd-EOB-DTPA MRI诊断敏感度具有显著性差异(85%对97%,P<0.05),因此提高肝硬化患者SHCC的诊断效能是迫切需要的[13]。病灶血供动脉化是HCC发生的重要特征,CEUS能够实时检测到病灶血流灌注情况,因而在监测肝脏病变的血供方面是有用的。Sugimoto 等[14]表示以动脉期富血供为诊断标准时,CEUS诊断HCC敏感度可达到85%。Zhou等[15]报道称70.8% SHCC病灶在CEUS门脉或延迟期呈低强化,这也削弱了CEUS对肝脏病变的诊断能力。与CEUS造影剂不同的是,Gd-EOB-DTPA具备细胞外、肝胆期造影剂特质,当创造性地结合肝胆期成像后进行SHCC诊断时敏感度能够显著提高,因为肝胆期低信号是HCC的重要特征[16]。然而多数HCC患者同时存在肝脏功能障碍、胆汁淤积等情况,Gd-EOB-DTPA摄取率降低,因此增加了对病变与肝脏组织的鉴别难度。此外,DWI能够评价水分子的扩散情况,因HCC细胞增殖加速,细胞致密性增加,进而导致水分子扩散受到局限,表现为DWI信号强度增加。不过,与肝胆期类似,DWI成像也易受到肝脏病变带来信号变化的影响。

