预氯化对原水管道含氮污染物转化及微生物群落结构的影响
周正协,徐 巧,何建荣,刘志刚,,许 航,陈桃源
(1. 宁波市自来水有限公司,浙江宁波 315041;2. 河海大学环境学院,江苏南京 210098)
原水输送管道系统是城镇给水系统的重要组成部分,由于原水管道通常管径大且距离长,因此,在原水的输送过程中通常会发生一系列物理、化学及生物反应,引起水厂进水端水质的变化。近年来,随着水体富营养化的不断加剧,湖泊、水库、河流等常用水源地普遍存在藻类增殖引起水质问题的现象。为控制藻类在原水输送管道中大量繁殖,一些水厂采用在取水前端投加氧化剂的方式保证输送过程中的水质稳定[1]。预氧化能够有效抑制原水管道中藻类微生物的繁殖,但是氧化剂同样会破坏原水管道中微生物的活性,不仅影响原水管道内壁微生物对水体的净化作用,也会因为生物膜失活脱落而增加水质污染风险[2]。目前,关于氧化技术对饮用水水质影响的研究主要集中在水厂及市政供水管网,针对原水预氧化技术对原水输送过程中的水质变化规律及对微生物群落结构的影响研究较少。本文利用原水管道模拟装置探究了不同浓度预氧化条件下,原水含氮污染物的转化规律及微生物群落结构变化,以期为原水管道预氯化处理技术保障原水水质安全性提供理论依据。
1 试验材料与方法
1.1 试验装置
试验原水管道模拟小试装置如图1(a) 所示。将管道内径为100 mm的水泥砂浆内衬管段截成长度为20 cm的试验管段,用纯水将管道洗净后自然通风晾干。用环氧树脂涂抹管段的外壁以及横切面,消除对试验水质的影响,最后将处理好的管段放入原水输送管道,模拟中试装置以培养生物膜,中试装置结构参照顾艳梅等[3]的研究,如图1(b)所示。对上述管段及中试装置内进行周期性的微生物量检测,当两者数量相当时可认为挂膜成功。将挂膜成功后的管段取出后放入试验容器,利用磁力搅拌器模拟实际水流的剪切力,对试验容器进行外覆锡纸处理以模拟管道埋地状态。
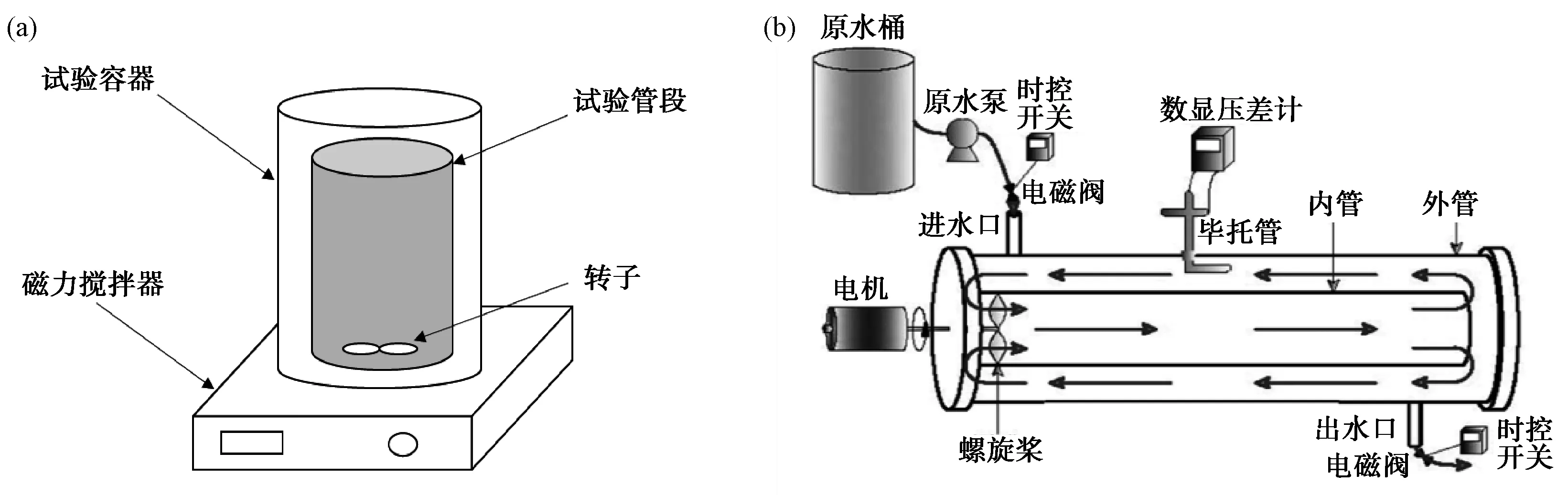
图1 原水管道模拟装置 (a)小试; (b)中试Fig.1 Schematic Diagram of Raw Water Pipeline Simulation Device (a) Bench-Scale; (b) Pilot-Plant
1.2 试验水质
试验管段挂膜期间的进水为宁波JK水库水,宁波JK水库水质基本满足我国《地表水环境质量标准》(GB 3838—2002)中的相关限值要求,试验期间模拟管道装置的进水水水质如表1所示。试验过程采用次氯酸钠配制成的氯化溶液作为预氧化剂,试验在常温下进行。
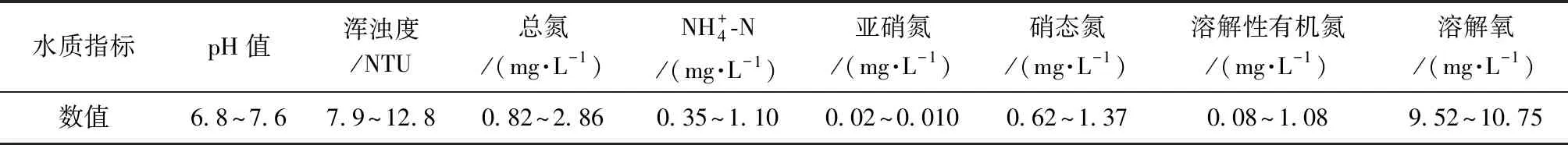
表1 试验用水水质Tab.1 Quality of Influent Water
1.3 测定项目及分析方法
(1)常规水质指标测定

(2)溶解性有机氮(DON)分子量分布测定
DON的分子量分布采用超滤膜法测定,使用超滤杯和超滤膜对DON分子量分布进行测定。超滤杯中配有磁力搅拌器,其压力驱动是高纯氮气,压力约为0.15 MPa;超滤膜的有效面积为31.75 cm2,其截留的分子量分别为10、5、3、1 kDa。先将待测水样用0.45 μm的微滤膜进行过滤,再将水样依次通过不同截留分子量的超滤膜,测定膜后水样中的DON含量,各级浓度相减得到各分子量范围内的有机物含量[4],如式(1)~式(5)。
(1)
(2)
(3)
(4)
(5)
其中:Ci——分子量在i的DON浓度,mg/L。
(3)DON亲疏水性测定
DON 的亲疏水性通树脂吸附法实现分离[5]。先将待测水样用0.45 μm的微滤膜进行过滤,调节pH值至2后,分别使用 DAX-8、XAD-4和IRA-958树脂将待测水样中的DON分离成不同亲疏水性的组分。
(4)微生物指标测定
异养菌总数(HPC)采用R2A平板计数法测定,微生物群落结构采用宏基因组测序法测定。
2 结果与讨论
2.1 不同加氯量下pH值和DO的变化
不同加氯量下装置出水pH值和DO浓度变化如图2所示。未加氯时,出水pH值随时间延长而逐渐降低,这主要是由于硝化菌的硝化作用。加氯后,出水pH值较对照组明显上升,分析原因是次氯酸钠溶液呈碱性,投加后引起出水pH值的上升。此外,随着氯投加量的增加,管道内壁硝化菌的硝化作用可能被抑制,导致出水pH值上升。
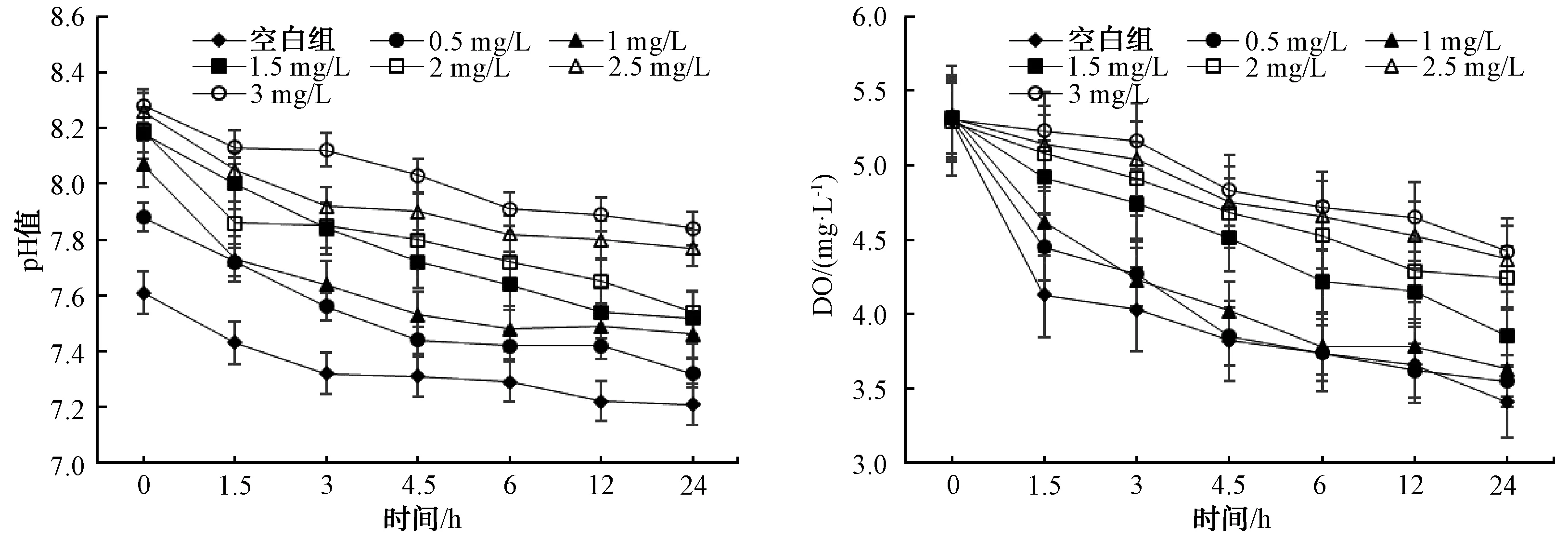
图2 不同加氯量pH值和DO浓度变化Fig.2 pH Value and Dissolved Oxygen Concentration at Different Chlorine Dosage
由出水DO浓度变化可知,未加氯时,装置出水DO浓度随着时间的延长逐渐降低,反应24 h后出水DO浓度下降约1.9 mg/L。随着氯投加量的增加,出水DO浓度逐渐上升,当加氯量在0.5~1.0 mg/L时,出水DO浓度随时间的下降趋势同空白对照组相似。这表明在较低浓度加氯条件下,管道内部可能存在一部分耐氯微生物仍能维持自身的生长代谢过程,消耗水中的DO;当加氯量大于1.5 mg/L时,出水DO浓度较低浓度加氯量时明显上升,这可能是由于高浓度的氯能够使管道内部微生物大量失活,从而降低耗氧能力。
2.2 含氮污染物的变化

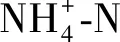
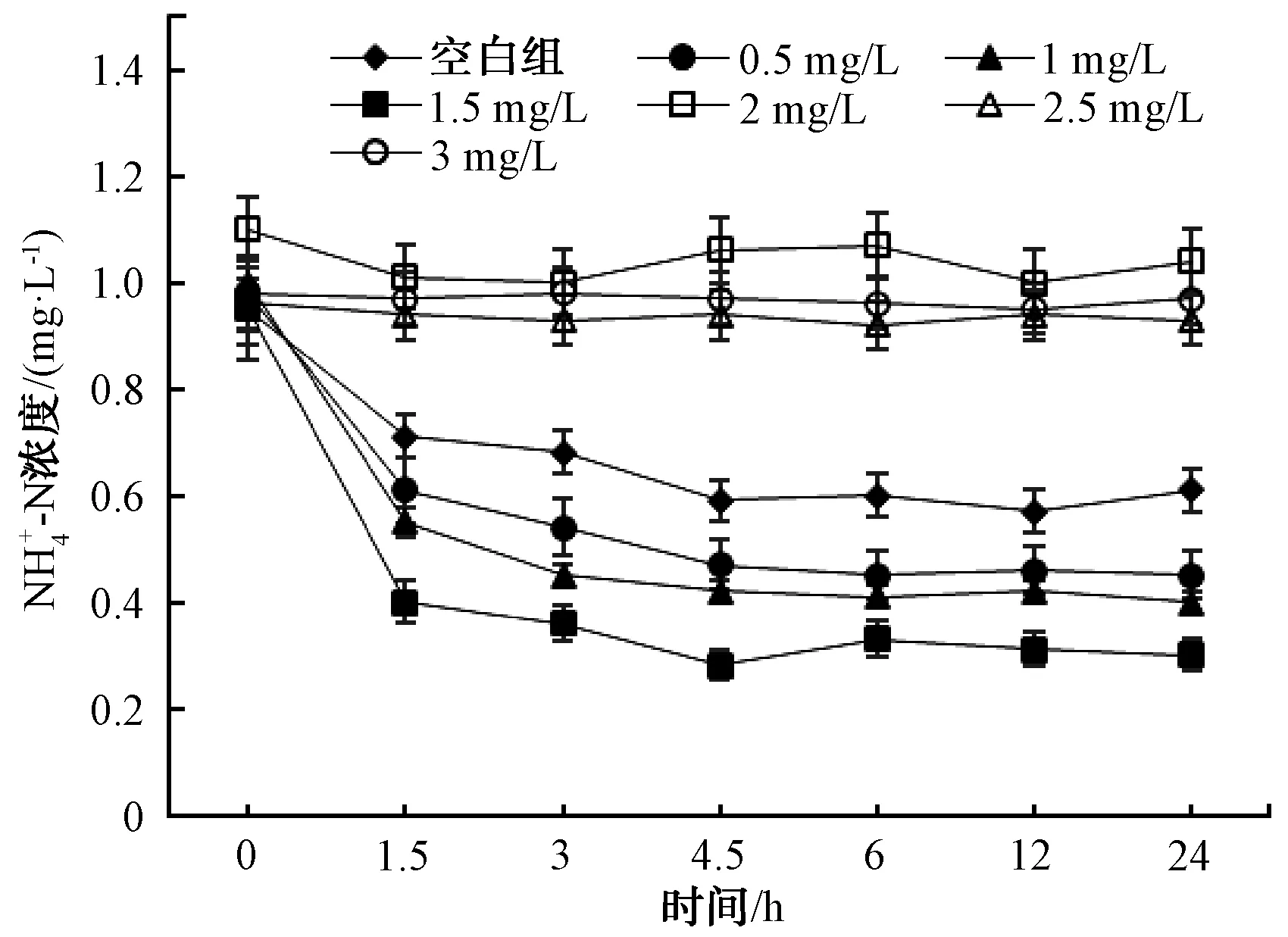
图3 不同加氯量下浓度的变化 Concentration at Different Chlorine Dosage
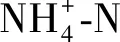
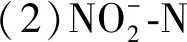
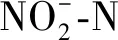
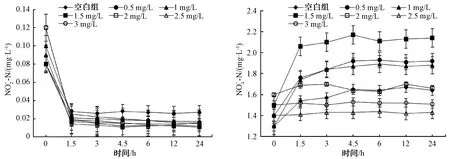
图4 不同加氯量下和浓度变化 and Concentration at Different Chlorine Dosage
(3)DON浓度的变化
DON浓度变化如图5所示,空白试验组出水DON浓度随时间逐渐增大,24 h后出水DON浓度增加0.13 mg/L,增长率为45%。DON浓度的上升可能由3方面因素引起:(1)试验管道内壁生物膜在代谢过程中会产生一系列代谢产物,导致出水DON浓度升高;(2)水体中悬浮颗粒物表面附着的有机物与氯发生反应引起DON浓度的升高;(3)水力剪切作用可能会导致部分生物膜脱落,引起出水DON浓度升高。加氯后,出水DON浓度明显增加,且随着投加量的增加而升高。当加氯量大于1.5 mg/L,反应时间为4.5 h时,出水DON浓度较进水增加86%左右。这可能是由于较大的加氯量会破坏生物膜胞外结构,导致生物膜内微生物失活后进水水体,增加出水DON的浓度。赵锐[7]研究了加氯作用对供水模拟管道生物膜的影响,结果表明,当水中游离氯浓度逐渐升高到0.5 mg/L时,管壁生物膜内生物量随游离氯的增加呈直线下降趋势,生物膜内生物量减少约90%。另外,微生物产生的有机物会和氯反应生成复杂的消毒副产物,这可能也是引起出水DON浓度升高的原因之一。

图5 不同加氯量下DON浓度变化Fig.5 Dissolved Organic Nitrogen Concentration at Different Chlorine Dosage
2.3 DON分子量及亲疏水性变化
选取出水DON浓度相对稳定的4.5 h水样进行分子量分布及亲疏水性测定,结果如图6所示。试验原水以小分子DON为主,分子量<1、1~3、3~5、5~10、>10 kDa所占比例分别为63.2%、5.2%、2.3%、7.1%和22.2%。空白试验组DON分子量变化较小,加氯后,DON中分子量<1 kDa的比例逐渐上升,分子量>10 kDa的比例逐渐下降。当加氯量为3 mg/L时,出水DON中分子量<1、1~3、3~5、5~10、>10 kDa所占比例分别为77.5%、8%、2.7%、7.2%和4.6%。这表明随着加氯量的增加,水体中的大分子有机物与氯反应转化为小分子有机物。DON亲疏水性变化如图6所示,加氯后明显增加了DON中亲水性组分的比例,与空白试验组相比,当加氯量为3 mg/L时,亲水性DON比例由69.8%增加至88.2%。疏水性有机物通常含有大量的芳香族结构,而亲水性组分通常含有更多的脂肪族结构,如氨基酸和多糖[8]。Beggs等[9]对加氯消毒后有机物荧光光谱的研究结果表明,氯能与水中部分有机物发生反应,将大分子芳香族有机物转化成了小分子亲水性有机物。综上所述,加氯后能够将水体中DON转化为分子量更小,亲水性更强的有机物。
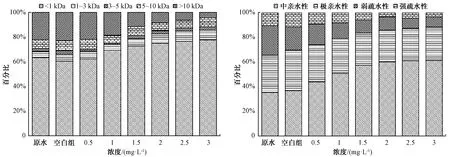
图6 不同加氯量下DON分子量分布及亲疏水性变化Fig.6 DON Molecular Weight and Hydrophilicity at Different Chlorine Dosage
2.4 微生物群落结构变化
在不同加氯量下, 选取反应4.5 h后的管壁生物膜样品进行16S rRNA测序分析。采用Uclust软件将DNA系列进行聚类分析,以97%相似水平为标准划分可操作性分类单元(OTU),结果如表2所示。空白试验组的生物膜样品中得到268个OTU,当加氯量小于1.5 mg/L时,OTU指数较空白组大;当加氯量大于2 mg/L时,OTU指数明显降低。通过对样品Shannon指数分析可知,随着加氯量的增加,Shannon指数先上升后下降,由此可见,与投加高浓度氯(>1.5 mg/L)相比,投加较低浓度氯(0.5~1.0 mg/L)更有利于提高管道生物膜中微生物多样性。与未投加氯相比,较低的加氯量同样表现为较高的微生物多样性,这与Mi等[10]研究供水管网中消毒剂对生物膜中微生物种群结构影响的结果一致。
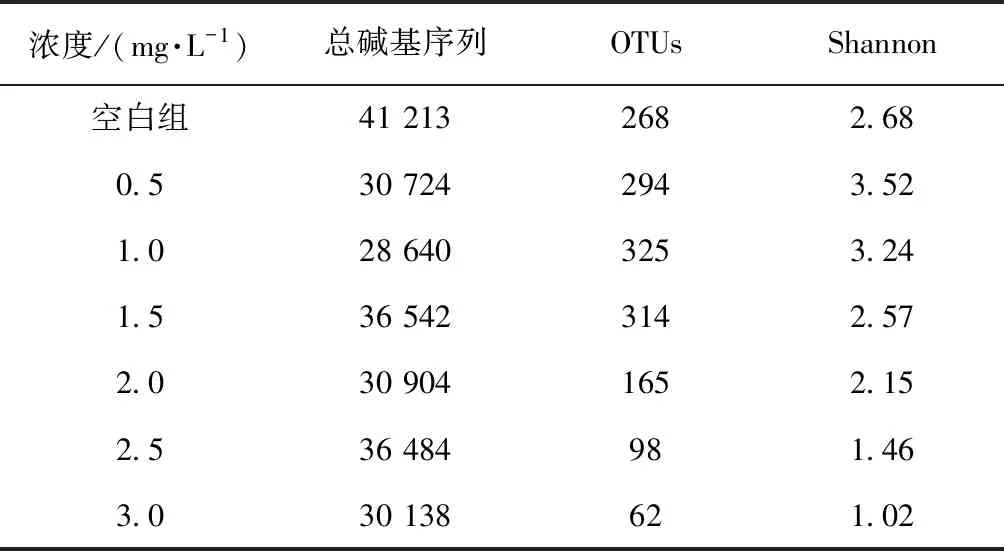
表2 不同加氯量下微生物多样性指数Tab.2 Microbial Diversity Index at Different Chlorine Dosage
为准确反应不同加氯量条件下微生物群落结构,对微生物在门和属水平上的群落结构组成进行分析,结果如图7所示。生物膜中优势菌门主要包括变形菌门(Proteobacteria)、厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)、放线菌门(Actinobacteria)、蓝藻菌门(Cyanobacteria)、浮霉菌门(Planctomycete)、酸杆菌门(Acidobacteri)、硝化螺旋菌门(Nitrospirae)、绿弯菌门(Chloroflexi)及部分未鉴定菌门。
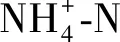

图7 不同加氯量下管壁生物膜微生物群落(门水平)Fig.7 Distributions of Bacterial Strains (Level of Phylum) at Different Chlorine Dosage
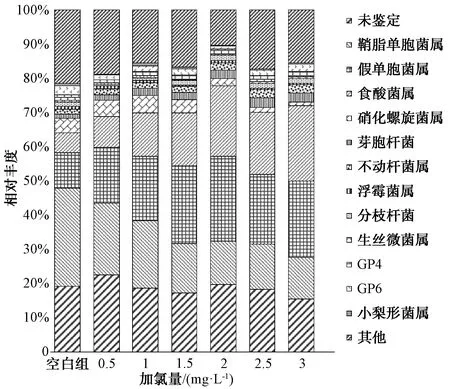
图8 不同加氯量下管壁生物膜微生物群落(属水平)Fig.8 Distributions of Bacterial Strains (Level of Genus) at Different Chlorine Dosage
通过对微生物属水平群落结构分析可知(图8),生物膜中主要含有鞘脂单胞菌属(Sphingomonas)、假单胞菌属(Pseudomonas)、食酸菌属(Acidovorax)、硝化螺旋菌属(Nitrospira)、不动杆菌属(Acinetobacter)等。其中,鞘脂单胞菌属占比随着加氯量的增加不断降低,当加氯量为3 mg/L时,鞘脂单胞菌属比由28.6%下降至12.2%。鞘脂单胞菌属能够产生大量EPS(胞外聚合物),是生物膜形成过程中的重要微生物[13]。由此推断,较高浓度的加氯量可能会加快生物膜的脱落,不利于生物膜生长。此外,假单胞菌属、食酸菌属、不动杆菌属等占比逐渐上升,这些菌属在耐氯菌属研究中具有相关报道[14-15]。
3 结论
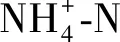
(2)预氯化后水体中DON浓度明显增加,且随着加氯量的增加而升高,主要是由于微生物被消毒剂氧化后细胞溶出物增加以及高氯浓度下管道内壁生物膜失活脱落引起。此外,预氯化后水体中亲水性小分子DON比例明显增加。
(3)投加较低浓度氯(0.5~1.0 mg/L)在一定程度上会促进微生物多样性升高,而较高浓度的氯(>1.5 mg/L)则会大大削减物种多样性。预氯化后,生物膜中变形菌门占比逐渐降低,厚壁菌门则逐渐成为优势菌,占比逐渐上升。硝化螺旋菌门在高浓度氯条件下占比明显降低,这与装置中硝化反应规律相似。在属水平上,鞘脂单胞菌是生物膜中的重要菌属,其占比随着加氯量的增加而降低,而假单胞菌属、食酸菌属、不动杆菌属等耐氯菌属占比则逐渐上升。

