合并阻塞型睡眠呼吸暂停低通气综合征的结直肠癌患者的肠道菌群状况及其慢性间歇性缺氧状况与病理特征的关系▲
何 斌 薛 珉 余苏云 贝颂华 高习文
(复旦大学附属闵行区中心医院1 呼吸内科,2 内镜中心,上海市 201199,电子邮箱:hebing20190@126.com)
结直肠癌是临床常见的消化道恶性肿瘤,2019年国家癌症中心发布的最新数据显示,在农村、城市其发病率分居恶性肿瘤谱的第5位、第2位,且呈逐渐上升、年轻化趋势[1]。尽管近年来诊疗技术和靶向药物快速发展,但结直肠癌患者的预后依然不理想,中位生存时间仅为30个月[2]。间歇性缺氧是阻塞型睡眠呼吸暂停低通气综合征(obstructive sleep apnea syndrome,OSAHS)的重要特征[3]。研究表明,间歇性缺氧所致的氧化应激反应和缺氧诱导因子(hypoxia inducible factor,HIF)表达水平的升高与肿瘤的发生和发展密切相关[4]。OSAHS可通过间歇性缺氧影响结直肠癌的病理生理特征,但具体机制仍未完全阐明[5]。因此,本研究探讨合并OSAHS的结直肠癌患者的肠道菌群状况及其慢性间歇性缺氧状况与病理特征的关系。现报告如下。
1 资料与方法
1.1 临床资料 选择2015年1月至2018年12月间在我院就诊或体检的100例患者或体检者作为研究对象,其中健康者(对照组)、结直肠癌合并OSAHS患者(结直肠癌+OSAHS组)、单纯结直肠癌患者(结直肠癌组)、单纯OSAHS患者(OSAHS组)各25例。结直肠癌患者入组标准:(1)所有患者均经手术病理确诊,且临床资料齐全;(2)术前未接受放化疗或其他抗肿瘤治疗;(3)排除合并其他肿瘤及心肝肾等重要器官严重功能不全者。OSAHS患者入组标准:(1)OSAHS诊断符合中华医学会呼吸病学分会制定的诊断标准[6];(2)睡眠呼吸紊乱指数≥40次/h;(3)排除慢性阻塞性肺疾病患者、心肝肾等重要器官严重功能不全者。各组的性别构成比、年龄等差异均无统计学意义(均P>0.05),结直肠癌+OSAHS组与结直肠癌组患者在Dukes分期、分化程度、淋巴结转移等方面差异均无统计学意义(均P>0.05),见表1。本研究符合《赫尔辛基宣言》的伦理学要求,患者或家属均签署知情同意书。
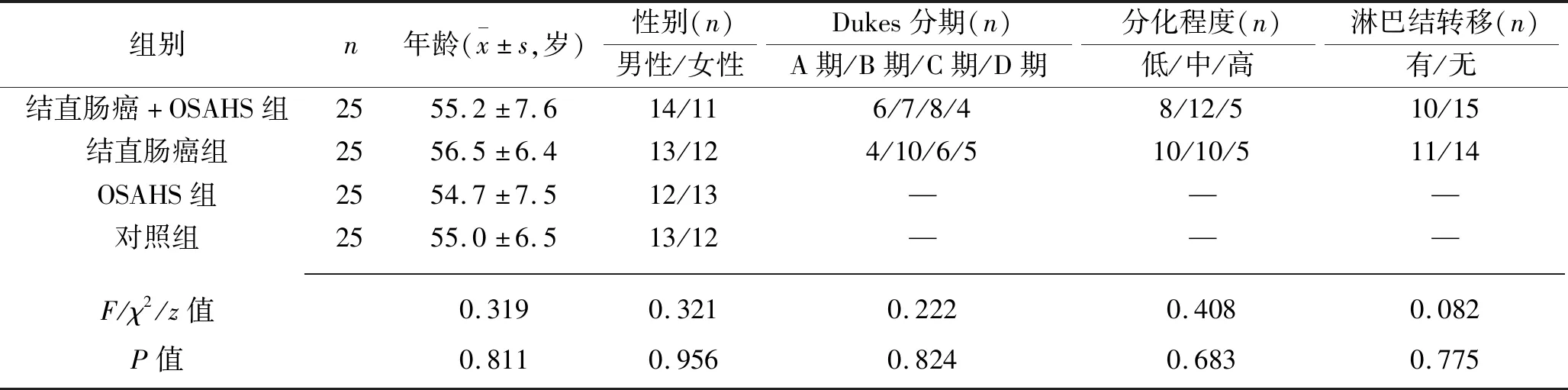
表1 4组一般资料的比较
1.2 研究方法
1.2.1 病理资料收集:结直肠癌患者均于术中留取肿瘤病灶组织标本,送病理检查,明确Dukes分期、分化程度、淋巴转移等情况。
1.2.2 粪便肠道菌群计数及种类鉴定:(1)收集所有研究对象的适量新鲜粪便,30 min内送检,其中结直肠癌患者在术前3 d采集,其余研究对象在肠镜检查前3 d采集。(2)称取0.1 g粪便标本置于EP管,加入0.9 mL生理盐水混匀,倍比稀释,依次稀释10倍、102倍、103倍;将不同稀释度的标本分别接种于需氧菌、厌氧菌培养基上进行初次分离培养,其中需氧菌培养条件为37℃(18~24 h),厌氧菌培养条件为37.5℃(24~48 h);在相应时间内若未见菌落生长,则继续按原条件培养至1周。确定平板上的目的菌后,利用平板计数法对菌株进行计数;根据平板活菌计数和稀释倍数,按下列公式计算活菌计数,活菌数量=lg[每毫升粪便标本活菌集落数量(CFU/mL)],每毫升粪便标本活菌集落数量(CFU/mL)=(标本质量+稀释量)/标本质量×稀释倍数×菌落个数[7];以稀释倍数102倍计算所得为最终结果。
1.2.3 免疫组化检测:(1)通过手术或肠镜检查采集所有研究对象的结直肠组织样本,其中结直肠癌患者的标本包括肿瘤病灶组织及病灶周围3 cm外的癌旁组织,对照组、OSAHS组肠镜检查时取结直肠黏膜标本(升结肠、横结肠、降结肠、乙状结肠各取活检2块)。(2)采用链菌素抗生物素蛋白-过氧化酶连结法染色,具体操作如下:取得结直肠组织样本后,经甲醛固定、石蜡包埋,制作厚度为3 μm的组织切片4张,常规脱蜡、水化、抗原修复后加入3% H2O2,室温孵育10 min,再用磷酸缓冲盐溶液冲洗3遍;将切片置于1.0%枸橼酸缓冲液持续煮沸2 min后取出冷却,磷酸缓冲盐溶液冲洗3遍;加入山羊血清37℃孵育15 min,加入一抗HIF-1免疫组化单克隆抗体(美国Sigma公司,批号:131105554F)、谷氨酰胺酶2(glutaminase 2,GLS2)免疫组化单克隆抗体(美国Sigma公司,批号:1303189902),37℃孵育60 min;滴加二抗,37℃孵育30 min;滴加辣根酶标记链霉卵白素工作液,37℃孵育15 min,磷酸缓冲盐溶液冲洗3遍;滴加新鲜配制的3,3′-二氨基联苯胺显色(福州迈新生物技术开发有限公司,批号:81215710)15 min,自来水冲洗10 min终止反应,再复染、脱水、透明、封片。(3)为了排除假阳性和假阴性,采用HIF-1、GLS2阳性的结直肠组织切片作为阳性对照,采用磷酸缓冲盐溶液替代一抗作为阴性对照。所有标本均由两名高年资病理医师进行评估;如意见不统一,则由第3名病理医师共同商讨得出统一结论。(4)采用半定量分级计分方法[8]评估HIF-1、GLS2的表达情况:HIF-1、GLS2蛋白均主要位于细胞质,阳性染色表现为淡黄色至棕褐色;染色强度计分标准为无色为0分、淡黄色为1分、棕黄色为2分、棕褐色为3分;阳性细胞占比计分标准为≤5%为0分、6%~25%为1分、26%~50%为2分、≥51%为3分;以染色强度计分与阳性细胞占比得分的乘积作为阳性系数,阳性系数为0~1分判定为该因子阴性表达,阳性系数≥2分则判定为该因子阳性表达。
1.3 统计学分析 采用SPSS 18.0软件进行统计分析。计量资料以(x±s)表示,组间比较采用方差分析或t检验,多组间两两比较采用LSD-t检验,方差不齐时组间比较采用F′检验,两两比较采用Welch检验;计数资料以例数或百分比表示,组间比较采用χ2检验或确切概率法,两两比较采用Bonferroni校正法。以P<0.05为差异有统计学意义;采用Bonferroni校正法时,检验水准=0.05/K,K为比较的次数。
2 结 果
2.1 4组主要肠道菌群的活菌集落数 本研究主要鉴定出5种肠道细菌,分别是乳酸杆菌、脆弱拟杆菌、大肠埃希菌、双歧杆菌、粪肠球菌。4组主要肠道菌群的活菌集落数差异均有统计学意义(均P<0.05);其中,结直肠癌+OSAHS组、结直肠癌组、OSAHS组、对照组的乳酸杆菌集落数依次升高,大肠埃希菌集落数依次降低;结直肠癌+OSAHS组、结直肠癌组的脆弱拟杆菌、粪肠球菌集落数均高于OSAHS组、对照组,双歧杆菌集落数均低于OSAHS组、对照组(均P<0.05)。见表2。
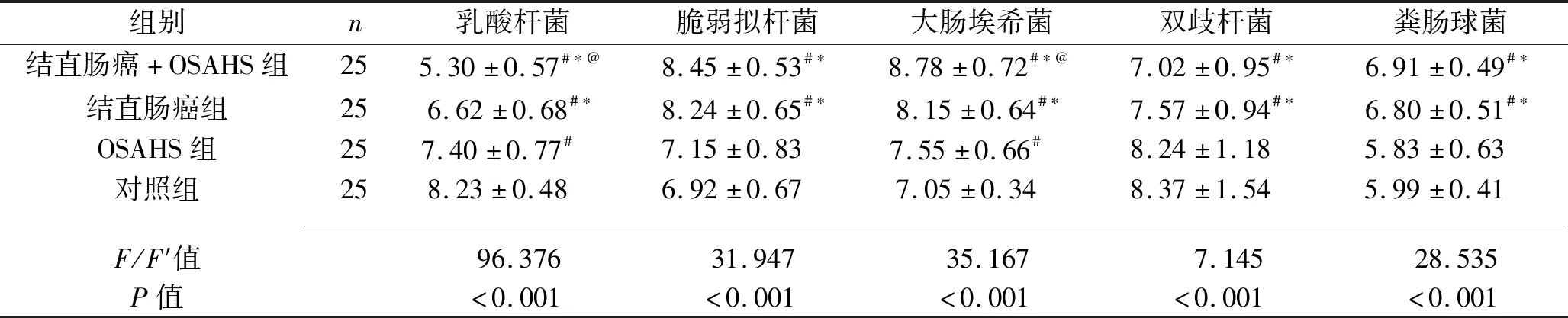
表2 4组肠道菌群分布情况的比较(x±s,CFU/mL)
2.2 各组HIF-1、GLS2的阳性率比较 与对照组比较,结直肠癌+OSAHS组、结直肠癌组、OSAHS组的HIF-1、GLS2表达阳性率均升高(均P<0.05)。见表3。
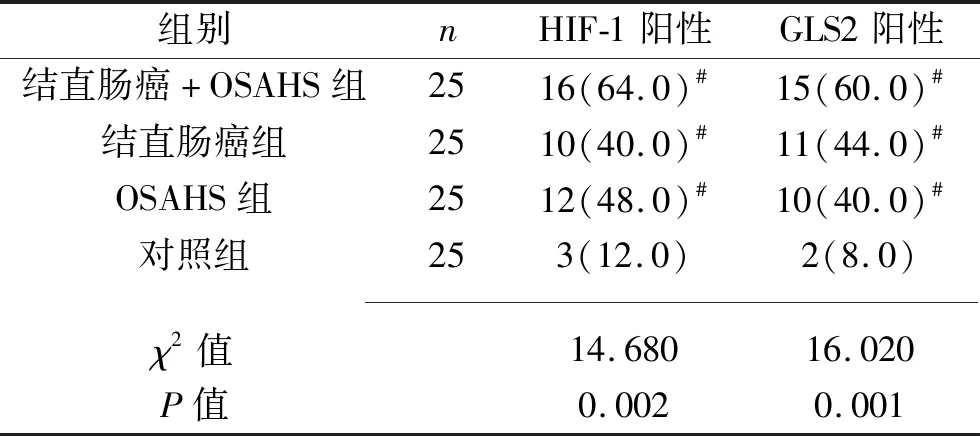
表3 各组HIF-1、GLS2阳性率的比较[n(%)]
2.3 结直肠癌患者癌组织及癌旁组织HIF-1、GLS2的阳性率的比较 结直肠癌+OSAHS组和结直肠癌组中,与癌旁组织比较,结直肠癌组织HIF-1、GLS2阳性率均升高(均P<0.05)。见表4。
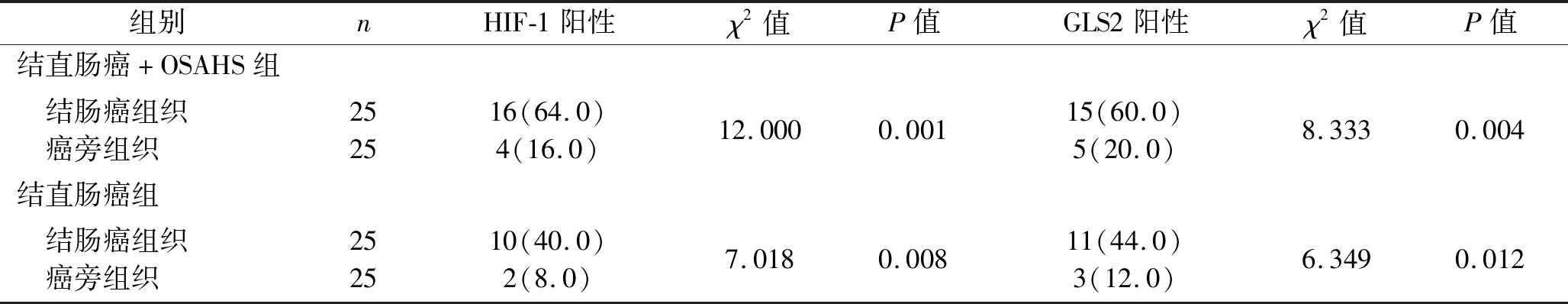
表4 结直肠癌患者癌组织及癌旁组织HIF-1、GLS2的阳性率的比较[n(%)]
2.4 结直肠癌+OSAHS组患者HIF-1、GLS2的表达与临床病理特征的关系 浸润深度≥T2期、Dukes分期为C~D期、合并淋巴结转移的结直肠癌+OSAHS患者的GLS2阳性率升高,合并淋巴结转移的结直肠癌+OSAHS患者的HIF-1阳性率升高(均P<0.05)。见表5。
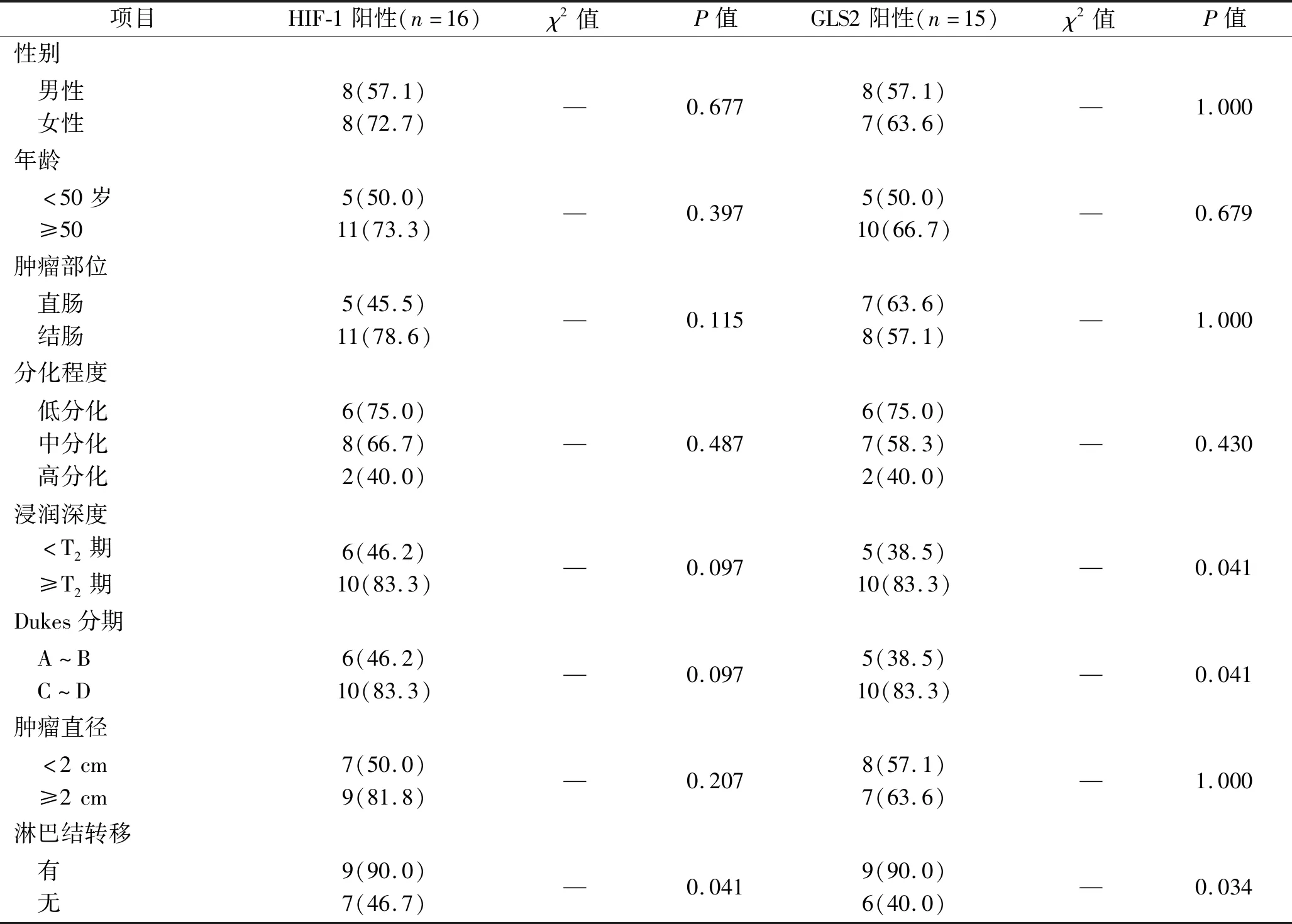
表5 结直肠癌+OSAHS组患者HIF-1、GLS2阳性率与临床病理特征的关系[n(%)]
3 讨 论
近年来,OSAHS发病率不断升高,成人OSAHS患病率高达4%,60岁以上人群患病率可高达20%~40%,该病严重影响患者的生活工作质量,对健康和生命具有极大危害[9]。OSAHS的病理生理特征表现为睡眠中气道塌陷阻塞、气流受限,引起反复间歇性缺氧、二氧化碳潴留、睡眠片段化,造成内分泌功能紊乱、神经调节功能失衡、血流动力学改变及微循环异常等变化,最终导致多系统器官功能损害;由于机体的保护性反应,OSAHS患者夜间可出现反复觉醒、通气加快,这使得间歇性缺氧症状可获得缓解,但入睡后再次出现间歇性缺氧。这种缺氧/复氧过程类似于缺血/再灌注状态,可引起机体产生大量活性氧簇,进而诱发HIF-1、GLS2等对氧化还原敏感的转录因子表达增加,促发炎症因子聚集,加重氧化应激反应[10]。
肠道菌群具有肠黏膜生物屏障的作用,在食物消化与吸收、肠黏膜上皮细胞增殖更新、抵抗病原体及炎性反应等方面发挥关键性作用;当肠道菌群失调时,肠黏膜上皮细胞与肠道微环境将出现功能性变化,可诱发结直肠癌等多种疾病[11]。OSAHS可促进肿瘤的发生、发展[12]。Martínez-García等[13]通过多中心临床研究对OSAHS患者随访发现,有9.4%患者被确诊为癌症,其癌症发病率远高于普通人群,但其具体机制仍有待研究。最近有研究显示,间歇性缺氧可改变肠道菌群的多样性:研究者通过构建间歇性缺氧小鼠模型来模拟OSAHS,饲养6周后取粪便进行菌群分析,发现与正常对照小鼠比较,间歇性缺氧小鼠的粪便出现菌群多样性和构成改变,其中拟杆菌、变形杆菌相对减少而硬壁菌群相对增加[14]。本研究结果显示,结直肠癌+OSAHS组、结直肠癌组、OSAHS组、对照组的乳酸杆菌集落数依次升高,大肠埃希菌集落数依次降低,结直肠癌+OSAHS组、结直肠癌组的脆弱拟杆菌、粪肠球菌集落数均高于OSAHS组、对照组,双歧杆菌集落数均分别低于OSAHS组、对照组(均P<0.05),即结直肠癌+OSAHS组肠道菌群异常和微生态紊乱更为明显,厌氧菌与需氧菌比例失衡,这表明OSAHS可促进结直肠癌患者的肠道菌群紊乱。同时,结直肠癌+OSAHS组、结直肠癌组及OSAHS组的HIF-1、GLS2阳性表达率均高于对照组,且结直肠癌+OSAHS组、结直肠癌组肿瘤病灶组织的HIF-1、GLS2阳性表达率均高于癌旁组织(P<0.05),这与邓立勇等[15]的研究结果相似。已有研究证实,肠道菌群与炎症的发生关系密切,在炎症刺激下可通过产生活性氧自由基诱发结肠黏膜的氧化应激反应,并通过HIF-1、GLS2等促进炎症细胞聚集,从而造成DNA损伤,进而激活癌基因或抑制抑癌基因,最终导致癌症的发生[16]。有研究显示,肠道菌群的变化可通过促进肠上皮细胞中内源性细胞因子白细胞介素17C过表达来影响下游Toll样受体/髓样分化因子信号通路,从而诱发结直肠组织发生癌变[17]。进一步分析发现,随结直肠癌浸润深度的增大、Dukes分期增高或出现淋巴结转移,结直肠癌+OSAHS组患者GLS2阳性率明显升高,而合并淋巴转移的结直肠癌+OSAHS组患者HIF-1阳性率明显升高(P<0.05)。研究表明,HIF-1、GLS2参与了肿瘤细胞的血管形成、增殖凋亡和侵袭转移,促进肿瘤的恶性进展,且HIF-1能通过调控GLS2表达等多种途径诱导肿瘤细胞产生耐药,从而削弱患者治疗效果[18]。这提示OSAHS所致慢性间歇性缺氧可能与结直肠癌患者的病理特征甚至预后密切相关。
综上所述,合并OSAHS的结直肠癌患者存在明显的肠道菌群紊乱,OSAHS可能通过影响肠道菌群引起结直肠癌,并与结直肠癌的病理特征密切相关。

