非酮症高血糖伴癫发作一例
高雨田 刘文娟 王克健 黄作义
患者 女性,58岁。因抽搐发作7年,加重3月余,于2021年8月20日入院。患者7年前乘坐电动自行车时突发肢体抽搐,自车上摔下,无意识障碍和严重外伤,急诊至外院诊断为癫,予奥卡西平0.30 g/次、2次/d和左乙拉西坦0.50 g/次、2次/d口服抗癫治疗,发作控制欠佳,每月发作3~4次。3个月前癫发作频繁,表现为身体后倾,右上肢不自主上举,左下肢屈曲,口角向左侧偏斜,持续3~5秒后自行缓解,每日发作20余次,发作过程中无意识障碍和大小便失禁,于2021年8月13日至我院门诊就诊,增加药物剂量为奥卡西平0.60 g/次、2次/d和左乙拉西坦1 g/次、2次/d,癫发作未见明显改善,发作频繁且影响日常生活,门诊收入院。患者既往有2型糖尿病病史8年,随餐服用阿卡波糖100 mg/次、3次/d,睡前皮下注射地特胰岛素8 U,血糖控制欠佳,其母及其妹罹患2型糖尿病,否认癫家族史,余既往史、个人史及家族史无特殊。入院后体格检查:体温36.5℃,心率68次/min,呼吸18次/min,血压124/74 mm Hg(1 mm Hg=0.133 k Pa),心、肺、腹部查体未见明显异常;神经系统查体神志清楚,语言流利,脑神经检查未见异常,四肢肌力、肌张力正常,共济运动和感觉系统未见明显异常,生理反射对称引出,病理反射未引出,脑膜刺激征阴性。实验室检查:入院时随机血糖9.70 mmol/L、入院第2天院第4天早餐前空腹血糖10.81 mmol/L,糖化血红蛋白(HbA1c)7.20%(4%~6%),尿糖阳性、尿酮体可疑阳性;入院第4天腰椎穿刺脑脊液检查外观清亮、透明,压力120 mm H2O(1 mm H2O=9.81×10-3k Pa,80~180 mm H2O),葡萄糖为4.78 mmol/L(2.50~4.40 mmol/L);血清和脑脊液抗自身免疫性脑炎抗体谱抗N-甲基-D-天冬氨酸受体(NMDAR)抗体、抗接触蛋白相关蛋白-2受体(CASPR2R)抗体、抗α-氨基-3-羟基-5-甲基-4-异唑丙酸1和2受体(AMPA1R和AMPA2R)抗体、抗富亮氨酸胶质瘤失活基因1受体(LGI1R)抗体、抗γ-氨基丁酸B型受体(GABABR)抗体、抗谷氨酸脱羧酶65受体(GAD65R)抗体均呈阴性,脑脊液抗神经元抗体抗水通道蛋白4(AQP4)-IgG抗体呈阴性。入院即行长程视频脑电图(LT-VEEG)监测,记录到3天共50余次样发作,表现为右上肢向上抬起,左上肢屈曲,头部向左侧偏转,痛苦样表情,无意识障碍;同期脑早餐前空腹血糖为5.66 mmol/L(<6.10 mmol/L)、入电图显示发作前1秒左侧中央区、顶区、中央中线最先出现棘波节律(图1),以及发作开始后大量肌电和动作伪迹,持续约20秒。入院第5天(8月24日)头部MRI检查显示,右侧基底节区腔隙性梗死灶(图2)。入院第7天(8月26日)头部18F-脱氧葡萄糖(18F-FDG)PET显示,右侧顶叶可疑葡萄糖代谢略有减低,右侧基底节区软化灶(图3)。入院后连续监测3天血糖(7次/d),空腹血糖8.10~11.10 mmol/L、餐后血糖11.80~13.90 mmol/L(<7.80 mmol/L),经内分泌科会诊(入院第4天)后调整治疗方案,在阿卡波糖100 mg/次、3次/d随餐口服基础上,增加格列齐特60 mg/早口服,血糖仍控制欠佳,同时予奥卡西平0.60 g/次、2次/d和左乙拉西坦1 g/次、2次/d,癫发作仍频繁,每日发作20余次;再次请内分泌科会诊(入院后第7天),将治疗方案调整为胰岛素皮下注射,三餐前6 U、睡前8 U,继续监测4天血糖(7次/d),空腹血糖为4.90~7.30 mmol/L、餐后血糖8.20~12.20 mmol/L,抗癫治疗方案不变,癫发作频率明显减少(4次/d),持续时间缩短(1~2 s/次),症状明显减轻,右侧肢体无肌强直样伸直动作。患者共住院15天,出院后遵医嘱规律皮下注射胰岛素(三餐前6 U、睡前8 U),同时监测血糖,并根据血糖水平门诊复诊以调整胰岛素剂量;继续服用奥卡西平0.60 g/次、2次/d和左乙拉西坦1 g/次、2次/d,癫发作好转之后,门诊复诊以逐步减停抗癫药物。出院后2个月随访时,患者癫 发作频率明显减少(约2次/月),仍采取上述抗癫治疗方案。目前仍在随访中。
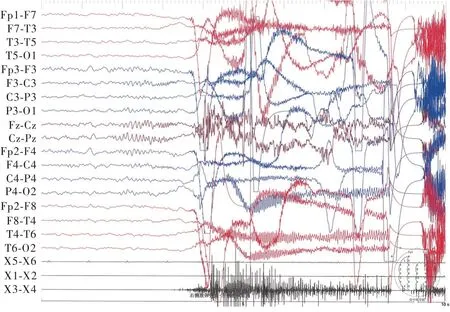
图1 脑电图(2021年8月21日)显示,发作期起始为左侧中央区棘波节律Figure 1 EEG showed the onset of a seizure with a spike rhythm in the left central region.
讨 论
1965年,Maccario等[5]首次报告高血糖状态下并发部分性发作,同时具有血糖升高、酮体阴性、意识保留和部分性发作这4个特点。目前,非酮症高血糖伴癫发作的发生机制尚不明确,单一因素不足以明确解释这种复杂疾病,分析其原因可能为:(1)高血糖状态使神经元产生渗透压梯度,使膜电位去极化[6],蓄积电位引起癫发作。(2)高血糖引起颅内动脉硬化和功能损害,形成的局部缺血性病灶使脑血流量减少,引起脑组织局部代谢状态改变,导致局灶性发作[7]。本文患者18F-FDG PET显像结果亦证实这一机制。(3)高血糖导致γ-氨基丁酸(GABA)代谢升高,增加大脑能量消耗[8],导致癫发作阈值降低。而在糖尿病酮症患者中,细胞内酸中毒使GABA含量增加,使细胞膜电位处于稳定静息电位水平,防止癫发作。从这一角度可以考虑为酮症的抗惊厥作用。(4)免疫相关异常,Peltola等[9]发 现,难 治 性 癫患者抗谷氨酸脱羧酶抗体(GADA)呈阳性,与1型糖尿病患者效价相似,说明二者存在某种联系,提示免疫功能异常很可能参与非酮症高血糖伴癫发作的发生。(5)近年研究显示,血-脑屏障破坏也是非酮症高血糖伴癫发作的重要机制[10],且与其他高血糖相关神经系统症状相关,如肌张力障碍、认知功能障碍等[11-12]。(6)非酮症高血糖伴部分性发作可能是由于长期高血糖引起局部血管异常、缺血,或不同部位神经细胞对高血糖、高渗透压的敏感性和耐受性不同[13]。
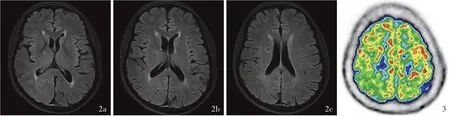
图2 头部横断面FLAIR成像(2021年8月24日)显示,右侧基底节区腔隙性梗死灶 2a,2b基底节区层面 2c放射冠层面 图3 18F-FDG PET显示,右侧顶叶葡萄糖代谢略减低(右侧绿色区域所示)Figure 2 Brain axial FLAIR showed the lacunar focus in the right basal ganglia region Basal ganglia level(Panel 2a,2b).Radial coronal level(Panel 2c). Figur e 3 18F-FDG PET showed the metabolism of the right parietal lobe decreased slightly(green areas in the right indicate).
本例患者根据其发病年龄、病程、发作特点和频率,结合既往史和相关辅助检查等明确诊断为非酮症高血糖伴癫发作。该例患者中年发病,表现为单纯部分性发作且发作频繁,入院后LT-VEEG监测到反复刻板发作,发作期脑电起始节律支持局灶性发作,由于发作迅速且短暂样放电快速传导至对侧引起脑电图改变,完善影像学检查无结构性病变和脑血管病相关病灶,18F-FDG PET显示右侧顶叶葡萄糖代谢略减低,考虑为频繁发作致左侧代谢略高所致,实验室脑脊液检查未提示中枢神经系统感染、免疫性脑炎和神经变性病相关线索,结合首次发作时间和既往史,考虑为血糖相关癫发作。入院后血糖控制过程也体现出癫发作与血糖的相关性。
治疗方面,基本治疗原则主要为尽早采取有效方法控制血糖[17]和补液等,同时密切监测血糖,纠正水电解质紊乱[18-19]。然而,抗癫药物对此类发作疗效较差,即使应用足量仍无法控制发作,且有些药物如苯妥英钠、地西泮等,通过诱导胰岛素抵抗和影响离子通道等机制还可加重癫症状,故选择药物时应考虑此种情况。此外,还应对确诊为糖尿病的患者加强健康宣教,指导其坚持服用降糖药、清淡饮食、保持积极心态,避免因血糖波动过大导致癫发作[20],提高治疗效果。血糖控制后无需长期抗癫治疗。
综上所述,本文报告1例非酮症高血糖致单纯部分性发作患者,严重影响日常生活、降低生活质量,应早期识别这一临床综合征,及时予以有效降糖治疗,避免不必要的病因检查,对患者预后至关重要。
利益冲突无

