中华按蚊气味结合蛋白AsinOBP2的基因克隆、表达谱及与人体气味物质的结合特性分析
张嘉俊, 何兴菲, 张婷婷, 司风玲, 陈 斌, 何正波
(重庆师范大学昆虫与分子生物学研究所, 媒介昆虫重庆市重点实验室, 重庆 401331)
吸食人血及传播疾病的蚊虫主要是按蚊属Anopheles、伊蚊属Aedes、曼蚊属Mansonia和库蚊属Culex的部分种类(陆宝麟, 2000)。蚊虫的吸血行为不仅骚扰、叮咬人畜,还传播多种疾病,包括疟疾、登革热、西尼罗河病毒、基孔肯亚热、黄热病等,严重威胁着人类的健康(Caraballo and King, 2014)。感知和定位宿主是蚊虫吸血行为中的关键环节,已有研究表明蚊虫通过嗅觉、视觉、湿度和温度等刺激来追寻宿主(Bar-Zeevetal., 1977; Bidlingmayer, 1994; Bernieretal., 1999, 2000; Chenetal., 2019)。其中,通过嗅系统觉感知宿主散发出的气味物质,进而顺着气味源搜寻宿主,是蚊虫定位宿主的主要方式(Bernieretal., 1999)。蚊虫的嗅觉系统包含多种与嗅觉相关的功能蛋白,如气味结合蛋白(odorant binding proteins, OBPs)、化学感受蛋白(chemosensory proteins, CSPs)、气味受体(odorant receptors, ORs)和离子型受体(ionotropic receptors, IRs)等(Leal, 2013)。气味结合蛋白是昆虫感知外界环境的基础(Pelosietal., 2006),能够选择性地结合并将环境中的气味分子通过感器淋巴液运输至位于嗅觉感觉神经元(olfactory sensory neurons, OSNs)膜上的ORs(王桂荣等, 2004)。
在长期的进化过程中,蚊虫对宿主的偏好有明显的分化,比如冈比亚按蚊Anophelesgambiae、埃及伊蚊Aedesaegypti嗜吸人血,而中华按蚊Anophelessinensis则兼吸人、畜血液。已有研究表明,宿主气味物质的种类和含量差异是造成蚊虫宿主偏好的重要原因之一(Patesetal., 2001; Qiuetal., 2006a; Omranietal., 2010; Verhulstetal., 2016)。通过气相色谱-质谱联用仪(GC/MS)鉴定人体气味物质,发现人体不同部位气味物质的数量和种类存在差异(吴德华等, 2003a, 2003b; 代勇等, 2009)。Bernier等(2000)采用GC/MS对人体皮肤气味物质进行分析,共鉴定出277种成分,包括羧酸类、醇类、醛类、酰胺/胺类、酯类、卤化物类、酮类、硫化物、卤化物、硫酯类、杂环类、脂肪族化合物和芳香族类化合物等。通过行为和电生理测定,这些人体气味物质中的一些组分在一定的剂量下能够引起蚊虫产生较强的电生理反应,并表现出引诱或驱避的效果(Mboeraetal., 1998; Purietal., 2006; Cooperbandetal., 2008; Seenivasaganetal., 2013; Guhaetal., 2014; Chenetal., 2019)。比如,在Y型管引诱实验中,乳酸显著吸引埃及伊蚊(Geier and Boeckh, 1999),3-甲基-1-丁醇会显著吸引冈比亚按蚊(Verhulstetal., 2011; Zohdyetal., 2015),辛酸和吲哚在一定浓度下也呈现出对蚊虫的引诱作用(余静等, 2012)。致倦库蚊Culexquinquefasciatus雌蚊对人体皮肤挥发物质的触角电位和行为反应测定发现,C3-C13的羧酸均会在一定剂量下引起致倦库蚊产生EAG反应,而C14-C18的羧酸不能引起EAG反应,C3, C6, C7, C8, C9, C11, C13和C14的羧酸能对雌蚊有吸引作用;丙三醇、乙二醇、苯甲醇、胆固醇、苯酚、正癸醇、苯甲醛、正庚醛、正丙醛和正壬醛均能引起显著的EAG反应,其中乙二醇、苯甲醇、胆固醇、正癸醇、正庚醛、正丙醛和正壬醛均有吸引作用(Purietal., 2006)。通过这些研究,证实人体气味物质通过蚊虫的嗅觉系统影响蚊虫的宿主搜寻行为。有些人体气味物质,例如辛醇还被进一步开发成引诱剂,用于蚊虫种群监测或防治(Bonvechio, 1991; Bernieretal., 1999, 2000; Smallegangeetal., 2010)。因此,深入研究宿主气味物质与蚊虫的互作关系有助于揭示蚊虫追寻宿主的机制,开发新型蚊虫引诱剂或驱避剂。
中华按蚊隶属于双翅目(Diptera)蚊科(Culicidae),是中国广大平原地区传播疟疾的重要媒介,也是中国和亚洲东南部其他国家传播丝虫病的媒介之一(Zmuanpuiietal., 2014)。对于中华按蚊嗅觉系统的研究,有助于减少蚊虫与人类宿主的接触,防止传染病的传播,也可为基于嗅觉的行为调控提供理论依据。在前期研究中,从中华按蚊基因组数据中共鉴定了64个气味结合蛋白基因,分属于Classic, Plus-C和Atypical 3个亚家族(Heetal., 2016);从中华按蚊不同组织的转录组数据中发现,AsinOBP1,AsinOBP2,AsinOBP7,AsinOBP66等基因在雌蚊触角中富集表达,通过CRISPR/Cas9技术突变AsinOBP1基因,蚊虫对宿主的追寻能力下降,吸血受到影响(数据未发表)。这些前期的研究结果暗示这些在雌蚊触角高表达的OBP基因可能在追寻宿主中起着重要的作用。本研究在前期研究基础上,利用qPCR研究了AsinOBP2基因在中华按蚊不同发育时期、成虫不同组织及吸血前后的表达水平,通过构建原核表达系统、Ni离子亲和层析技术获得了较高纯度的重组蛋白,利用荧光竞争结合实验测试了重组蛋白与39种人体气味物质的结合特性,为进一步探究AsinOBP2在中华按蚊嗅觉系统和追寻宿主中的功能奠定了基础。
1 材料与方法
1.1 供试昆虫
实验用中华按蚊种群饲养于重庆师范大学昆虫与分子生物学研究所,自交保种已超过30代。幼虫用鱼饲料饲养于清水中,待其化蛹后挑出放于塑料小桶中等待羽化。成蚊用10%葡萄糖水饲养,羽化后第3天用麻醉的小鼠喂血,供繁殖传代。蚊虫饲养条件:温度27±1℃,相对湿度75%±5%,光周期12L∶12D。
1.2 试剂
Trizol购自Ambion公司,反转录试剂盒RevertAid First Strand cDNA Synthesis Kit购自Thermo公司,3′RACE试剂盒3′RACE System for Rapid Amplification of cDNA Ends购自Invitrogen公司,2×Pro Taq Master Mix、凝胶回收试剂盒、质粒提取试剂盒和DNA提取试剂盒购自康维世纪生物科技有限公司,SYBR Premix ExTaq、限制性核酸内切酶、DNA连接酶、ExTaq DNA聚合酶购自TaKaRa公司,克隆试剂盒pEASY®-Blunt Zero Cloning Kit购自北京全式金生物技术有限公司,表达感受态Rosetta(DE3)菌株购自上海唯地生物科技有限公司,1-NPN荧光探针购自Sigma公司,气味标样购自Macklin公司。
1.3 总RNA提取及cDNA合成
收集中华按蚊3日龄雌、雄成虫触角(各100头,约200根触角)、喙(各100根)和下颚须(各100头,约200根下颚须);收集中华按蚊雌雄蛹、刚羽化成蚊以及羽化后第1, 2, 3, 6和9天成蚊各3头;收集取吸血前和吸血后12, 24和48 h的3日龄雌成蚊以及同时期未吸血雌成蚊(对照)各3头。以上为各种样品的一个生物学重复。参照RNA提取试剂说明书提取总RNA,用核酸蛋白浓度测定仪(NanoDrop ND-1000)检测总RNA浓度及纯度,1.0%琼脂糖凝胶电泳检测RNA的完整性。利用DNase I除去总RNA中的基因组DNA后反转录合成cDNA第1链,-80℃保存备用。
1.4 AsinOBP2基因克隆和生物信息学分析
根据已鉴定的AsinOBP2基因序列(Heetal., 2016),设计特异性引物用于AsinOBP2基因编码序列的验证和3′端非编码序列的克隆,引物序列见表1。 以中华按蚊雌虫触角cDNA为模板扩增AsinOBP2基因编码序列。PCR反应体系(25 μL): cDNA模板1 μL, 正反向引物(10 μmol/L)各1 μL, 2×Pro Taq Master Mix 12.5 μL, 去离子水9.5 μL。PCR反应程序: 95℃预变性5 min; 95℃ 30 s, 58℃ 30 s, 72℃ 30 s, 35个循环; 72℃延申5 min, 12℃保存。3′端非编码序列的扩增参照RACE试剂盒说明书,进行两轮巢式PCR,反应体系: 中华按蚊雌虫触角cDNA模板1 μL, 引物各1 μL, ExTaq酶12.5 μL, 去离子水9.5 μL,混匀离心后进行PCR扩增,首轮PCR产物稀释20倍取1 μL作为第二轮PCR的模板。反应程序: 95℃预变性5 min; 95℃ 30 s, 56℃ 30 s, 72℃ 30 s, 35个循环; 72℃延伸2 min。用1.5%琼脂糖凝胶电泳检测PCR产物,将符合预期大小的DNA片段切胶回收,克隆后送上海生工生物工程技术服务有限公司测序。

表1 本研究所用引物
用DNAMAN 4.0软件拼接AsinOBP2基因的测序片段,组装成为全长的cDNA序列。 用AsinOBP2基因cDNA序列在VectorBase进行在线比对(https:∥www.vectorbase.org/blast),提取中华按蚊基因组序列,用GENSCAN预测基因,分析内含子、外显子结构(https:∥genes.mit. edu/ GENSCAN.html)。用在线软件(http:∥www.Expasy.org/compute_pi/)对蛋白质的分子量和等电点等基本物理形状进行分析预测,蛋白质结构域采用SAMART软件进行分析(http:∥ smart.embl-heidelberg.de/),信号肽分析采用SignalP 5.0 Server软件(http:∥www.cbs.dtu.dk/ services/SignalP/)。分别以AsinOBP2基因的核酸和蛋白质序列为询问序列,在VectorBase搜索同源序列,使用MEGA4.0软件中的邻接(neighbor-joining, NJ)法构建系统发育树,分支节点支持率采用1 000次重复抽样进行氨基酸序列聚类分析。
1.5 AsinOBP2基因在中华按蚊不同发育时期、不同组织及吸血前后雌成蚊中的表达分析
以中华按蚊RibosomalproteinS7(Rps7)基因(Unigene23940_5,见中华按蚊转录组数据GBEO01000000)为内参基因,利用CFX-96实时荧光定量PCR仪(Bio-Rad)检测AsinOBP2基因的表达量,定量PCR引物见表1,反应体系(20 μL): SYBR Premix ExTaq 10 μL, cDNA模板 1 μL, 正反向引物(10 μmol/L)各0.8 μL, ddH2O 7.4 μL。反应程序: 95℃预变性3 min; 95℃ 10 s, 60℃ 30 s, 72℃30 s, 共40个循环;最后在60℃~95℃记录熔解曲线。各时期个体或组织样品以1.3节合成的cDNA作cDNA模板。每种样品设3个生物学重复,每样品重复测定3次。利用2-ΔΔCt法计算目的基因的相对表达量。
1.6 AsinOBP2基因的原核表达与纯化
以中华按蚊雌虫触角cDNA为模板,利用带有酶切位点的特异性引物(表1)扩增AsinOBP2基因的全长编码序列,将扩增产物纯化回收后连接至克隆载体(pEASY®-Blunt Zero Cloning Vector)并转化至感受态细胞,挑选阳性克隆,震荡培养后提取质粒DNA测序验证。 将AsinOBP2克隆载体和pET-28a(+)质粒DNA用限制性内切酶BamH I和HindⅢ在37℃酶切4 h,纯化回收后在T4 DNA连接酶的作用下将目的片段连接到表达载体pET-28a(+)上。最后将重组表达质粒转化到Rosetta(DE3)感受态细胞,涂板培养后,挑单菌落接种于LB培养液中过夜震荡培养(37℃ 200 r/min)。将小量培养后的菌液按1∶100(v/v)接种至500 mL含50 μg/mL卡那霉素的LB液体培养基中,37℃ 220 r/min震荡培养至OD600=0.4~0.6时,加入终浓度为1 mmol/L的IPTG,30℃诱导表达2.5~3 h,收集菌体后用超声波进行破碎处理(500 W,45次,每次10 s,间隔10 s),4℃ 12 000×g离心30 min后分别收集上清和沉淀,SDS-PAGE检测蛋白的表达情况。参照Ni-Agarose His 标签蛋白纯化说明书进行亲和层析纯化蛋白,纯化后的重组蛋白置于-80℃保存备用。
1.7 荧光竞争结合实验
采用荧光竞争结合实验测定AsinOBP2与39种人体气味物质(表2)的结合能力。荧光竞争结合实验使用HITACHI公司的F-2500型荧光分光光度计进行,所用容器为1 cm宽的石英杯,狭缝宽度为10 nm。将荧光探针1-NPN溶于甲醇,终浓度为1 mmol/L。在测定荧光探针与AsinOBP2的结合常数时,设定激发光波长为337 nm,扫描的发射光波长为390~500 nm。向石英杯中加入50 mmol/L的Tris Buffer(pH 7.4),然后加入AsinOBP2蛋白,使其终浓度为2 μmol /L,充分混匀并静置2 min后扫描并记录发射光谱。随后加入1-NPN溶液,使1-NPN终浓度依次从2~16 μmol /L,浓度梯度每次增加2 μmol /L。每组实验重复3次,利用Scatchard方程计算AsinOBP2 /1-NPN的结合常数。测定气味物质与AsinOBP2的结合常数时,首先配制气味标样,将各种气味标样溶于甲醇溶液,使其终浓度为1 mmol/L,放在4℃冰箱备用,然后在石英杯中加入50 mmol/L的Tris Buffer(pH 7.4),然后加入荧光探针1-NPN及AsinOBP2蛋白,使其终浓度为2 μmol/L。随后加入1 mmol/L的气味物质,气味物质终浓度为10, 20, 30, 40, 50, 60和70 μmol/L的梯度加入到荧光探针1-NPN与AsinOBP2蛋白混合溶液中,记录最大的荧光强度值,每个样品3次重复。假设蛋白活性为100%,在饱和情况下蛋白和配基结合的比例为1∶1,根据公式Ki=[IC50]/(1+[1-NPN]/K1-NPN)计算蛋白与气味配体的解离常数Ki,其中IC50为气味配体使荧光值降低到初始荧光值一半时的浓度(配基能替换50% 的1-NPN时的浓度),[1-NPN]为未结合的1-NPN浓度,K1-NPN为AsinOBP2与1-NPN的解离常数。
1.8 数据分析
目的基因在成虫不同部位和不同时期的表达量差异用单因素方差分析(Turkey氏检验)进行检验,在雌雄间及吸血与未吸血间的表达量差异用独立样本t检验(independent samplest-test)进行检验,以P<0.05为差异显著。
2 结果
2.1 AsinOBP2基因克隆与序列特征
AsinOBP2的编码序列扩增和3′RACE扩增均得到一个单一的条带。测序后进行序列拼接,获得AsinOBP2基因全长的cDNA序列,其开放阅读框长492 bp,编码163个氨基酸,3′端非编码区186 bp,预测等电点为5.18,分子量为18.8 kD。将AsinOBP2基因cDNA序列比回到基因组序列,得到AsinOBP2的基因结构(GenBank登录号: MT700441),包含2个外显子和1个内含子,外显子1长474 bp,外显子2长204 bp,内含子长80 bp。利用SignalP 5.0 Server进行信号肽预测,N端疏水区包含由起始位置开始的30个氨基酸组成的信号肽,推测AsinOBP2为分泌型蛋白。序列比对分析发现AsinOBP2有一个保守的PhBP结构域(第59-156位氨基酸,E=4.77e-20)。
将AsinOBP2氨基酸序列与其他按蚊属蚊虫的OBP2进行多序列比对发现,AsinOBP2具有气味结合蛋白的典型特征,含有6个高度保守的半胱氨酸残基, 属于Classic亚家族(图1)。同源性分析显示AsinOBP2与与冈比亚按蚊OBP2、黑小按蚊AnophelesatroparvusOBP2、白魔按蚊An.albimanusOBP2和致倦库蚊OBP2的氨基酸序列一致性分别为70.2%, 63.6%, 59.7%和51.7%。系统进化树显示,AsinOBP2与白魔按蚊和黑小按蚊的OBP2聚类到独立的Classic OBP进化枝(图2),表明它们在进化上关系更密切。

图1 中华按蚊AsinOBP2与其他蚊虫OBP2蛋白的氨基酸序列比对
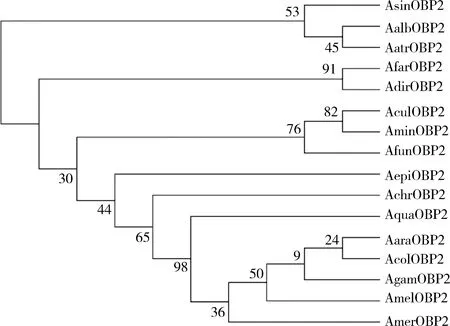
图2 邻接法构建的基于氨基酸序列的中华按蚊AsinOBP2与其他昆虫OBPs的系统发育树(1 000次重复)
2.2 AsinOBP2的时空表达谱
qPCR结果显示,AsinOBP2在雌、雄蛹中几乎没有表达;在雄成虫中始终维持较低的表达水平,而在雌成虫中的表达水平逐渐增强,羽化后第6天达到最高,随后下降;在刚羽化和羽化后第1天的雌、雄成虫之间表达差异不显著(P>0.05),羽化第2-6天在雌成虫中的表达水平显著高于在雄成虫中的(P<0.05)(图3: A),羽化后第2, 3和6天雌虫的表达量分别是雄成虫的6.45, 3.49和6.61倍。AsinOBP2主要在3日龄成虫触角中表达,在雌、雄成虫触角中的表达水平均显著高于在下颚须和喙中的(P<0.05)(图3: B);AsinOBP2在雌成虫触角中的表达量分别是在喙和下颚须中的43.1倍和155.1倍,在雄成虫触角中的表达量分别是在喙和下颚须中的4.1和142倍。AsinOBP2在吸血后的表达水平显著下调(图4),吸血后12, 24和48 h时对照组的表达量分别是吸血组的4.67, 7.53和65倍。
2.3 AsinOBP2的原核表达与纯化
将成功构建的原核表达载体pET-28a(+)/AsinOBP2转入宿主菌Rosetta(DE3),经IPTG诱导表达出目的蛋白。SDS-PAGE电泳结果显示目的蛋白主要以包涵体形式表达(图5: A),通过变性,纯化,透析复性后在21 kD左右处出现预期的单一条带(图5: B)。
2.4 AsinOBP2重组蛋白与人气味配体的结合能力
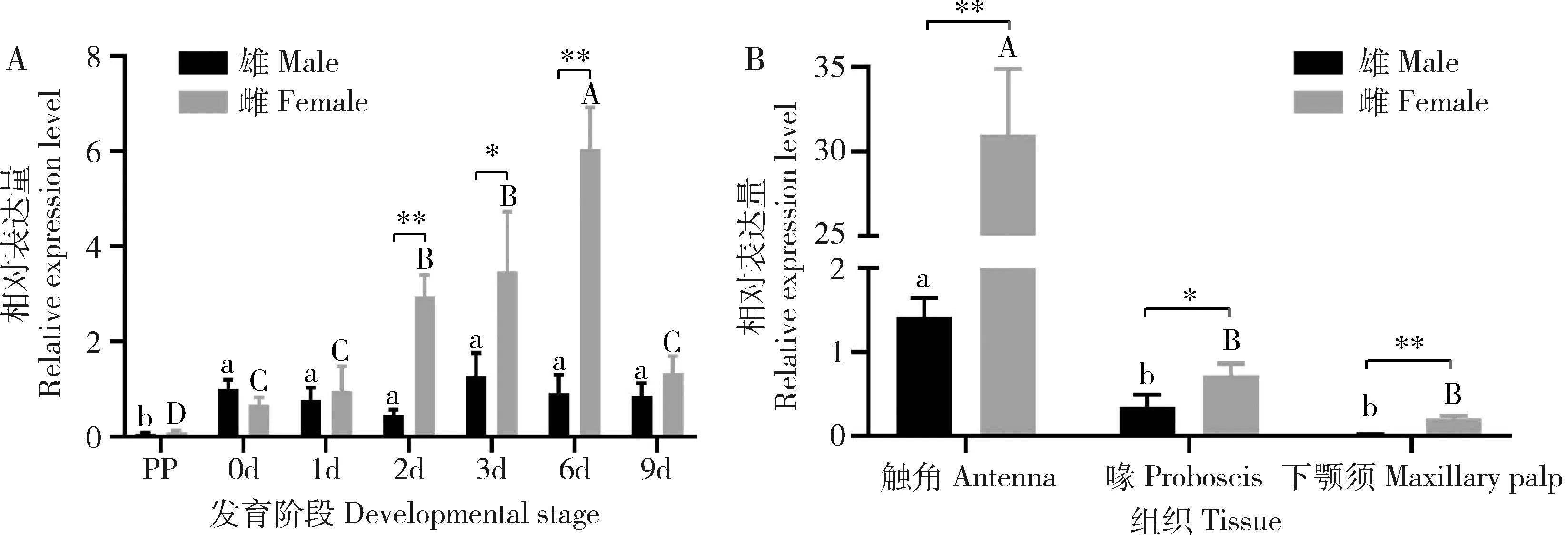
图3 AsinOBP2在中华按蚊不同发育时期(A)及3日龄成虫不同嗅觉组织中(B)的相对表达量

图4 AsinOBP2在中华按蚊羽化后3 d雌成虫吸血前后的相对表达量
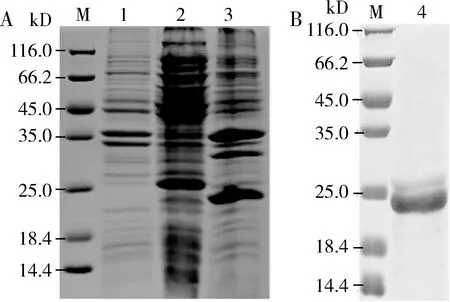
图5 AsinOBP2的表达(A)和纯化(B)的SDS-PAGE分析
重组蛋白AsinOBP2在337 nm激发光波长下自身无明显的内源荧光信号。向AsinOBP2重组蛋白中以2 μmol/L的浓度梯度加入1-NPN溶液,在410 nm进行扫描,荧光强度的增幅随加入1-NPN的浓度增加而逐渐增强,最终蛋白和1-NPN的结合达到饱和,通过Scachard方程对AsinOBP2与1-NPN的结合曲线进行线性化,计算出该蛋白与1-NPN的解离常数为8.310 μmol /L(图6)。AsinOBP2与人体气味物质的荧光竞争结合实验结果显示,在测定的39种气味物质中,仅有12种能将荧光探针1-NPN从重组AsinOBP2蛋白溶液中替换50%以上,说明AsinOBP2的气味结合谱较窄,具有选择性识别人体气味物质的特性(图7)。AsinOBP2与部分醛、醇、酸和杂环族化合物有结合活性,与吲哚结合能力最强,解离常数Ki=27.15 μmol/L;与正丙胺、2-甲基丁醛、葵醛具有一定结合能力,其解离常数Ki分别为42.49, 48.33和47.90 μmol /L;与3-甲基吲哚、己醛、正庚醛、正戊醛、正癸酸、对二甲苯、乙基苯和反式-2-己烯醇结合能力较弱(Ki>50 μmol /L),与其他28种气味分子不能结合(表2)。
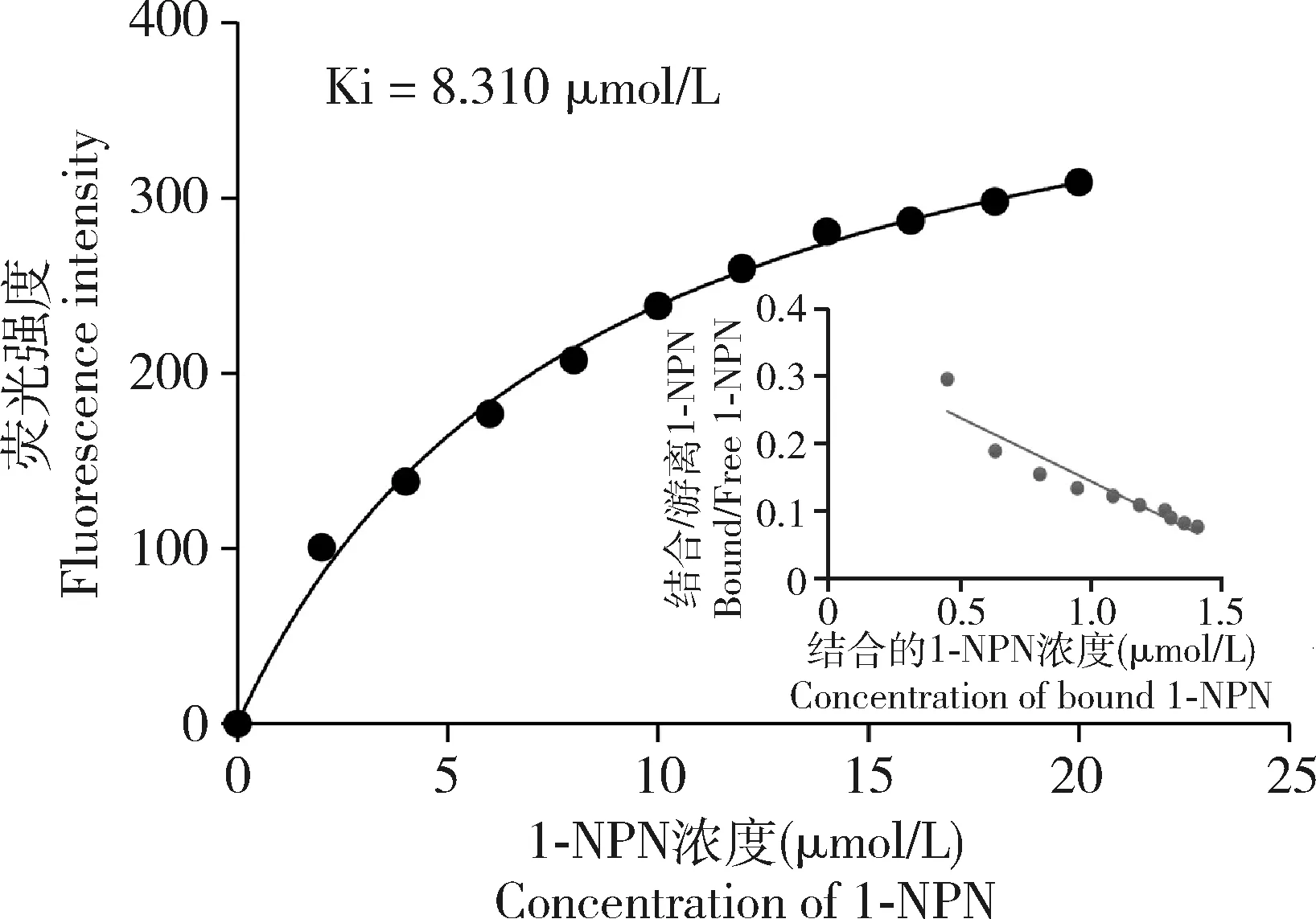
图6 AsinOBP2重组蛋白与1-NPN的结合曲线及斯卡查德方程
3 讨论
本研究qPCR分析发现,AsinOBP2在雌成虫触角中高表达(图3: B),与嗅觉组织的转录组分析结果一致(数据未提供);不同发育时期的定量分析显示,AsinOBP2在雌成虫中的表达水平显著高于雄成虫的,而且在羽化后呈上升表达趋势,在雄成虫中则始终维持在较低的表达水平(图3: A)。 与AsinOBP2直系同源的冈比亚按蚊OBP2基因(AgamOBP2)在雌成成虫中的表达水平高于雄成虫,主要在雌成虫头部高表达(Marinottietal., 2006);雌成虫AgamOBP2的表达水平在羽化后呈现上升趋势, 而在雄成虫中则维持稳定的低水平表达(Cook and Sinkins 2010),与AsinOBP2的表达模式一致。触角是昆虫最重要的嗅觉器官,AsinOBP2在雌成虫的触角中高表达,推测其与雌成虫的特异性行为有关,比如追寻宿主、吸血和寻找产卵场所等。AsinOBP2基因的表达水平在雌成虫吸血后显著下降(图4),与AsinOBP2基因直系同源的冈比亚按蚊AgamOBP2和致倦库蚊CquiOBP2在吸血后表达水平均显著下降 (Pintoetal., 2009; Tapariaetal., 2017),与蚊虫吸血后进入静息状态的行为相契合,说明AsinOBP2基因可能与追寻宿主有关。
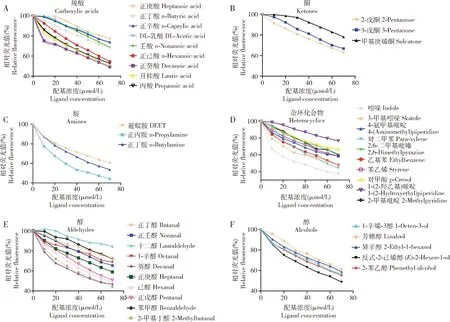
图7 人体气味物质分子和1-NPN与重组蛋白AsinOBP2的竞争结合
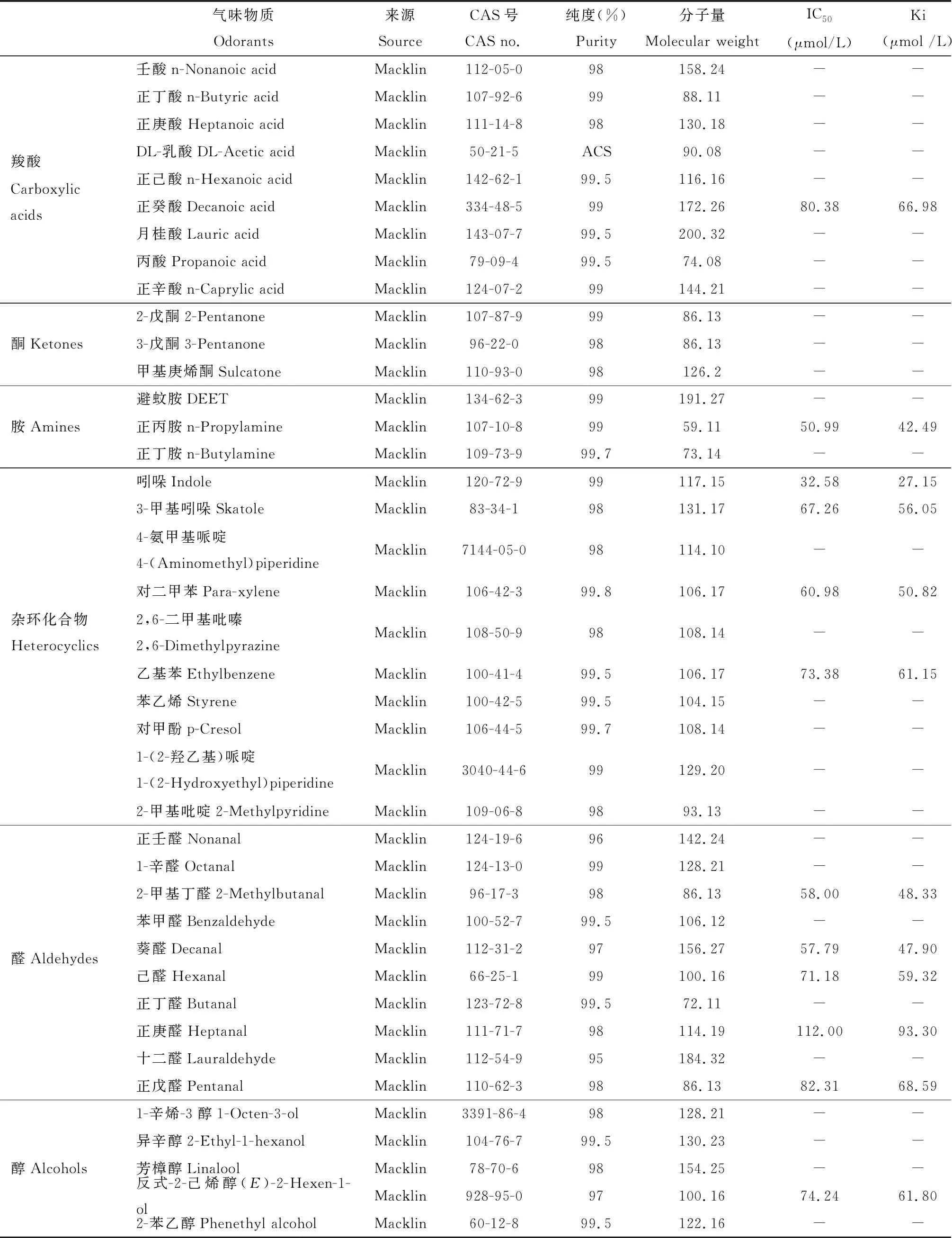
表2 重组蛋白AsinOBP2与人体气味物质的结合能力
为了进一步验证AsinOBP2基因的功能,对其进行了原核表达和与人体气味物质的结合特性分析。蚊虫通过嗅觉感知人体挥发物,进而逆向追踪。Bernier等(2000)采用GC/MS对人体皮肤挥发物进行分析,检测到了346个峰,鉴定出277种化合物。采用单感记录仪测定其中103种气味物质引起埃及伊蚊的电生理反应,结果显示89种物质能够引起明显的刺激或抑制反应(Chenetal., 2019)。根据Chen等(2019)的结果,选取了反应较强的39种人体气味物质,通过荧光竞争结合实验测定了AsinOBP2与这些物质的结合能力,结果显示12种气味物质能够将AsinOBP2/1-NPN复合体中的1-NPN竞争至50%以下(表2)。在12种结合的物质中,与吲哚的结合能力最强(Ki=27.15 μmol/L),与其余物质的结合能力较弱(Ki>40 μmol/L),说明AsinOBP2能够选择性地结合人体挥发物中的一些组分,在中华按蚊追寻宿主的过程中起着作用。本研究中人体气味物质的选择是依据埃及伊蚊电生理的结果,有可能导致与AsinOBP2亲和力更强的气味物质被人为地遗漏。因此,吲哚是不是人体挥发物中与AsinOBP2亲和力最强的天然配体,还有待进一步研究。扩大人体气味物质筛选的数量,将有可能筛选到与AsinOBP2亲和力更强的人体气体物质。
吲哚属于芳香族杂环有机化合物,人体表某些种类的细菌能够分解色氨酸产生吲哚,是人体挥发物中的主要组分(Elgaalietal., 2002),甚至可以占到汗液挥发物的30%以上。除AsinOBP2外,中华按蚊AsinOBP1(未发表数据)和冈比亚按蚊AgamOBP1也能结合吲哚(Biessmannetal., 2010; Dimitratosetal., 2019),说明吲哚可与多种气味结合蛋白结合。吲哚能引起冈比亚按蚊雌成蚊触角毛状感器的强烈电生理反应(Blackwell and Johnson 2000; Meijerinketal., 2000; Qiuetal., 2006b),并可以激活埃及伊蚊(Sijuetal., 2010)、致倦库蚊(Hilletal., 2009; Syed and Leal, 2009)和环跗库蚊Culextarsalis(Du and Millar, 1999)的嗅觉受体神经元。用RNAi方法抑制AgamOBP1基因的表达,冈比亚按蚊对吲哚的触角电位反应明显减弱(Biessmannetal., 2010);抑制致倦库蚊CquiOBP1表达,对吲哚的触角电位反应也显著减弱(Pelletieretal., 2010)。由此可见,蚊虫能够通过嗅觉系统感知人体挥发物中的吲哚,进而感知宿主;AsinOBP2基因可能是通过识别人体挥发物中的吲哚等气味物质,感知和追寻宿主。
致倦库蚊CquiOBP2蛋白的结合特性研究发现,CquiOBP2能结合3-甲基吲哚(skatole),不能结合吲哚(Yinetal., 2015)。AsinOBP2与CquiOBP2为直系同源基因,氨基酸序列一致性为51.7%,但AsinOBP2的结合特性与CquiOBP2相反,能够结合吲哚,而与3-甲基吲哚结合能力很弱(表2)。通过同源建模、分子对接和定点突变等方法比较研究这两个蛋白的结合特性和结构差异,将有助于揭示AsinOBP2结合配体的机制。除此之外,吲哚和3-甲基吲哚既是人体挥发物的主要组分,又是冈比亚按蚊和致倦库蚊典型的产卵刺激剂(Millaretal., 1992; Blackwell and Johnson, 2000)。AsinOBP2能够结合吲哚,是否说明AsinOBP2与雌蚊寻找产卵场所有关,还有待进一步研究。
本研究通过表达分析证实AsinOBP2在中华按蚊雌成虫触角中富集表达,在羽化后的雌成虫中表达水平逐渐增强,吸食血液后表达水平显著下降,而且AsinOBP2能够结合吲哚等人体气味物质,说明AsinOBP2在中华按蚊的嗅觉系统中起着重要的作用,可能与雌成虫追寻宿主有关。还需要通过RNAi或基因编辑、电生理、行为学和结构生物学等方法进一步研究该基因的功能,为基于AsinOBP2蛋白筛选引诱或驱避剂、或进行行为调控以减少蚊虫与人类接触的机会奠定基础。

