补肾强筋胶囊对膝骨关节炎的治疗作用及分子机制研究
彭莎 姚楠 卢岩岩 许学猛,2△ 吴淮,2 刘文刚,2 黄雪君 陈国材
膝骨关节炎(KOA)是一种以软骨退变为主要特征的骨退行性疾病,而软骨细胞自噬水平降低是软骨退变的主要原因[1-2]。维持软骨细胞一定的自噬水平可减缓软骨退变,是软骨细胞生存的重要方式[1-2]。目前中医药治疗KOA已受到广泛关注[3-4]。补肾强筋胶囊临床运用逾18 a,临床报道和实验研究均表明其对KOA具有一定的疗效[5-10]。本研究拟以KOA大鼠为研究对象,从软骨自噬角度探讨补肾强筋胶囊治疗KOA的作用机制,为补肾强筋胶囊临床治疗 KOA 提供实验依据。
1 材料与方法
1.1 实验动物
40只SPF级SD大鼠,雌雄各半,体质量180~220 g,购自广东省医学实验动物中心,生产许可证号为SCXK(粤)2018-0002。动物实验环境:广东省第二中医院(广东省中医药工程技术研究院)SPF级动物实验室,设施使用许可证号为SYXK(粤)2015-0059。
1.2 实验药物和试剂
补肾强筋胶囊(批准文号为粤药制字Z20071352,批号为20180801,药物组成:杜仲、补骨脂、骨碎补、熟地黄、血竭、全蝎等)由广东省第二中医院制剂室提供;木瓜蛋白酶(美国Sigma公司,批号为SLBR9817V);半胱氨酸(美国Sigma公司,批号为BCBN4306V);大鼠白细胞介素-1β(IL-1β)和肿瘤坏死因子-α(TNF-α)酶联免疫吸附测定(ELISA)试剂盒(天津安诺瑞康生物技术有限公司,批号分别为370180831,569181010);4%组织细胞固定液(北京鼎国昌盛生物技术有限责任公司,批号为893001335);Trigol试剂(北京鼎国昌盛生物技术有限责任公司,批号为99G00127);RevertAid Reverse Transcriptase(美国Thermo Fisher Scientific公司,批号为00366374);SYBR Premix Ex Taq Ⅱ (Tli RNaseH Plus)(大连宝生物工程有限公司,批号AHX0051N);ddH2O(北京天根生化科技有限公司,批号R6305);苏木精-伊红(HE)染液(广州优迪生物科技有限公司,批号为0314A20);番红染液和固绿染液(北京雷根生物技术有限公司,批号为1205A14);RIPA蛋白裂解液和蛋白酶磷酸酶抑制剂混合物(上海贝博生物公司,批号为BB18091);BCA蛋白定量分析试剂盒(美国Thermo Fisher Scientific公司,批号为SE248351);Super Signal®West Pico Chemiluminescent Substrate(美国Thermo Fisher Scientific公司,批号为QE217005);β-actin抗体(美国Proteintech公司,批号为00047970);MMP13抗体(美国Proteintech公司,批号为00018170);Beclin1抗体(美国Proteintech公司,批号为00018170);LC3B(美国Abcam公司,批号为GR319117-2);ULK1(美国Proteintech公司,批号为00070905);p-AMPK(T172)(美国Cell Signaling Technology公司,批号为14);p-mTOR(Ser2448)(美国Affinity Biosciences公司,批号为55y1643);辣根过氧化物酶标记羊抗兔IgG(美国Proteintech公司,批号为20000199)。
1.3 实验仪器
BX51荧光显微镜(日本Olympus公司);BSA224S电子分析天平(德国Sartorius公司);全配置病理分析仪器(德国Leica公司);5424型小型高速离心机(德国Eppendorf公司);702型-80 ℃超低温冰箱(美国Thermo Fisher Scientific公司);Varioskan Flash全波长多功能酶标仪(美国Thermo Fisher Scientific公司);Smart Spec Plus核酸蛋白测定仪(美国Bio-Rad公司);IQTM5荧光定量PCR仪(美国Bio-Rad公司);Tanon 5200 Multi多功能成像系统(上海天能科技有限公司)。
1.4 方法
1.4.1KOA模型 大鼠双侧膝关节腔内注射木瓜蛋白酶和半胱氨酸,注射剂量为每个膝关节腔50 μL,注射时间为第1、3、7天,4周后KOA造模成功。
1.4.2动物分组 40只SD大鼠按随机分组数字表法分为正常组、模型组、补肾高剂量组、补肾低剂量组,每组10只。除正常组外,其余三组大鼠复制KOA模型。
1.4.3动物给药和样本采集 补肾高、低剂量组按照人推荐剂量进行等效换算,分别给予0.486 g/kg及0.243 g/kg补肾强筋胶囊灌胃,正常组和模型组给予生理盐水灌胃。给药6周后,处死动物,收集大鼠血清用于ELISA检测;各组随机取4只大鼠双侧膝关节组织,放置于4%组织细胞固定液中固定,用于HE染色和番红-固绿染色以及改良Mankin评分;其余大鼠膝关节软骨组织保存于-80 ℃冰箱中,留待实时荧光定量聚合酶链式反应(PCR)和蛋白免疫印迹(Western Blot)检测。
1.4.4组织病理学检测 大鼠双侧膝关节软骨组织固定72 h,脱钙处理,石蜡包埋,切薄片,脱蜡,HE或番红-固绿染色,乙醇梯度脱水,二甲苯透明,最后用中性树脂封片。光镜下观察各组大鼠膝关节软骨病理改变情况,并进行改良Mankin评分定量评估软骨损伤情况。
1.4.5ELISA检测 按照试剂盒说明书要求,使用多功能酶标仪在450 nm波长下测定标准品各孔的吸光度。以标准品浓度作为横坐标,各孔检测的吸光度值作为纵坐标绘制标准曲线,按照标准曲线方程式计算各组大鼠血清样品IL-1β和TNF-α水平。
1.4.6实时定量PCR检测 从冰箱中取出冻存的大鼠软骨组织剪碎,液氮研磨至细颗粒状,采用Trigol裂解并加入氯仿震荡后离心,取最上层上清液,加入等体积的异丙醇,充分混匀静置30 min后离心,弃上清。加入75%乙醇冲洗沉淀,离心弃上清,离心管开盖静置,待残留的乙醇完全挥发,沉淀变为无色凝胶状时加入ddH2O溶解,即为总RNA。总RNA浓度和纯度采用核酸蛋白测定仪测定。总RNA经反转录后合成cDNA。将ddH2O 9.5 μL,相关前引物F和后引物R(终浓度均是1 μmol/L)各1 μL,cDNA 1 μL,SYBR Premix Ex Taq Ⅱ (Tli RNaseH Plus) 12.5 μL混合后共25 μL体系放入定量PCR仪进行扩增。扩增反应完成后分析产物熔解曲线。以18S作为内参,采用2-△△Ct的方法计算各组基因相对表达量。所有引物均由上海英潍捷基贸易有限公司合成,引物信息如表1所示。

表1 相关基因的引物信息
1.4.7Western Blot检测 从冰箱中取出冻存的大鼠软骨组织剪碎,液氮研磨至细颗粒状,加入PIPA蛋白裂解液与蛋白酶磷酸酶抑制剂混合物处理后,震荡,离心,取上清。采用BCA蛋白定量测定试剂盒测定蛋白浓度,经SDS-PAGE电泳及电转移至PVDF膜后,用8%牛奶封闭膜1.5 h,加入蛋白一抗抗体 4 ℃过夜,第二天回收一抗抗体,Western洗涤液洗4次后加入辣根过氧化物酶标记羊抗兔IgG孵育膜1.5 h,Western洗涤液洗4次。将膜置于显影液中反应1 min,在成像系统中进行发光显影、拍照,最后采用Image J软件进行条带灰度值分析。
1.5 统计学方法

2 结果
2.1 补肾强筋胶囊对KOA大鼠膝关节软骨病理变化的影响
正常组大鼠膝关节软骨表面光滑,无裂隙,软骨细胞排列规则,大小均匀,层次分明,基质染色正常,有完整的潮线存在;模型组大鼠软骨表面粗糙,软骨层变薄,有不规则裂隙,细胞数明显减少,基质染色减少,潮线大量破坏;补肾高剂量组和低剂量组大鼠软骨表面基本光滑,偶有裂隙,细胞数有所减少,基质染色轻度减退,细胞排列相对整齐,潮线有所残缺(见图1-图2)。改良Mankin评分结果表明与正常组相比,模型组Mankin评分显著升高,差异有统计学意义(P<0.01);补肾高剂量组和低剂量组Mankin评分显著低于模型组,差异有统计学意义(P<0.01),见图3。
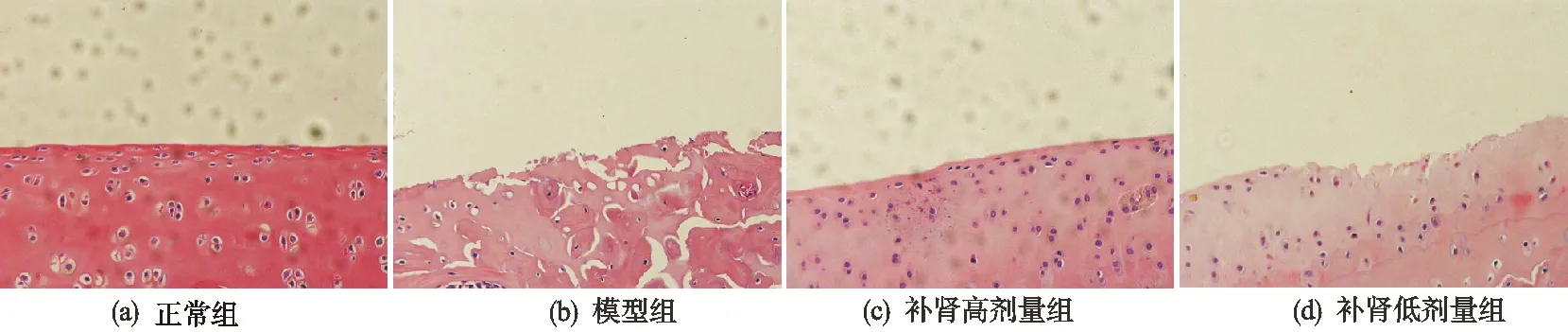
图1 各组大鼠关节软骨HE染色(×200)

图2 各组大鼠关节软骨番红-固绿染色(×100)

图3 各组大鼠膝关节软骨Mankin评分
2.2 补肾强筋胶囊对KOA大鼠血清IL-1β和TNF-α水平的影响
如图4所示,与正常组相比,模型组大鼠血清IL-1β和TNF-α水平显著升高,差异有统计学意义(P<0.01);与模型组相比,补肾高剂量组和低剂量组IL-1β和TNF-α水平显著降低,差异有统计学意义(P<0.01)。
2.3 补肾强筋胶囊对KOA大鼠关节软骨MMP13、Beclin1、LC3B、ULK1 mRNA表达的影响
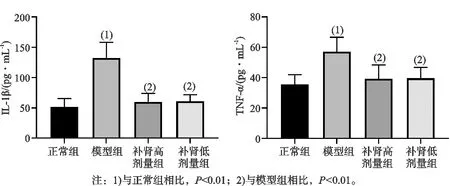
图4 各组大鼠血清IL-1β和TNF-α的水平
如图5所示,与正常组相比,模型组MMP13 mRNA表达水平显著升高,差异有统计学意义(P<0.01),Beclin1、LC3B、ULK1 mRNA表达水平显著降低,差异有统计学意义(P<0.01);与模型组相比,补肾高剂量组和低剂量组MMP13 mRNA表达水平显著降低,差异有统计学意义(P<0.01),Beclin1、LC3B、ULK1 mRNA表达水平显著升高,差异有统计学意义(P<0.01)。
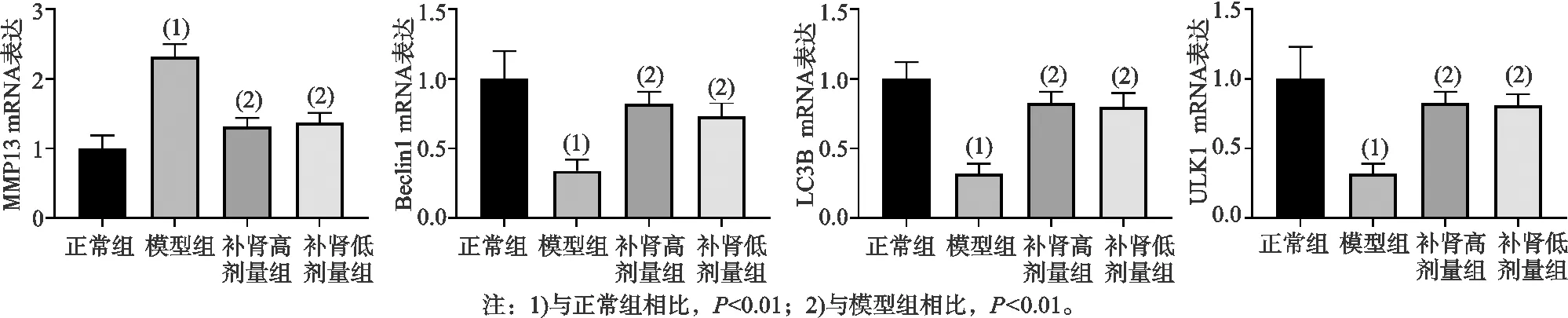
图5 各组大鼠软骨相关mRNA的相对表达
2.4 补肾强筋胶囊对KOA大鼠关节软骨MMP13、Beclin1、LC3B-Ⅱ/Ⅰ、ULK1、p-AMPK、p-mTOR蛋白表达的影响
如图6所示,与正常组相比,模型组MMP13和p-mTOR蛋白表达水平显著升高,差异有统计学意义(P<0.01),Beclin1、LC3B-Ⅱ/Ⅰ、p-AMPK、ULK1 蛋白表达水平显著降低,差异有统计学意义(P<0.01);与模型组相比,补肾高剂量组和低剂量组MMP13和p-mTOR蛋白表达水平显著降低,Beclin1、LC3B-Ⅱ/Ⅰ、ULK1蛋白表达水平显著升高,补肾高剂量组p-AMPK蛋白表达水平显著升高,差异有统计学意义(P<0.01)。
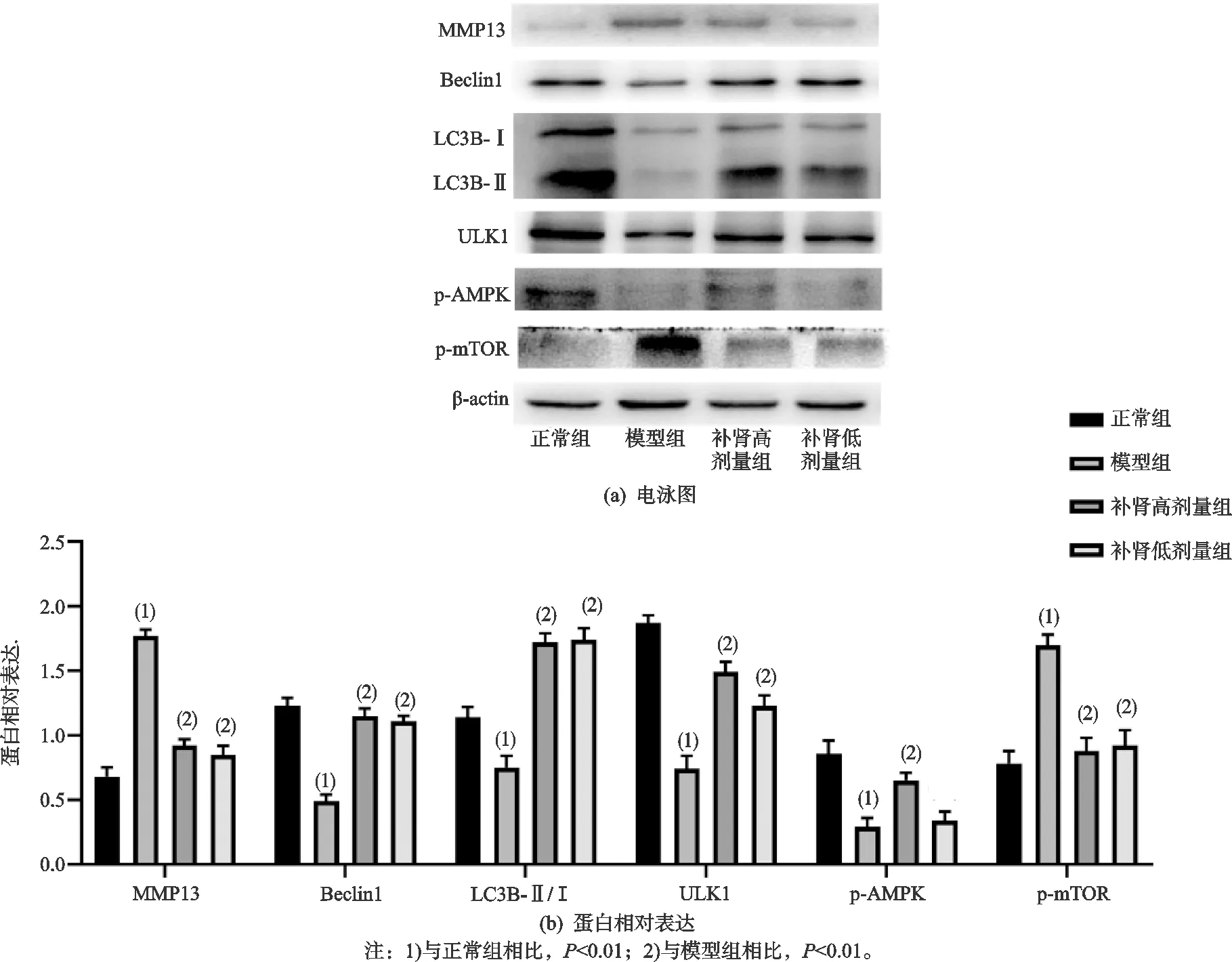
图6 各组大鼠软骨相关蛋白的相对表达
3 讨论
KOA的临床表现主要以膝关节进行性疼痛、关节不稳定为特征,属于中医“骨痹”范畴,《素问·长刺论》中记载:“骨痹病,其病在于肾。骨重而不可举,骨髓可见酸痛症状,故名曰骨痹。”其病机特点多为“肾虚血瘀”“肾虚络阻”,当以“补肾活血法”治疗。广东省第二中医院院内制剂补肾强筋胶囊以杜仲、补骨脂、骨碎补、熟地黄四药补肝肾共为君药,血竭活血通络为臣药,全蝎祛风除湿、通络止痛为佐药,六药合用具有强筋壮骨、活血通络之功效。前期的临床报道和实验研究表明其治疗KOA疗效良好[5-10],但其作用机制还未阐明。
本研究通过关节腔注射木瓜蛋白酶复制KOA大鼠模型,6周后染色结果显示模型组大鼠软骨关节面不平整,关节软骨大面积消失,细胞数明显减少,介于正常关节软骨和钙化软骨之间的潮线结构被严重破坏,其Mankin评分也明显高于正常组。经补肾强筋胶囊高、低剂量治疗后,KOA大鼠的软骨结构更为完整,软骨表面形态受损较轻,Mankin评分也明显降低。病理观察的结果表明补肾强筋胶囊明显改善了KOA大鼠关节软骨病变程度。KOA发病过程伴随着促炎因子表达的增加[11],软骨细胞分泌的促炎因子IL-1β和TNF-α可以增加MMP13的表达,从而导致软骨细胞外基质降解加剧,促进软骨退变[12-13]。研究发现补肾强筋胶囊降低了促炎因子IL-1β和TNF-α的水平,并且通过抑制MMP13表达减缓了软骨细胞外基质的分解代谢。
另一方面,这些促炎因子也具有抑制细胞自噬水平的作用[14]。细胞自噬是真核生物中一种进化保守的溶酶体降解途径,软骨细胞自噬可以为软骨细胞的再生、修复提供原料,维持软骨细胞稳态[15]。自噬体的形成是自噬过程的必要条件。哺乳动物的自噬关键基因包括ULK1、Beclin1和LC3B。ULK1处于自噬信号通路中最上游的位置,被认为是自噬的主要调控因子,在细胞自噬过程中发挥重要作用,招募其他 Atg 蛋白形成自噬体[16]。ULK1激酶失活则会抑制自噬发生。Beclin1是自噬重要的正向调节因子,其表达与自噬水平呈正相关,参与调控自噬体的形成和成熟[17]。LC3B为自噬过程中重要的蛋白分子,并且是自噬标志物,有LC3B-Ⅰ 和LC3B-Ⅱ两种存在形式,主要参与自噬体的形成[18]。自噬发生时,LC3B-Ⅰ会转化成LC3B-Ⅱ,因此LC3B-Ⅱ/Ⅰ蛋白表达量比值可以用来评估细胞自噬水平。在KOA发病过程中,由于软骨细胞正常的自噬水平受到促炎因子的抑制,导致软骨细胞内功能紊乱和受损的细胞器和大分子物质等有害物质无法及时清除,破坏了软骨细胞的稳态,从而加剧了关节软骨退变[19]。
已有研究表明药物抑制mTOR以及软骨特异性敲除mTOR都可以减轻小鼠KOA的病变程度,抑制mTOR信号通路导致软骨细胞的自噬增加,最终起到缓解KOA的作用[14,20]。腺苷酸活化蛋白激酶(AMPK)是细胞主要的能量感受器[21],AMPK相关基因敲除后可加重小鼠KOA的病变程度[22]。并且有研究表明 AMPK信号通路也参与了KOA的软骨代谢过程,在KOA患者的软骨组织和IL-1或TNF-α处理的人软骨细胞中均观察到AMPK活性的降低[23]。活化的 AMPK能够抑制mTOR的活性,导致mTOR对ULK1的抑制作用减弱,ULK1表达增强,提高细胞自噬水平。当前,广大研究者开始关注AMPK/mTOR通路在软骨细胞自噬中扮演的角色。
本研究中关于软骨细胞自噬的结果和Li等报道的结果一致[24],实验中复制的木瓜蛋白酶诱导的KOA模型大鼠软骨自噬相关ULK1、Beclin1、LC3B-Ⅱ/Ⅰ表达均明显下降,表明在此KOA模型下存在促炎因子引起的细胞自噬水平下降。研究还发现p-AMPK蛋白表达明显降低,p-mTOR蛋白表达明显上升,表明当前KOA大鼠软骨自噬水平降低的状态与AMPK/mTOR通路有关。补肾强筋胶囊显著提高了p-AMPK蛋白表达水平,降低了p-mTOR蛋白表达水平,表明AMPK活性增强,mTOR活性减弱,mTOR信号通路受到抑制。在此情况下,补肾强筋胶囊显著提高了ULK1和Beclin1基因和蛋白表达,并且显著提高了LC3B-Ⅱ/Ⅰ蛋白比值,充分说明其激活了软骨细胞自噬。
综上所述,本研究表明补肾强筋胶囊通过AMPK/mTOR通路调节软骨细胞自噬是其有效治疗KOA的机制之一。然而补肾强筋胶囊是否通过其他信号通路调控自噬以及该方中调控自噬有效成分的确认还有待进一步研究。

