基于偶氮配体的一类配位不饱和建筑块分子的合成、结构和荧光性质研究
张广威,张 齐,李双双,王 鹏
(山东科技大学 化学与生物工程学院,山东 青岛 266590)
羧酸类有机物被广泛应用于各种配位反应。羧酸类配体有两个显著的特征:一是可以比较容易地与金属离子配位,二是与金属离子配位时的配合形式多种多样[1-3]。例如,Li等[4]通过修饰得到一种四羧酸H4OMTP,以此为配体组成的金属有机框架在Hg(II)的吸附方面体现出了优异的性能;Sharma等[5]在氧化锌四足体纳米材料表面负载大量的羧酸类配合物,通过质子化的羧基,可以有效地去除水中的Cr(III);Xiao等[6]合成了一种锆基羧酸类金属有机框架,可以作为手性催化剂来催化醛的加成。由于羧酸类配体对金属荧光的敏感性,羧酸类配合物常常会被用作荧光探针,例如Shi等[7]使用了一种联苯四羧酸配体,得到了一系列同构的配合物,在Fe(III)和Cr(VI)的溶液中会规律性猝灭,这些配合物可以作为两种金属离子的荧光探针。羧酸类配合物在吸附、催化、传感等领域均展现出其独特的价值[8-13]。
羧酸类配体可以直接与金属配位,也可以通过后合成修饰将羧酸基团修饰进已有的配合物中[14]。由单一金属所形成的配合物理化性质在某些方面往往存在局限性,引入第二种恰当的金属离子,形成双金属配合物,通过两种金属离子间的协同作用,往往可以有效地弥补这种不足,呈现出两种金属离子的共同性质。构建双金属配合物的配体中,往往利用羧酸基团为强配位基,吡啶或咪唑等作为弱配位基,以构建设计的配位化合物[15]。
根据碳链长度的变化,不同的羧酸基团会展现出截然不同的配位性质[16-20]。以苯甲酸和苯乙酸为例,苯甲酸的羧酸基团属于刚性基团,以苯甲酸为配体的配合物容易排列成有序的晶体。但是,由于苯甲酸的酸基和苯环之间的共轭效应削弱了其自身的酸性,而酸性会影响羧酸基团的去质子化过程,使得苯甲酸的配位能力受到一定的影响。与此相比,苯乙酸的羧酸基团由于碳链的延伸而具有一定的柔性,乙酸基团与苯环之间不存在共轭效应,使得其酸性要稍强,所以苯乙酸在配位能力上具有一定的优势。利用苯甲酸和苯乙酸不同的酸性和配位能力,能够获得配位不饱和的配位化合物作为次级建筑单元(secondary build unit, SBU)构建双金属配位化合物或者金属离子探针。
本研究通过重氮化反应合成了同时具有苯甲酸和苯乙酸结构的偶氮分子,(E)-3-(5-羧乙基-2-羟基苯)偶氮烯基苯甲酸(H2L)。通过液相溶剂分散法,将H2L与醋酸盐配位获得了一系列配位化合物,得到了H2L与醋酸钴、醋酸锰的配合物单晶,对其进行了晶体结构分析。然后,研究了这两个配位化合物在溶液中的荧光发射性质,利用未配位的苯甲酸基团与稀土金属铕离子在N,N-二甲基甲酰胺(N, N-dimethylformamide, DMF)中进行了金属离子识别和荧光猝灭效应研究。
1 实验部分
1.1 仪器与试剂
甲醇、二氯甲烷、醋酸钴、醋酸锰均为分析纯试剂,所使用的药品均未经提纯直接使用。采用Nicolet IS50傅立叶变换红外光谱仪,溴化钾压片透射法测试;使用Perkin-Elemental 2400元素分析仪测定碳、氢、氮元素含量;X-射线粉末衍射(X-ray power diffraction, XRD)测试使用日本理学Rigaku Utima IV型X-射线衍射仪(Cu靶Kα射线,λ=0.154 18 nm),在40 kV电压及40 mA电流条件下收集2θ范围5°~50°的粉末衍射数据以完成测试。荧光测试使用Hitachi F-4600荧光分光光度计,激发狭缝宽度10.0 nm,发射狭缝宽度5.0 nm,光电信增管电压700 V,激发波长由各自的最大紫外吸收波长确定,扫描速度统一设置为240 nm/min。

图1 中间体M2L的合成

图2 配体H2L的合成
1.2 配体H2L的合成
如图1,在500 mL三口烧瓶中加入间氨基苯甲酸甲酯(1.33 g,8.8 mmol)、盐酸(3.6%,18 mL)及30 mL水,用冰盐浴冷却到0 ℃后,搅拌下逐滴滴入NaNO2水溶液(30%,1.62 mL),过程中控制温度在0~5 ℃,滴毕,继续搅拌反应40 min,最终得到浅黄色黏稠的悬浊液。向50 mL水中加入对羟基苯乙酸甲酯(1.26 g, 7.6 mmol),用氢氧化钠溶液调节悬浊液的pH在9左右,降温至5 ℃以下,于60 min内将上述所得重氮盐溶液缓慢地滴加到此溶液中,滴加过程中保持反应溶液温度在0~5 ℃,且使用饱和Na2CO3溶液保持反应体系的pH在9左右。加完后维持pH为9的情况下反应4 h,停止反应,滴加盐酸调节pH到2~3,过滤,水洗至洗涤液呈中性,干燥,得到中间体M2L的橙黄色固体1.71 g,熔点90~92 ℃,收率为68.3%。
如图2,将中间体M2L(0.32 g,1 mmol)加入到三口烧瓶中,加入KOH(0.34 g,6 mmol)和水(10 mL),搅拌过夜至澄清透明后加稀盐酸调节pH到5,抽滤、水洗、干燥,得配体H2L的橙色固体 0.28 g,熔点超过200 ℃,收率为88%。红外光谱(KBr, cm-1):3 417.8(s), 1 696.0(m), 1 587.2(m), 1 512.2(m), 1 416.0(m)。 核磁共振氢谱δ:3.69 (s,2H), 7.15 (m,2H), 7.86 (m,2H), 8.35 (m,3H), 9.85 (s,1H), 12.45 (s,1H), 12.72 (s,1H)。
1.3 配位化合物1的合成
采用溶剂扩散法合成配位化合物1,将醋酸钴(23.6 mg,0.2 mmol)溶于1 mL去离子水中,装入试管底部,在其上慢慢加入2 mL甲醇,形成一个甲醇-水双层体系,最后将配体H2L(65.6 mg, 0.2 mmol)溶解于1 mL甲醇中,将所得淡黄色溶液缓缓加入上述甲醇-水双层体系中,最终在试管里形成三层体系,然后于室温静置,缓慢挥发直至在试管中有棕红色晶体析出,洗涤称量得46.3 mg,产率59%。红外光谱(KBr, cm-1):3 427(m),2 933(m),1 661(m),1 560(m),1 494 (m),1 390(m),1 253(m),1 104(s),773(m),664(m)。元素分析(按C30H34CoN4O16计算值,%):C,46.14(47.07);H,4.21(4.48);N,7.49(7.32)。
1.4 配位化合物2的合成
使用醋酸锰(22.8 mg, 0.2 mmol)代替醋酸钴重复上述步骤,得到配位化合物2的橙黄色晶体,产率57%。红外光谱(KBr, cm-1):3 416(m),2 935(m),1 659(m),1 559(m),1 438(m),1 390(m),1 253(s),1 105(m),774(m),664(m)。元素分析(按C30H36MnN4O17计算值,%):C,46.57(46.22);H,3.81(4.65);N,8.02(7.19)。
1.5 配位化合物1和2的晶体学数据
2个配位化合物的晶体学数据见表1~3。

表1 配位化合物1和2的晶体学数据

表2 配位化合物1和2的部分键长(nm)与键角(°)
2 结果与讨论
2.1 配合物1的晶体结构
配合物1结晶于单斜晶系C2/c空间群,其一个不对称结构单元中包含半个Co(Ⅱ)离子,一个负一价的配体HL-,两个配位水分子和两个各占据一半的游离水分子,如图3所示。所形成的配位分子结构为Co(HL)2·2H2O,中心Co(Ⅱ)离子处于[CoO6]八面体配位环境的中心,如图4所示。2个氧原子(O5、O5i)分别来自2个配体HL-中的乙酸官能团,另外的4个氧原子(O6、O7、O6i、O7i)分别来源于配位水。值得一提的是,配位分子中的配体上有2个羧基(O1和O2所在的苯基甲酸及O4和O5所在的苯基乙酸)仅苯基乙酸上的O5参与配位,而O1仍保持未脱质子的羧酸状态。众所周知,脱质子后的羧基的碳氧间的键长趋向于相等,而脱质子前的羧基则存在C=O与C—O的不等长碳氧键,晶体学数据所得C1—O1为0.131 nm,C1-O2为0.120 nm,这与C15—O4的0.126 nm和C15-O5的0.127 nm形成鲜明对比,也有力证明了配位化合物中HL-的结构特点。

表3 配位化合物1和2的氢键键长和键角
对称码参数:i-x+1/2,-y+1/2,-z;iix,-y+2,z+1/2;iii-x+1/2,y-3/2,-z+1/2;iv-x+1/2,-y-1/2,-z;v-x+1/2,y+1/2,-z+1/2;vix,y-1,z.
在固态下的配位分子中,配体的2个苯环平面之间仅仅存在7.67°的二面角,几乎处于同一平面上,配体的2个苯环和连接2个苯环的氮氮双键之间组成了一个大的平面共轭体系,电子在整个的大共轭平面体系中可以自由流动,在理论上具有良好的紫外吸收性质和荧光发射性质。
如图5所示,配位分子中的两个配体负离子通过Co(II)中心离子对称排列,在空间上呈现为一种Z字形的台阶状平面分子。相邻的配合物分子沿着晶体学b轴方向平行排列,相邻两个配体分子的共轭平面间距为0.344 nm,这一距离属于典型的π-π作用的平面间距。这些强烈的π-π作用形成了空间上配位化合物之间的AA堆积,这一模式导致空间中没有典型的孔穴出现。

图3 配位化合物1中的不对称结构单元(椭球度50%)
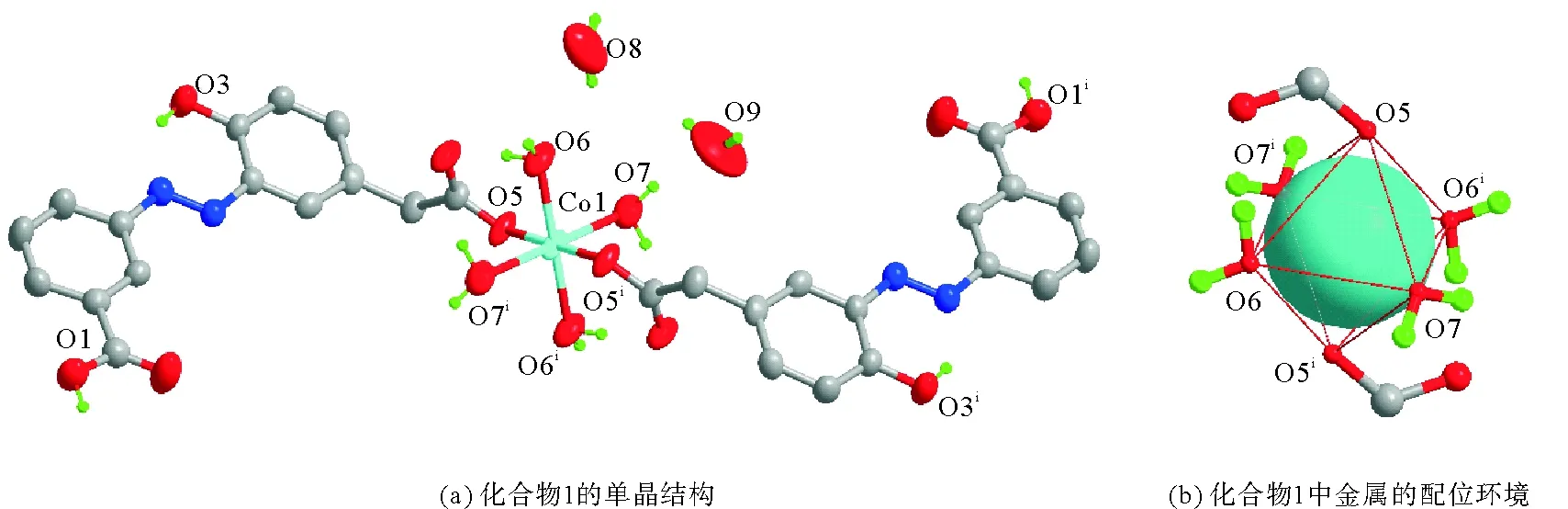
图4 单晶中配位化合物1的分子结构及Co金属离子所处的[CoO6]配位环境(对称码:i-x+1/2,-y+1/2,-z+1)
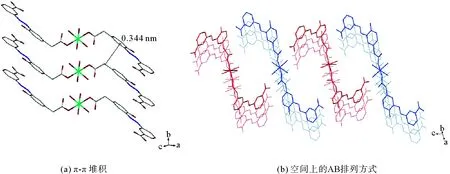
图5 固态下配合物1分子的π-π堆积(a)和空间上的AB排列方式(b)
相邻配位分子中Co离子的配位水与游离水之间存在大量的氢键,如图6(a)所示,对同一个配位分子而言,末端苯甲酸基团上的羰基氧原子会依次通过与两个游离水形成O2—H8B…O8、O8—H8A…O9两组氢键,最终与Co离子的一个配位水相连,形成O9—H9B…O7的氢键。与此同时,相邻的配位分子上的配位水两两之间也存在着氢键作用,使得相邻的配位分子之间的相互作用更加牢固,
特别对于配位分子末端的苯甲酸基团而言,其游离的羧羟基上的氧原子在c轴方向上会与相邻的另一种排列方式的配位分子上苯乙酸基团的羰基氧原子形成O1—H1…O4的强氢键,如图6(b)所示。
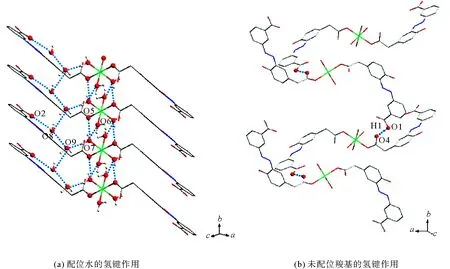
图6 配合物1的分子间氢键作用
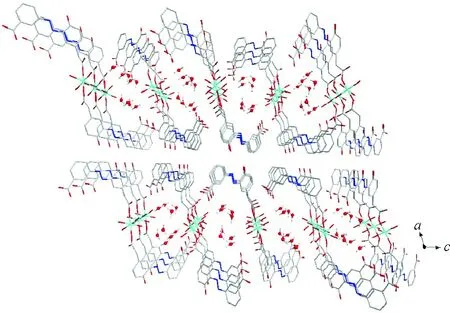
图7 沿晶体学b轴方向上观察到的一维水链
这些氢键将游离的结晶水连接在因堆积而形成的空间骨架上,形成了晶体学b轴方向上的一维水链,如图7所示。
2.2 配合物2的晶体结构
配合物2与配合物1属于异质同晶结构,其差别仅在于使用Mn(II)代替Co(II)后导致的金属-氧之间的键长和键角的差别,基本结构相同。
2.3 配合物的荧光性质
配位分子具有良好的共面性和电子云密度,理论上应该具有良好的紫外吸收及荧光发射性质,但测试表明,该配位分子存在强的紫外吸收,而其固态荧光发射无法测出。经过DMF的溶解稀释,测定了配体和配位分子的紫外及荧光发射性质(图8~9),结果显示,在波长365 nm的激发条件下,配位分子的荧光发射较配体有明显的蓝移,低浓度时三者有较好的荧光发射,但在浓度到达2×10-4mol/L后出现明显的下降,直至最后的荧光猝灭。这一明显的浓度增加导致的淬灭现象归因于聚集诱导猝灭(aggregation-caused quenching,ACQ),具有大平面构型和强π-π作用的分子通常会表现出这种性质[21-22]。根据晶体学解析的结果,所合成的配位化合物1和2符合这一结构特点:苯环及其连接体之间的大共轭平面结构和典型的π-π堆积作用,这可以解释配位化合物1和2的强紫外吸收和固态下的荧光猝灭现象。
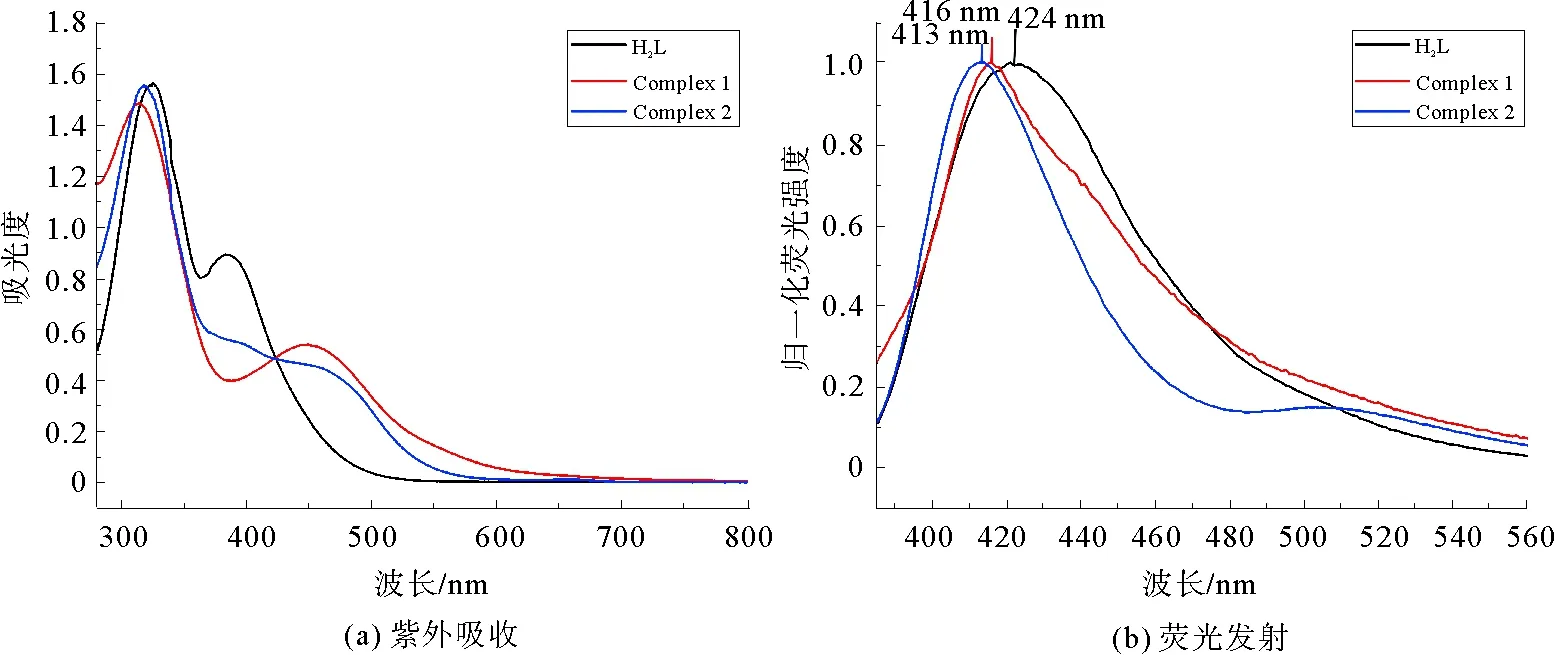
图8 配体与配合物1、2的紫外吸收峰(a)与荧光发射峰(b)
配合物1和2的结构均为M(HL)2结构,存在未配位的苯基甲酸结构,在DMF等弱配位的溶液溶解后,这两个配位化合物中未配位的羧基结构将有可能继续与其他金属离子络合反应,展现出良好的配位不饱和建筑块分子应用方面的潜质。

图9 H2L (a)、配合物1(b)及配合物2(c)在不同浓度下的荧光发射峰
铕是一种典型的荧光稀土元素,在水溶液中一般以八水化合物形式存在,具有较强的荧光发射性质。将配位化合物1和2分别和EuCl3-6H2O的DMF溶液进行混合反应,观察金属铕离子在590 和615 nm处的强特征荧光峰的变化,从而验证配位化合物的配位不饱和建筑块的应用。
在对2个化合物的荧光发射性质的探索结果基础上,以溶液中配合物的最大荧光发射浓度为标准配制配位化合物的DMF溶液,向具有最大发光强度的氯化铕DMF溶液(0.2 mmol/L)中加入不同摩尔数的配位化合物,混合均匀后检测其荧光发射的变化。如图10所示,随着配合物与Eu(III)的摩尔比值渐渐增大,Eu(III)的两个特征荧光峰渐渐变弱。当配合物与Eu(III)的摩尔比达到3∶2时,Eu(III)的特征荧光峰消失。这与配合物中苯甲酸基团的数量和Eu(III)价态的比值相同,证明了是配合物中的甲酸基团与Eu(III)发生了结合而使后者完全猝灭荧光。

图10 配合物对Eu(III)荧光的影响
根据上述的荧光测定结果,可以确定配位化合物中的未配位苯基甲酸基团可以作为配位点继续与其他金属进行反应,从而获得双金属配位化合物,有望在双金属螯合催化剂领域获得新的催化性质。
3 结论
合成了一个未经报道的含不同酸性羧基的偶氮配体H2L,通过与不同过渡金属离子进行配位反应,获得了2种典型的过渡金属Co和Mn的配位化合物的单晶,并进行了单晶结构分析。通过对2个配位化合物的单晶结构分析发现,这2个配位化合物属于异质同构的配位分子结构,配体上的2种羧酸基团在配位时表现出了不同的倾向,其中苯基乙酸基团优于苯基甲酸与金属离子配位,形成M(HL)2型的配位结构。配位分子中游离的苯基甲酸基团使其可以作为配位不饱和建筑块,具有再次结合其他金属离子的能力。通过荧光发射性质的分析和对稀土铕离子荧光发射的猝灭效应研究验证了配位化合物1和2不仅具有羧酸类配合物本身的多种功用,还可以作为一种可修饰的次级建筑单元,在构建双金属配合物领域具有广泛的应用价值。

