抗生素负载型二硫化钼-糖基苝酰亚胺自组装体系构建及抗菌研究
吴 棒, 胡习乐, 陈国荣
(华东理工大学结构可控先进功能材料及其制备教育部重点实验室,费林加诺贝尔奖科学家联合研究中心,上海 200237)
细菌耐药性如今已呈现出愈发多样化和顽固化的趋势,这为细菌的临床治疗带来了大量新的威胁和挑战[1-3]。近年来,具有抗菌药物载体性能和功能性抗菌活性的新一代材料实现了光动力/光热效应协同传统抗生素的协同抗菌效果[4-6]。光动力治疗(Photodynamic Therapy, PDT)中的光敏剂分子与抗生素药物一样具有共轭化学结构,能负载在自组装体系表面,通过特定波长光的敏化作用激活周边环境中的氧,激活后的高能态氧通常被称为活性氧簇(Reactive Oxygen Species, ROS),由于其强氧化性和高能态毒性,能有效杀伤细菌。相比于传统药物治疗方法,PDT 往往不易使细菌产生耐药性,也大大减少了对宿主组织的损伤[7-9]。然而,单独使用光敏剂进行PDT 的劣势在于ROS 半衰期较短,导致ROS易在环境中耗散,因而达不到很好的抗菌效果。出于这一原因,在构建光敏治疗载体时常常需要将光敏剂负载在材料体系表面并与少量的抗生素类药物协同作用[10-11]。功能化的石墨烯纳米材料作为药物载体已经被广泛地应用[12],负载小分子的材料能够控释或缓释光敏药物以及传统的抗生素药物,从而使得所有治疗分子靶向簇集在患处。
二维片层二硫化钼(MoS2)是一种具有易制备、易分散、稳定性好、负载载体能力强等优点的材料[13-14]。荧光团苝酰亚胺(Perylenediimide, PDI)是常用的光敏剂,PDI 在光辐射下可显著产生ROS 从而实现PDT,且该化合物的荧光特性也可进一步被应用于疾病的光学诊断[15-16]。然而,外源性的光敏剂及功能材料往往对于人体组织有强烈的细胞毒性和促炎作用。因此,提升材料的生物相容性十分重要。糖基是能够显著改善材料亲水性的基团,还是生物体自身具有的不可或缺的生物分子。糖基的引入能降低细胞毒性和提高材料的生物相容性。更为特异的是,糖基同时还能够作为常见的生物靶向识别基团以此来识别特定凝集素。有些细菌也和细胞同样,能够特异性分泌某种凝集素或蛋白而被特定糖所靶向识别[17-18]。例如,半乳糖基能够特异性结合绿脓杆菌表面凝集素从而识别绿脓杆菌。此外研究还发现,小分子的糖基自身对细菌的识别能力较弱,往往需要聚集起来形成糖簇结构,才能提高糖对细菌的识别效果[19]。
本文探究两种分别修饰了半乳糖基以及甘露糖基的不同糖型PDI 糖缀合物,通过π-π 堆叠作用,两种PDI 糖缀合物被负载在片层MoS2上构建了糖簇自组装体系,以此构建靶向绿脓杆菌的半乳糖光动力抗菌体系,同时甘露糖的体系作为参照被证明无明显的绿脓杆菌靶向性。二硫化钼材料表面还能够进一步负载少量抗生素分子,在PDI 实现靶向光动力抗菌的同时实现协同释药。该载药光动力抗菌自组装体系的构建,实现了光动力治疗协同抗生素的抗菌效果。
1 实验部分
1.1 实验材料
绿脓杆菌(ATCC27853)购自北京中原公司,半乳糖基苝酰亚胺化合物(PDI-Gal4)和甘露糖基苝酰亚胺化合物(PDI-Man6)为已知化合物[20]。二硫化钼粉末(纯度99%)购于上海百灵威有限公司。
1.2 主要仪器
超净工作台购于无锡净化设备厂;Centrifuge5415D台式离心机购于Eppendorf 公司;电子天平购于上海舜宇恒平科学仪器有限公司;立式压力蒸汽灭菌器购于上海申安医疗器械厂;恒温培养箱购于OLYMPUS公司;超低温冰箱购于SANYO 公司;恒温摇床购于Forma Scentific 公司。
1.3 实验方法
1.3.1 二硫化钼分散溶液的制备 实验中使用二硫化钼的粉末作为原料,通过超声、冻干等步骤制备得到单层或少层的二硫化钼材料:向25 mL 的棕色玻璃瓶中加入20 mL 的乙醇和超纯水混合溶液(体积比为1∶1),然后加入100 mg 的二硫化钼粉末,搅拌均匀后放入超声清洗仪中,冰浴条件下(控制温度在20 °C左右)超声12 h(功率为100 Hz),得到混合的悬浮液。使用离心机对悬浮液进行离心12 min,使用移液枪吸取离心后的上层溶液,冻干机冻干过夜,最终得到10 mg 粉末状的二硫化钼(产率为10%),将其溶于去离子水中,超声30 min 得到二硫化钼分散液。
1.3.2 化合物PDI-Gal4/PDI-Man6与二硫化钼的自组装 糖基苝酰亚胺PDI-Gal4/PDI-Man6化合物的结构如图1 所示。
负载头孢他啶体系的构建步骤:取1 mL40μmol/L的PDI-Gal4或PDI-Man6与1 mL100μg/mL 的 二 硫化钼分散溶液分别置入5 mL 的棕色瓶中,放入超声清洗仪中超声30 min,得到二硫化钼与糖基化合物的自组装体系PDI-Gal4@MoS2或PDI-Man6@MoS2。进一步向自组装体系中加入256 μg/mL 头孢他啶(Ceftazidime, CAZ)溶液,搅拌12 h 后,离心除去未负载的药物,将底部离心物重新溶于缓冲液中,得到负载头孢他啶的抗菌体系PDI-Gal4@MoS2@CAZ 或PDI-Man6@MoS2@CAZ。采用动态光散射分析(DLS)和紫外-可见光谱分析(UV-Vis)验证苝酰亚胺分子与二硫化钼之间是否实现成功自组装。
1.3.3 细菌培养 将LB(Luria Bertani)固相培养基培养的绿脓杆菌(ATCC27853)单菌落挑出,接种到1 mL LB 液体培养基中,设定摇床温度为37 °C 并摇晃12 h 过夜待菌液完全浑浊。将菌液用LB 液体培养基稀释至每毫升106个细胞的浓度。
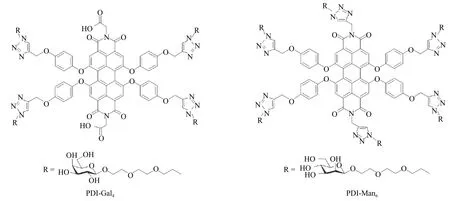
图1PDI-Gal4 和PDI-Man6 的结构Fig.1Structures of compound PDI-Gal4 and PDI-Man6
1.3.4 自由基的检测 糖基PDI 分子中的PDI 母核是有效的光敏剂,在白光的光照下能释放ROS 以此杀灭细菌。二氢罗丹明123(DHR123)是一种自由基捕获剂,其本身没有显著的荧光,但却能够在ROS 存在下被氧化产生荧光性罗丹明分子,从而显示出荧光,利用这种特性检测了在梯度时间光照下不同体系溶液中的ROS 释放,以此验证不同体系的光敏化作用。
1.3.5 抗菌活性的测试 抗菌活性测试的组别共有:空白组、CAZ 组、PDI-Man6@CAZ 组、PDI-Man6@MoS2@CAZ 组、PDI-Gal4@CAZ 组、PDI-Gal4@MoS2@CAZ组。空白组是在96 孔板的一排8 个孔中加入LB 培养基中的绿脓杆菌菌液(浓度为每毫升菌液有106个细胞,下同)。CAZ 组是在LB 菌液的1 排8 个孔中分别加入质量浓度为128、64、32、16、8、4、2、1 μg/mL 的CAZ,每个实验重复3 遍。PDI-Man6@CAZ组是在LB 菌液的1 排8 个孔中各自加入20 μmol/L的PDI-Man6和质量浓度分别为128、64、32、16、8、4、2、1 μg/mL 的CAZ,每个实验重复3 遍。PDI-Man6@MoS2@CAZ 组是在含有LB 菌液的1 排8 个孔中先加入PDI-Man6@MoS2自组装体系,其中PDI-Man6浓度为20 μmol/L,MoS2质量浓度为50 μg/mL,然后分别加入质量浓度为128、64、32、16、8、4、2、1 μg/mL的CAZ,每个实验重复3 遍以验证准确性。对于半乳糖体系的PDI-Gal4@CAZ 组和PDI-Gal4@MoS2@CAZ 组,实验方法与用量分别与PDI-Man6@CAZ 组和PDI-Man6@MoS2@CAZ 组相同。
材料制备完成后,若需光照则在白光下光照40 min,若不需要光照则置于暗处,之后将孔板置于培养箱中,37 °C 下培养18 h 过夜,最后观察最小抑菌浓度(Minimum Inhibitory Concentration, MIC)。

图2片层MoS2 和PDI-Gal4(a)与PDI-Man6(b)自组装前后的粒径变化Fig.2Particle size change before and after self-assemblies of MoS2 complex with PDI-Gal4(a)and PDI-Man6(b)
1.3.6 抗菌性能的表征 通过π-π 堆叠作用,分别将PDI-Gal4和PDI-Man6与二硫化钼片层自组装构成PDI-Gal4@MoS2和PDI-Man6@MoS2,然后将CAZ 进一步负载到材料表面构成PDI-Gal4@MoS2@CAZ 与PDI-Man6@MoS2@CAZ。利用白光光照条件下基于PDI 母核的抗菌材料体系在载入MoS2前后的自由基释放性能验证了材料的光动力杀菌活性。利用PDIGal4@MoS2和PDI-Man6@MoS2对于CAZ 的负载率验证了材料负载药物的能力;最后为验证本文所构建的所有体系的抗菌效果,利用绿脓杆菌标准菌株、单独的抗生素及自组装体系作为抗菌对照组,检验了白光光照下PDI-Gal4@MoS2@CAZ 及PDI-Man6@MoS2@CAZ 体系的MIC。
2 结果与讨论
2.1 糖基苝酰亚胺与二硫化钼自组装体系的构建
由DLS 实验分析可以看出,由于π-π 堆叠作用,PDI-Gal4和PDI-Man6与二硫化钼自组装构建为PDIGal4@MoS2和PDI-Man6@MoS2后,相较于单独的二硫化钼材料,自组装后体系的粒径增大(图2)。同时在UV-Vis 光谱分析中,化合物PDI-Gal4和PDI-Man6的紫外吸收信号在组装成为PDI-Gal4@MoS2和PDIMan6@MoS2体系之后,紫外吸收峰分别在594 nm 和596 nm 处发生了4~5 nm 左右的红移,并伴随有微小的紫外吸收强度提升(图3),说明苝酰亚胺糖缀合物与二硫化钼材料之间通过π-π 堆叠发生了自组装[21]。
2.2 糖基苝酰亚胺与二硫化钼自组装体系的ROS释放
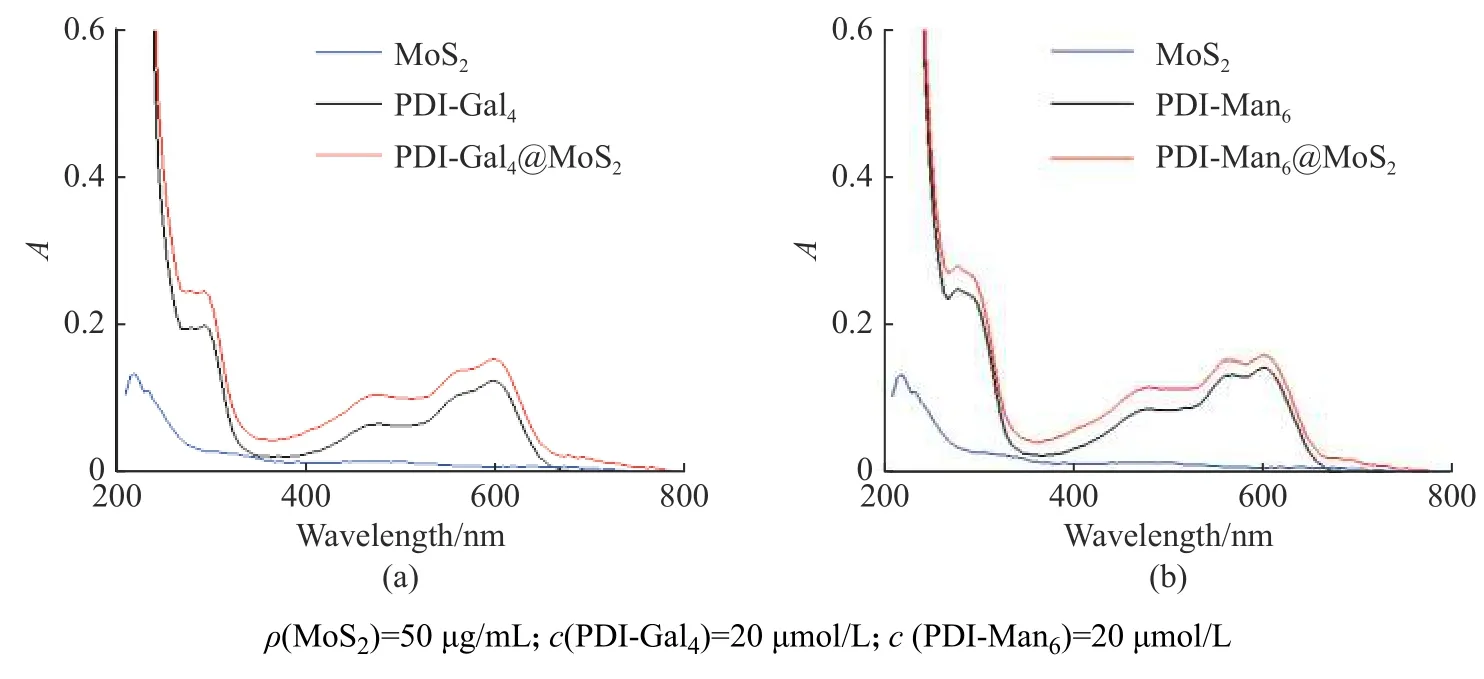
图3PDI-Gal4(a)和PDI-Man6(b)与MoS2 组装前后的紫外-可见吸收光谱变化Fig.3Ultraviolet-visible absorption spectroscopy analysis of MoS2 complex with PDI-Gal4(a)and PDI-Man6(b)
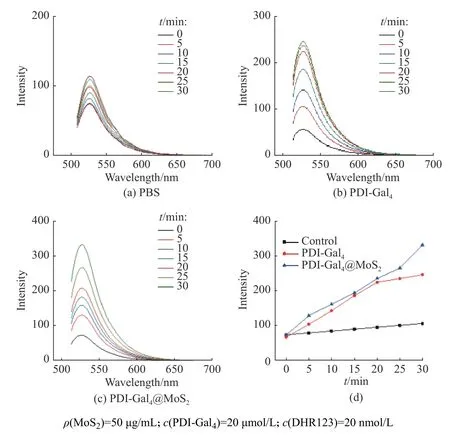
图4空白PBS(a),PDI-Gal4(b)和PDI-Gal4@MoS2(c)在白光光照下ROS 释放以及ROS 释放量与光照时间的线性关系(d)Fig.4ROS release of PBS blank (a), PDI-Gal4 (b), PDI-Gal4 @ MoS2 (c) under white light illumination and linear relationship between ROS release and light time (d)
组装体系的ROS 释放的结果如图4 和图5 所示。根据梯度光照下的荧光信号变化能够发现,空白的磷酸盐缓冲溶液(PBS)不会释放ROS,而单独的PDI-Gal4、PDI-Man6以及自组装后的PDI-Gal4@MoS2和PDI-Man6@MoS2体系则都具有显著而稳定的光敏化产生ROS 的效应(图4 和图5)。值得注意的是,根据荧光谱图变化对比和定量计算观察到,当PDI-Gal4和PDI-Man6与片层二硫化钼自组装之后,PDI-Gal4@MoS2和PDI-Man6@MoS2的ROS 释 放 量比起单独游离的PDI-Gal4和PDI-Man6分子有所提高,表明了二维材料的负载也能够一定程度提升苝酰亚胺的PDT 释放ROS 的效果(图4(d),图5(d))。
2.3 糖基苝酰亚胺与二硫化钼自组装体系对于头孢他啶的负载能力
实验中CAZ 药物被载入PDI-Gal4@MoS2和PDIMan6@MoS2体系后,分别测定了其药物负载能力。未负载药物总量可以通过测定PDI-Gal4@MoS2和PDI-Man6@MoS2上清液中游离药物的UV-Vis 吸收值和单体MoS2载药体系的空白对照计算得到。自组装体系的载药率=(药物总量−未负载药量)/药物总量×100%。实验结果表明,自组装体系PDI-Gal4@MoS2和PDI-Man6@MoS2具有优良的负载抗生素头孢他啶的性能(图6)。
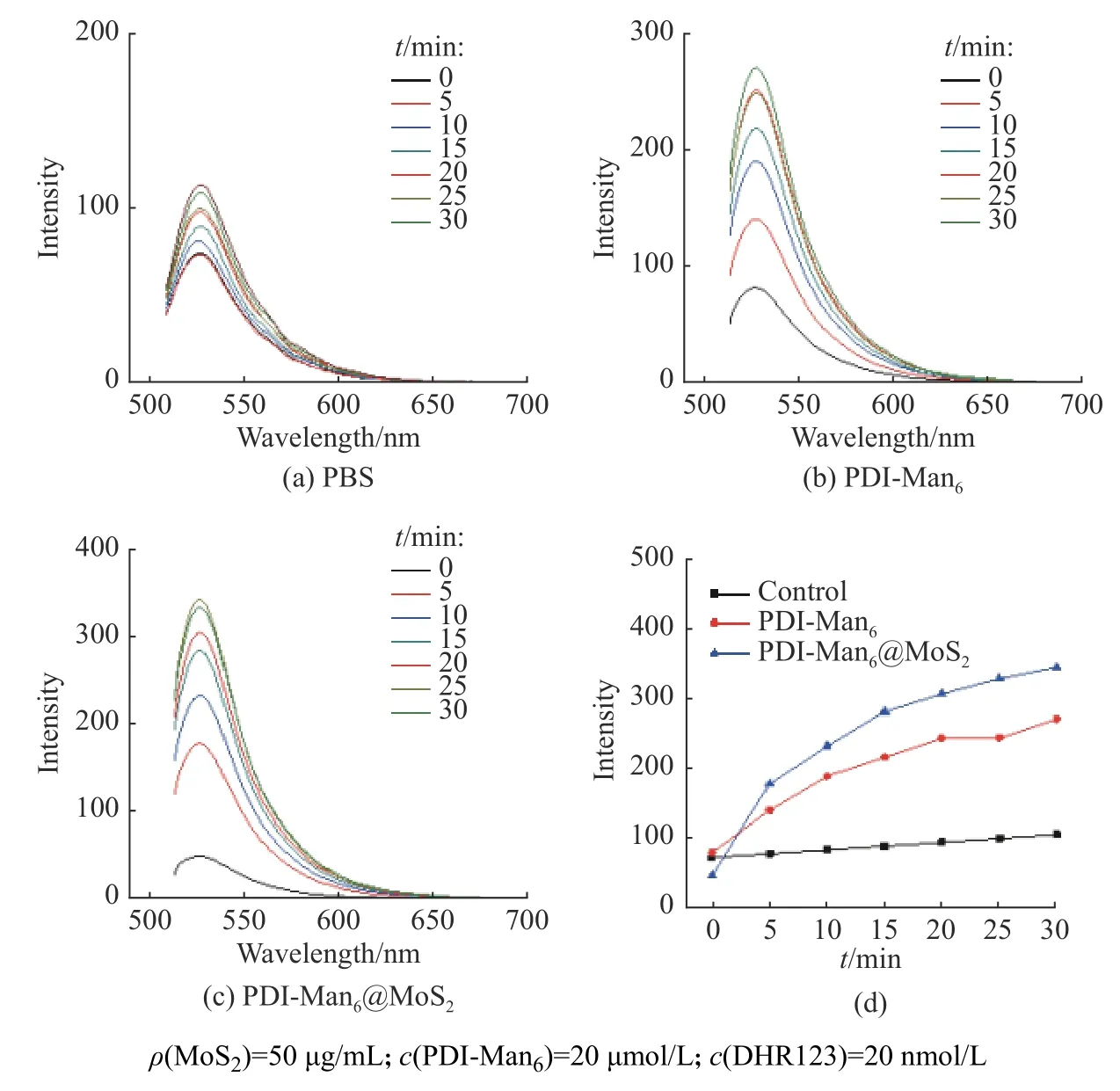
图5空白PBS 体系(a),PDI-Man6 体系(b)和PDI-Man6@MoS2 体系(c)的白光光照下ROS 释放以及ROS 释放量与光照时间之间的线性关系(d)Fig.5ROS release of PBS blank (a), PDI-Man6 (b) and PDI-Man6@MoS2 (c) under white light illumination and linear relationship between ROS release and light time (d)
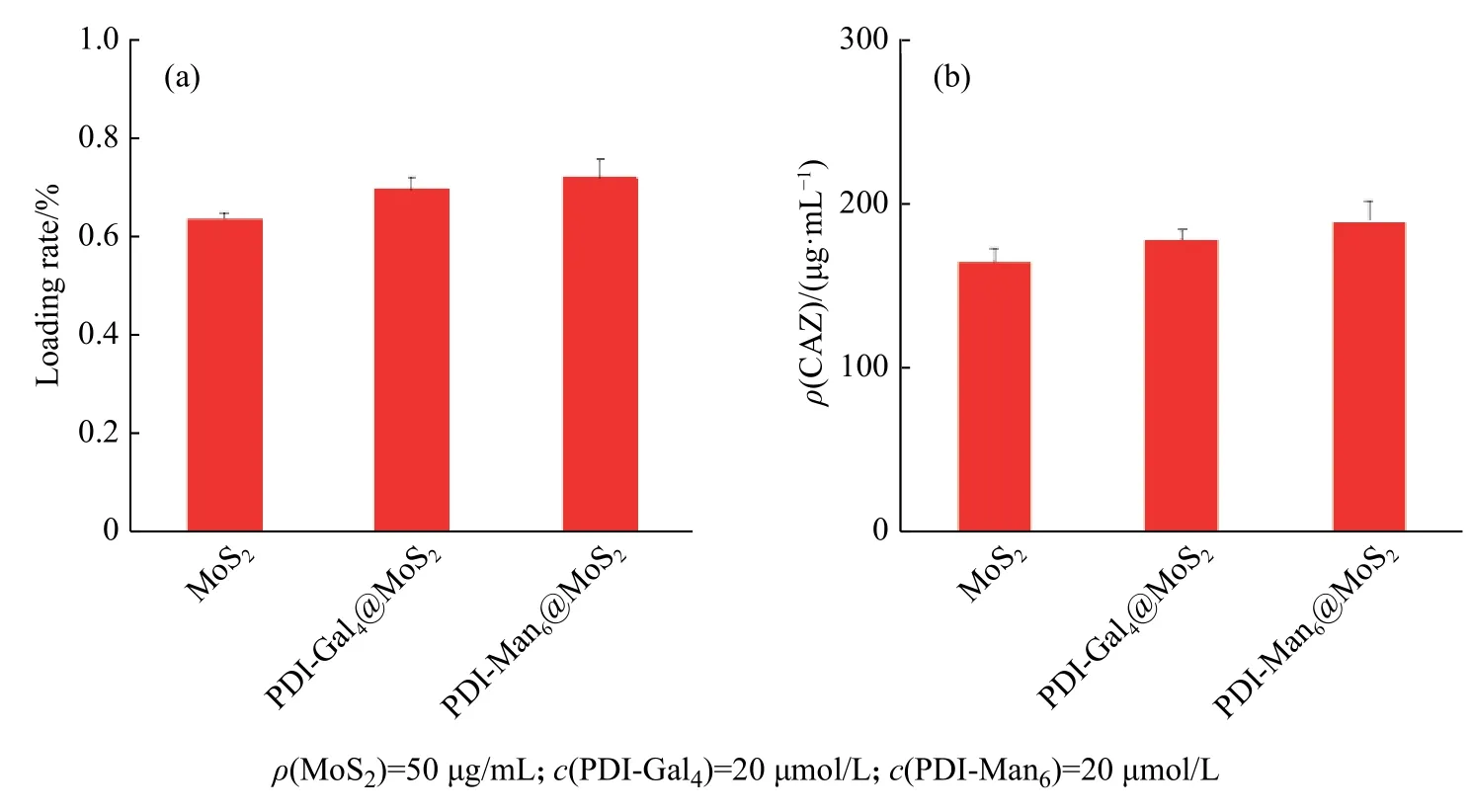
图6MoS2、PDI-Gal4@MoS2 和PDI-Man6@MoS2 对于药物CAZ 的负载率(a)和负载量(b)Fig.6Loading rates (a) and loading quantification (b) of MoS2, PDI-Gal4 @ MoS2 and PDI-Man6 @ MoS2 to drug CAZ
2.4 糖基苝酰亚胺与二硫化钼自组装体系的抗菌活性
PDI-Gal4@MoS2@CAZ 和PDI-Man6@MoS2@CAZ 对于绿脓杆菌的抗菌活性被进一步评价,结果表明,甘露糖体系作为参照组,半乳糖体系对绿脓杆菌具有靶向性。利用绿脓杆菌标准菌株,实验中分别测定了单独抗生素药物CAZ 和负载抗生素的PDI-Gal4@MoS2@CAZ 和 PDI-Man6@MoS2@CAZ 抗菌体系在有无白光照射条件下的抗绿脓杆菌的活性(MIC),以验证载药体系的光动力协同药物抗菌活性的强化效果,结果如表1 所示。从抗菌活性MIC 结果可以看出,单独的CAZ 作为传统抗生素药物对于细菌有稳定抑制效果,并且药物的作用是不受到外界光源的影响的。在CAZ 与PDI-Man6组装形成载药体系后,在非光照条件下,载药体系并未产生对细菌的增效杀伤效果,在白光光照下,PDI 化合物产生的ROS 能够协同负载的药物增强治疗效果,却并未有明显靶向增效性;在引入二硫化钼材料构建形成的抗菌体系PDI-Man6@MoS2@CAZ 中,药物在二硫化钼表面的装载起到了药物递送的作用,在非光照条件下表现出抗菌增效效果,在白光光照下,PDIMan6@MoS2@CAZ 体系将CAZ 原先对于绿脓杆菌的MIC 从32 μg/mL 降低到8 μg/mL,抗菌能力提升了3 倍。基于半乳糖基体系中的半乳糖基能够靶向绿脓杆菌表面分泌的蛋白LecA,实验中观察到在非光照条件下,CAZ 与PDI-Gal4自组装载药体系对于绿脓杆菌的靶向效果便已经初步体现。在白光光照下,即便未与二硫化钼材料自组装,PDI-Gal4与CAZ的复合体系借助半乳糖基的靶向性将体系中CAZ 对于绿脓杆菌的MIC 显著降低到2 μg/mL,该结果明显区别于没有靶向性的PDI-Man6@CAZ 体系。负载抗生素的PDI-Gal4@MoS2@CAZ 体系在非光照条件下的靶向效果与游离态PDI-Gal4@CAZ 相似,在白光光照下,半乳糖基对绿脓杆菌的靶向作用促使药物的高选择性低损耗的装载,完成敏化ROS 和药物的全方位菌内释放,使得PDI-Gal4@MoS2@CAZ体系将CAZ 原先对于绿脓杆菌的MIC 从32 μg/mL 降低到1 μg/mL(表1)。我们通过自组装体系携带抗生素,大幅度提高了抗生素 CAZ 杀灭绿脓杆菌的效果,将其抗菌能力提升了31 倍,表现出明显的增效效果。

表1CAZ 联合自组装体系对于绿脓杆菌(ATCC27853)的MICTable1Determination of MIC of CAZ combined self-assembly system treatment for P. aeruginosa (ATCC27853)
3 结 论
为有效治疗绿脓杆菌并且减少细菌的抗生素耐药性,利用菲酰亚胺荧光母核及二维材料的光动力性质,将两种分别带有半乳糖糖基或甘露糖残基的菲酰亚胺分子通过π-π 堆叠作用负载在具有优异物理性能的二维片层二硫化钼材料表面,并同时负载抗生素CAZ,构建了具有优良抗菌活性的载药光动力抗菌体系PDI-Gal4@MoS2@CAZ 和PDI-Man6@MoS2@CAZ。进一步在分子水平综合评价了抗菌体系光照下的活性氧簇释放性能和自组装体系的载药性能。最后,使用绿脓杆菌的菌液,采用最小抑菌浓度实验评价了构建体系的抗菌性能,发现 PDIGal4@MoS2@CAZ 在白光照射下对于绿脓杆菌的高效靶向抗菌活性非常显著。半乳糖基的引入,不仅为抗菌材料提供了靶向基团,使之能够靶向表面具有特异性凝集素的绿脓杆菌,也进一步提升了基于二维材料体系的生物相容性。本文工作为开发一类具有生物靶向性、高生物相容性等优势的抗菌材料提供了新的方向,也为能够避免抗生素的使用,完全借助材料的光学性能来实现抗菌效果的自组装体系的构建提供研究基础。
致 谢:本研究得到了法国里昂第一大学Sébastien Vidal 教授的大力支持与帮助!

