l2与水溶性高分子显色体系的探究
刘红瑜,原思浩,金谷
1化学国家级实验教学示范中心(中国科学技术大学),合肥 230026
2中国科学技术大学化学与材料科学学院,合肥 230026
3中国科学技术大学少年班学院,合肥 230026
I2遇淀粉显蓝色是一个非常灵敏的显色反应,这一方法常常被用来相互定性检验溶液中I2和淀粉的存在。学生通常知道该反应是一个定性反应,对于其在定量方面的应用还未涉猎。因此我们设计了一个探究实验,以此拓宽学生的理论和实验技能,同时让学生学会如何利用所学知识建立新的分析方法。
有文献用此显色反应定量测定食盐中的I2含量[1],也有用此显色反应定量测定烟草中的淀粉含量,测定波长从580 nm到620 nm[2]。本反应非常复杂,没有固定的摩尔比,是一个可逆反应,当其中一个反应物的量一定时,随着另一个反应物量的增加,生成的复合物的量也在增加,溶液的颜色变深。对于稀溶液只在一定范围内符合朗伯-比尔定律,用此显色反应测定I2和淀粉的含量时,标准系列溶液配制应非常严格,外界因素对此反应的影响非常大。I2和淀粉的显色反应比较复杂,I2分子进入淀粉螺旋圈内,形成淀粉-I2复合物,直链淀粉为蓝色,支链淀粉为紫红色[3]。直链淀粉的构像是卷曲盘绕的螺旋形,每转一圈约含 6个葡萄糖单位,同时,主链上还有少数分支[3]。聚乙烯醇(PVA)具有和淀粉相似的高聚多羟基结构,可以形成和 I2-淀粉体系类似的电荷转移复合物而显色。加入硼酸时,该显色反应具有比较稳定且定量的性质[4],常用于测定退浆废水中PVA含量的测定[5]。本实验就下述问题展开了探究:(1) I2和淀粉反应过程中,对淀粉浓度和I2浓度对显色反应的影响进行研究,得出测定浓度的上下限和最佳显色浓度;(2) I2-PVA-硼酸体系中,显色剂(PVA、硼酸)的比例、浓度,I2的浓度对体系的影响,以及最佳显色浓度;(3) pH、最大吸收波长、反应时间等条件的优化。本实验探究性强,有利于培养学生的综合创新能力,同时能让学生学会独立建立新的分析方法。
1 实验目的
探究I2-淀粉体系、I2-PVA-硼酸体系能否成为定量测定I2、PVA的方法。
2 实验原理
淀粉由直链淀粉和支链淀粉组成,这两部分在结构和性质上有所不同。直链淀粉相对分子质量较小,可溶于热水形成胶体溶液。支链淀粉相对分子质量比直链大得多,不溶于冷水,热水中膨胀成糊状。
现代科学已经通过X射线、红外光谱等先进的科学技术手段,证明了I2与淀粉显色原因。除了考虑到淀粉会吸附I2外,主要是由于形成了“淀粉-I2包合物”的结构:螺旋状的直链淀粉外侧有葡萄糖基暴露的部分羟基,这些羟基与I2分子作用,使I2分子嵌入淀粉螺旋体的轴心部位,与圈内6个葡萄糖基配位,形成包合物。该物质改变了原先的吸光性能,可以吸收除蓝光外波长范围为400-750 nm的可见光,故I2和直链淀粉溶液作用成蓝色。
3 试剂和仪器
3.1 试剂
淀粉、I2、KI、PVA、硼酸溶液、氨水、氯化铵、醋酸、醋酸钠、盐酸,试剂均为分析纯,购自国药集团化学试剂有限公司。
3.2 仪器
722可见光分光光度计(上海精密科学仪器有限公司)。
3.3 溶液配制
(1) 2.000 g·L−1淀粉标准溶液的配制。
称取0.5000 g可溶性淀粉于500 mL干净烧杯中,用蒸馏水打湿,搅匀,加入50 mL沸腾的蒸馏水,搅拌均匀,在电炉上再保持沸腾5 min,拿下,再加入蒸馏水50 mL,搅拌冷却至室温后转移至250 mL无色容量瓶中,用蒸馏水定容。
(2) 淀粉体系 2.000 g·L−1I2溶液的配制。
称取0.5000 g I2和1.25 g碘化钾,放入500 mL烧杯中,加蒸馏水溶解,转移至250 mL棕色容量瓶中,用蒸馏水定容。
(3) 0.2000 g·L−1I2溶液的配制。
移取(2)中标准溶液10.00 mL于100 mL棕色容量瓶中用蒸馏水定容。
(4) 0.101 g·L−1PVA 标准溶液。
准确称取0.0101 g PVA (聚合度为175)溶于80 mL热水中,冷却后移入100 mL容量瓶,定容。
(5) PVA 体系中 1.617 g·L−1I2溶液的配制。
称取0.1617 g I2和1.25 g碘化钾,定容至100 mL棕色容量瓶中。
(6) 39.55 g·L−1硼酸溶液的配制。
称取3.9550 g硼酸,溶解定容至100 mL容量瓶中。
(7) 显色剂的配制。
I2溶液(1.617 g·L−1)/硼酸溶液(39.55 g·L−1)体积比为 3 : 3、3 : 5、3 : 7。
4 实验过程及结果讨论
4.1 l2-淀粉体系
4.1.1 吸收曲线
取1.00 mL 0.2000 g·L−1I2溶液、5.00 mL pH 5.0的醋酸-醋酸钠缓冲溶液、1.00 mL淀粉标准溶液于25 mL容量瓶,定容。摇匀后从680 nm开始,到510 nm,每隔5-10 nm测一次吸光度。吸收曲线如图1所示。可以看出,最大吸收波长为610 nm。
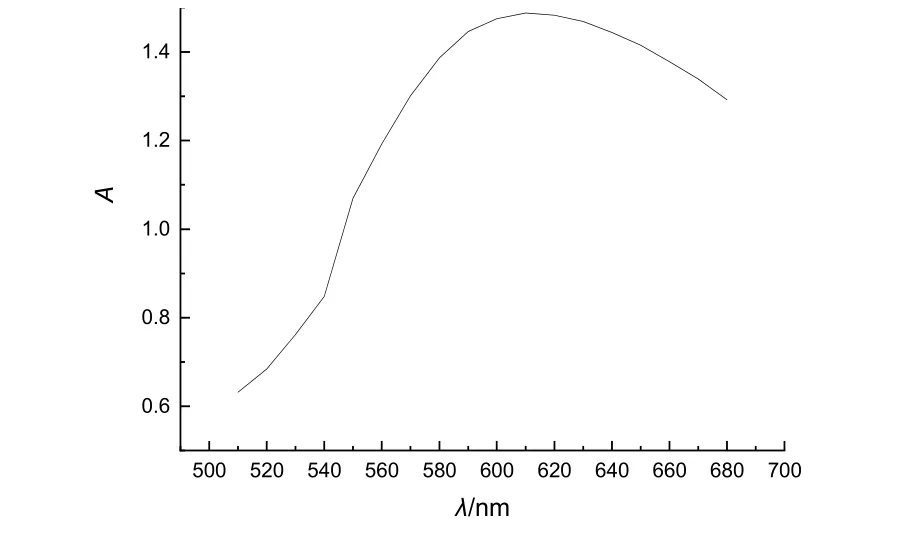
图1 I2-淀粉的吸收曲线
4.1.2 反应时间
取4.00 mL 0.2000 g·L−1I2溶液,50.00 mL淀粉标准溶液于100 mL容量瓶,定容,定容后淀粉浓度为 1.000 g·L−1、I2溶液浓度为 0.0080 g·L−1,每 30 min 测一次吸光度。
如图2所示,一开始,吸光度有微小变化,20 min后,吸光度不发生明显变化。混合各反应物后,需要一定时间来形成稳定的淀粉-I2包合物。因此,反应20 min后认为显色体系基本稳定,测得吸光度准确。

图2 I2-淀粉显色反应的吸光度和时间的关系
4.1.3 pH对显色体系的影响
取 1.00 mL 0.2000 g·L−1I2溶液,加入 5.00 mL 不同 pH 的缓冲溶液,1.00 mL 2.000 g·L−1淀粉溶液于25 mL容量瓶,定容,分别测定其吸光度。
如图3所示,中性、弱碱性条件下体系显淡蓝色,检测不灵敏;强碱性条件下,I2发生歧化反应故体系中基本没有I2存在;强酸性条件(pH 1.0)条件下,淀粉部分水解为糊精,与I2形成的包合物为红色,故体系呈蓝色和红色的混合色,即蓝紫色;pH 3.0-5.0的条件下,淀粉和I2都稳定存在,并结合形成蓝色包合物。因此弱酸性条件是理想的显色条件。

图3 pH对显色体系的影响
4.1.4 淀粉浓度对定量测定l2的影响
在不同淀粉浓度时测定 I2的工作曲线找出最佳淀粉浓度。由图 4可见,淀粉浓度为 0.1000、0.2000 g·L−1时,工作曲线线性较差,可以看到吸光度有趋于饱和的趋势。浓度为0.4000 g·L−1时,虽然线性较好,但吸光度太大,容易超量程。故选取淀粉浓度0.3000 g·L−1(用量3.75 mL)。
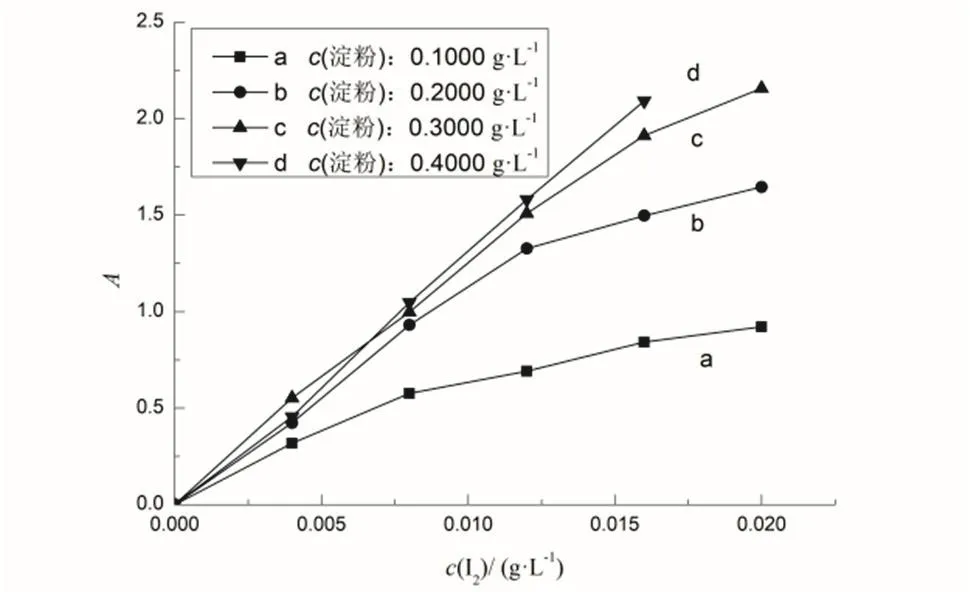
图4 不同淀粉浓度时I2的工作曲线
4.1.5 l2浓度对定量测定淀粉的影响
在不同I2浓度时测定淀粉工作曲线找出最佳I2浓度。对比图5中的四条曲线,可以发现当I2浓度大于等于 0.0080 g·L−1时,淀粉的线性范围在 0.0000-0.0120 g·L−1之间;对比 I2浓度分别为 0.0080、0.0120、0.0160 g·L−1时的曲线,I2浓度为 0.0120 g·L−1时线性关系较好,测定比较准确。

图5 不同I2浓度时淀粉的工作曲线
4.2 l2-PVA-硼酸体系
4.2.1 吸收曲线
取PVA标准溶液5.00 mL,加入6.00 mL显色剂(配制方法见3.3小节(7)),稀释至25.00 mL,定容后PVA浓度为0.0203 g·L−1、I2浓度为0.3880 g·L−1,摇匀显色15 min,以PVA体积为0.00 mL的溶液作参比,测定范围590-750 nm。如图6所示,最大吸收波长在660 nm处。

图6 I2-PVA-硼酸体系的吸收曲线
4.2.2 吸光度随时间变化
取2.25 mL I2溶液,50.00 mL PVA标准溶液于100 mL容量瓶,定容,定容后PVA浓度为0.0507 g·L−1、I2浓度为0.0364 g·L−1,每隔一定时间测一次吸光度。如图7所示,吸光度在15 min之后保持不变,故实验中要静置混合液15 min后再测定。

图7 I2-PVA-硼酸体系吸光度随时间的变化曲线
4.2.3 探究显色剂最佳比例
因为I2-PVA-硼酸显色体系中,I2起到显色的作用,而硼酸通过B和PVA的羟基形成配位键而增强显色的效果。我们采取固定I2体积(2.25 mL)而改变硼酸体积的方式探究最佳比例。制成二者体积比为3 : 3、3 : 5、3 : 7的显色剂,在最大吸收波长处测PVA的工作曲线,对比图8中的三条曲线,可以发现I2和硼酸的体积比为3 : 7时线性关系最好(图8)。

图8 不同显色剂比例下PVA的工作曲线
4.2.4 探究最佳显色剂体积
固定I2和硼酸的体积比为3 : 7,在不同显色剂体积时测定PVA的工作曲线找出最佳的显色剂体积。对比图9中的曲线,可以看出当显色剂用量为5.00 mL、7.50 mL时,PVA的线性范围为0-0.0160 g·L−1,用10.00 mL显色剂时线性范围可扩大至0-0.0200 g·L−1。故在测量时可以根据需求选择,需要测0.0160-0.0200 g·L−1可以用10.00 mL显色剂,0.0160 g·L−1以下时用7.50 mL显色剂即可得到满意结果。

图9 不同显色剂体积时PVA的工作曲线
4.3 实验结论
(1) 由于淀粉、PVA具有多羟基结构,可以和I2络合形成电荷转移配合物而显色,使用分光光度计可以进行定量测定。
(2) 在淀粉-I2测量体系中,最大吸收波长为610 nm。
(3) 使用弱酸性体系比较理想。
(4) 体系不宜静置太久,且控制显色时间尽量相同,可能因为淀粉会缓慢水解,导致吸光度缓慢上升。
(5) 测定 I2时,I2的线性范围在 0-0.0120 g·L−1,淀粉浓度 0.3000 g·L−1为最佳。
(6) 测定淀粉时,淀粉的线性范围在 0-0.1200 g·L−1,I2浓度 0.0120 g·L−1为最佳。
(7) 在I2-PVA-硼酸测量体系中,最大吸收波长为660 nm;
(8) 体系最好静置15 min。
(9) PVA 线性范围为 0-0.0160 g·L−1。
(10) PVA体系中显色剂最佳配比是I2和硼酸的体积比为3 : 7。待测PVA浓度在0.0160 g·L−1以下时,I2浓度为0.1455 g·L−1、硼酸浓度为8.306 g·L−1即可得到很好的结果。待测PVA浓度为0.0160-0.0200 g·L−1时,I2浓度为 0.1940 g·L−1、硼酸浓度为 11.07 g·L−1能获得较好的结果。
5 实验注意事项
(1) 实验中用到的淀粉和PVA均为高分子化合物,不易溶解,学生在配制其溶液时应该先调成糊状,然后再少量多次加水,便于其溶解。
(2) I2不稳定,所以其溶液应该在棕色试剂瓶中密封保存。
6 实验组织运行建议
(1) 本实验是一个综合探究实验,主要是培养学生自主建立分析方法的能力,适于面向化学院及地球和空间科学学院二年级本科生开设。小班开课,每个班16人左右,建议采用分组形式开展,4人一组开展本实验。该实验运行一轮,分两次课完成,每次时间大概6 h。建议教师课前引导学生开展文献调研,同时教师和助教也应在课前做好预备实验。
(2) 实验讲解采用分组讨论式。
(3) 实验报告要求学生详细记录不同条件下的测定结果,通过对比并结合文献,确定最佳的测定条件及有效的标准曲线。
(4) 需要单独组织学生对实验结果进行课堂汇报,并对实验过程中出现的各种实验结果进行讨论。
7 结语
本文介绍了一个分析化学探究实验。通过分光光度法,分别探究了淀粉和聚乙烯醇(PVA)两种水溶性高分子与I2构成显色体系在不同反应pH、反应温度、反应物浓度、反应时间等条件下显色结果的差异,从而确定该显色体系的最佳反应条件;进一步绘制出吸光度工作曲线,讨论了该显色体系用于物质定量测量的合理性。该实验探究性较强,非常有利于培养学生的综合实验能力,尤其是有利于培养学生自主建立新的分析方法的能力。本实验已经在中国科学技术大学化学与材料科学学院开设了4年,学生评价通过做该实验他们学会了自己建立新的分析方法,为以后的学习和工作打下了坚实的理论和实验基础,该实验项目非常值得推广。

