HCl中稀土盐硫酸高铈对1060铝板的缓蚀性能研究
唐敏,李向红
(1.西南林业大学 西南地区林业生物质资源高效利用国家林业和草原局重点实验室,云南 昆明 650224;2.西南林业大学 化学工程学院,云南 昆明 650224)

1 实验部分
1.1 试剂与仪器
硫酸高铈[Ce(SO4)2·4 H2O]、HCl(36%~38%)均为分析纯;1060铝板(厚度1.0 mm,抗拉强度135 MPa,各元素质量分数(%)为: 0.06 Si,0.215 Fe,0.005 Cu,0.005 Mn,0.048 Mg,0.001 6 Ti,其余为Al)。
HWS-20型恒温水浴箱(±0.1 ℃);FA1104电子天平(±0.1 mg);PARSTAT 2273电化学工作站;S4800型扫描电子显微镜;SPA-400 SPM unit原子力显微镜;Dataphyscis OCA20视频光学接触角测量仪。
1.2 实验方法
1.2.1 静态失重法测试 用系列砂纸将铝片(25 mm×20 mm×1.0 mm)打磨至表面平滑,丙酮脱脂后,用电子天平精确称重,然后将其悬于玻璃钩上全部浸泡于20 ℃不含和含有一定浓度Ce(SO4)2·4 H2O的1.0 mol/L HCl溶液中,2 h后取出清洗,用无水乙醇擦洗腐蚀产物,冷风吹干,再次进行称重,利用在铝片反应的前后质量差求缓蚀率(ηw)。
(1)
式中W0——不含缓蚀剂时铝片的质量损失,g;
W—— 含缓蚀剂时铝片的质量损失,g。
1.2.2 电化学法 电化学测量在电化学工作站完成,采用三电极系统:参比电极饱和KCl甘汞电极(SCE);辅助电极为铂电极(面积为1.0 cm×1.0 cm),工作电极为采用环氧树脂灌封的自制铝电极(裸露面积为1.0 cm×1.0 cm)。测试前工作电极的裸露面依次经过系列砂纸打磨和丙酮脱脂后,在开路电位(OCP)下全浸于测试液中浸泡2 h,充分保证开路电位稳定后再进行测试。
1.2.2.1 动电位极化曲线测试 动电位极化曲线测量时,扫描区间为-250~250 mV(vs.OCP),扫描速率为0.5 mV/s。极化曲线法的缓蚀率(ηp)通过腐蚀电流密度计算。
(2)
式中icorr(0)——铝电极在不含缓蚀剂的HCl溶液中的腐蚀电流密度,μA/cm2;
icorr(inh)——铝电极在含缓蚀剂的HCl溶液中的腐蚀电流密度,μA/cm2。
1.2.2.2 EIS测试 EIS的测量范围为100 kHz~10 mHz,交流激励幅值为10 mV。EIS的缓蚀率(ηR)通过极化电阻(Rp)计算[8]。
(3)
式中Rp(0)——铝在不含缓蚀剂的1.0 mol/L HCl溶液中的极化电阻,Ω·cm2;
Rp(inh)——铝在含缓蚀剂的1.0 mol/L HCl溶液中的极化电阻,Ω·cm2。
1.3 表面分析测试
将铝片表面处理后,20 ℃恒温浸泡于添加100 mg/L Ce(SO4)2·4H2O前后的1.0 mol/L HCl溶液中,2 h后取出洗净、吹干后立即进行SEM、AFM和接触角测试。
2 结果与讨论
2.1 硫酸铈的缓蚀作用及吸附行为(失重法)
失重法测试得到20 ℃时10~100 mg/L Ce(SO4)2·4H2O 对铝在1.0 mol/L HCl溶液中的缓蚀率(ηw)变化曲线,见图1。

图1 20 ℃时1.0 mol/L HCl中缓蚀率(ηw)和Ce(SO4)2·4 H2O浓度(c)关系Fig.1 Relationship between inhibition efficiency(ηw) and Ce(SO4)2·4 H2O concentration(c)in 1.0 mol/L HCl at 20 ℃
由图1可知,ηw随Ce(SO4)2·4H2O浓度的增加而增大,Ce(SO4)2·4H2O≥30 mg/L时,缓蚀率增加趋势变得平缓。100 mg/L Ce(SO4)2·4H2O缓蚀率高达94.3%。
硫酸高铈的缓蚀作用与在铝表面的吸附有关。为了进一步研究铝表面的吸附情况,将常见的几个吸附等温式,如Flory-Huggins吸附、Bockris-Swinkels吸附、Langmuir吸附、Frumkin吸附、Temkin吸附及Freundlich吸附拟合实验数据。
Langmuir吸附模型[8]:
(4)
式中c——缓蚀剂浓度,mg/L;
K——吸附平衡常数,L/mg;
θ——表观表面覆盖度,其值近似和缓蚀率相等。
图2是c/θ-c拟合直线,其线性拟合相关系数(r2=0.998 2)和直线斜率(0.95)均十分接近1,说明在20 ℃时1.0 mol/L HCl溶液中硫酸高铈在铝片表面的吸附方式为Langmuir吸附等温式。

图2 20 ℃ 1.0 mol/L HCl溶液中硫酸高铈在铝表面的Langmuir吸附模型Fig.2 Langmuir adsorption model of Ce(SO4)2·4H2O on aluminum surface in 1.0 mol/L HCl at 20 ℃
由拟合直线的截距(12.805)可换算出吸附平衡常数(K)为0.078 L/mg。通过吸附平衡常数计算出标准吸附Gibbs自由能ΔG0=-27.5 kJ/mol,故硫酸高铈在铝片表面的吸附作用方式为物理吸附和化学吸附[9],且绝对值较大,故吸附自发趋势较为明显。
(5)
式中 R ——气体常数,8.314 J/(K·mol);
T——热力学温度,K;
csolvent——水溶液浓度,其值接近于1.0×106mg/L。
2.2 铝在含硫酸高铈的HCl溶液中的动电位极化曲线
图3是20 ℃时铝在未添加和添加10,50,100 mg/L Ce(SO4)2·4H2O的1.0 mol/L HCl溶液中的动电位极化曲线。

图3 20 ℃铝在含Ce(SO4)2·4H2O的1.0 mol/L HCl溶液中的极化曲线Fig.3 Polarization curves of aluminium in 1.0 mol/L HCl solution containing Ce(SO4)2·4H2O at 20 ℃
由图3可知,添加稀土Ce(SO4)2·4 H2O后,极化曲线形状未发生改变,故铝的腐蚀机理亦未改变。阴极区域的极化曲线中出现较为宽的Tafel区间,在HCl溶液中添加稀土Ce(SO4)2·4 H2O后,各阴极极化曲线之间基本相互平行,表明铝在HCl中的阴极析氢反应(2H++2e-→H2)为活化控制。值得注意的是,本体系中的阳极极化曲线的Tafel区间不太明显,故采用将阴极Tafel直线外推至腐蚀电位的方法来求解腐蚀电位(Ecorr)、腐蚀电流密度(icorr)、阴极Tafel斜率(bc)参数[10],进而求算出ηp,结果见表1。

表1 20 ℃ 铝在含Ce(SO4)2·4H2O的1.0 mol/L HCl溶液中的腐蚀电化学参数Table 1 Electrochemical corrosion parameters for aluminium in 1.0 mol/L HCl without and with Ce(SO4)2·4H2O at 20 ℃
由表1可知,HCl中铝的icorr在加入Ce(SO4)2·4H2O后明显下降,且随缓蚀剂浓度用量的增加下降幅度愈加明显。未添加稀土盐的空白 1.0 mol/L HCl中,icorr高达4 734 μA/cm2,当添加100 mg/L Ce(SO4)2·4H2O 后,在HCl中icorr下降至 648 μA/cm2,缓蚀率86.3%,表明稀土盐硫酸铈对铝在HCl中具有良好的缓蚀作用。Ecorr在加入Ce(SO4)2·4H2O 前后基本未改变,但从图3的极化曲线可知,阳极极化曲线基本重合,故稀土盐硫酸铈为阴极抑制型缓蚀剂。阴极Tafel斜率(bc)随着稀土盐硫酸铈浓度的增大,改变趋势愈加明显,据此可表明随着缓蚀剂浓度的增加,阴极反应活性点不断被屏蔽覆盖,故阴极极化规律亦会发生明显改变。
2.3 铝在含硫酸高铈的HCl溶液中的EIS
图4为20 ℃时铝在不含和含有10,50,100 mg/L Ce(SO4)2·4H2O的1.0 mol/L HCl溶液中的Nyquist图。
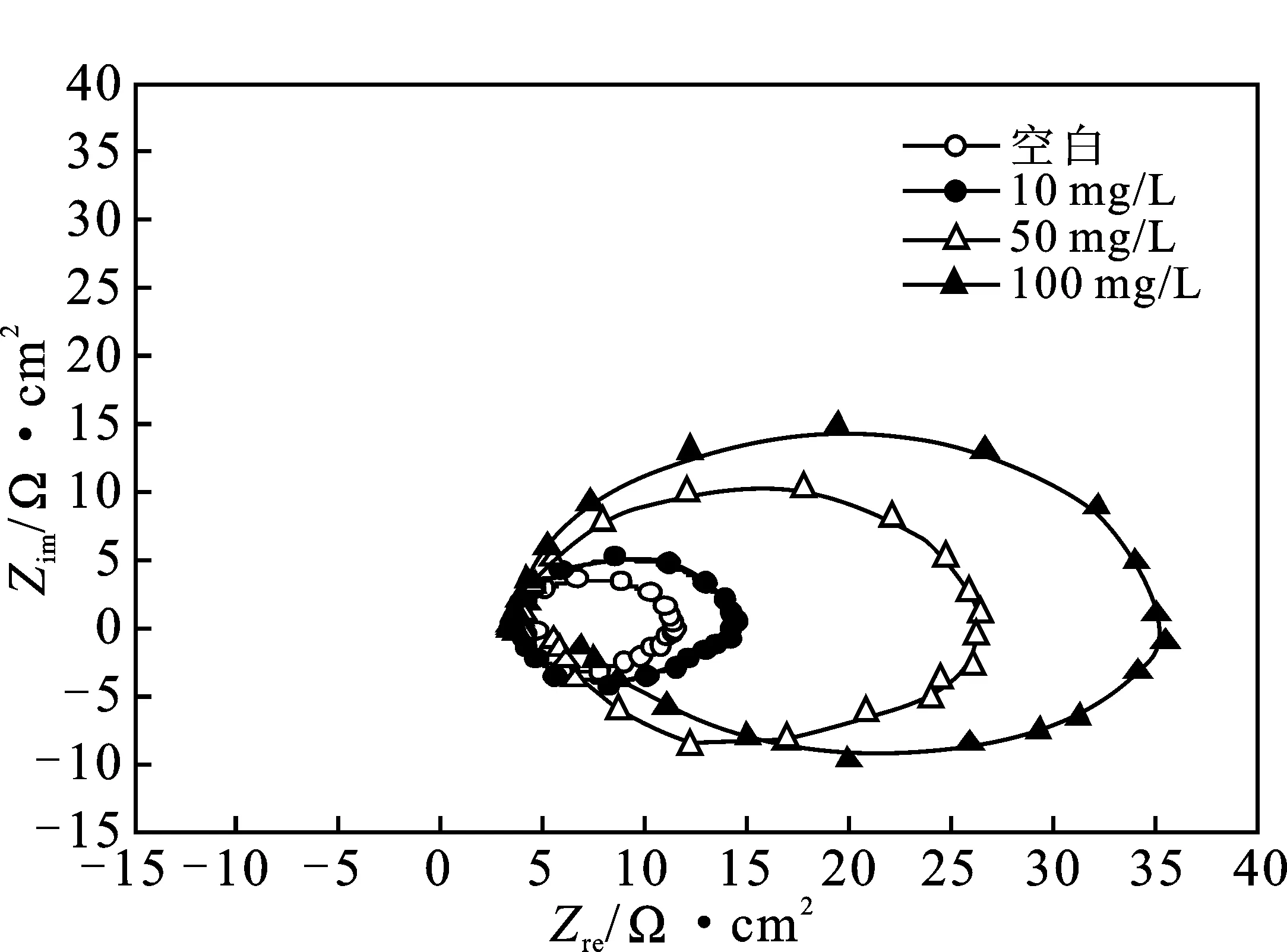
图4 20 ℃时铝在Ce(SO4)2·4H2O 的1.0 mol/L HCl介质中的Nyquist图谱Fig.4 Nyquist spectra of aluminum in 1.0 mol/L HCl media containing Ce(SO4)2·4H2O in 20 ℃
由图4可知,各条件下的Nyquist图都是由高频区的容抗弧和低频区的感抗弧两部分组成,且两个弧大小基本一致,感抗弧略小于容抗弧,即整个图谱基本呈椭圆形,类似EIS结果在Al/HCl体系中已有报道[11]。图中高频区的容抗弧是电荷转移电阻和电极界面电容组成的阻容弛豫过程;低频区的大感抗弧可能是铝表面的Al2O3溶解过程[11],或与HCl溶液中的H+[12]、Cl-[13]、缓蚀剂[14]等吸脱附过程引起的不平衡状态相关,也可能与低频下金属的再溶解过程相关[15]。
高频区的容抗弧的圆心处于实轴一些,故铝电极表面存在由电极表面粗糙不均匀引起的频率弥散效应[10]。圆弧弦长随Ce(SO4)2·4H2O质量浓度的增大而不断变大,表明Ce(SO4)2·4H2O在铝表面发生吸附后使电荷传递受到明显抑制,产生良好的缓蚀作用。加入Ce(SO4)2·4H2O后,Nyquist图谱的形状未发生改变,表明添加 Ce(SO4)2·4H2O 后,铝在HCl中的腐蚀电化学机理并未发生明显变化。
添加稀土盐Ce(SO4)2·4H2O后,容抗弧和感抗弧的半径均随Ce(SO4)2·4H2O的浓度用量增加而增大,表明添加Ce(SO4)2·4H2O后对铝在HCl中的腐蚀起到了良好的减缓作用。采用图5的等效电路图对EIS拟合,图中Rs、Rt、RL、Q、L分别为溶液电阻、电荷转移电阻、电感电阻、常相位角元件、电感值。极化电阻(Rp)可通过Rt和RL进行换算[8]。
(6)
式中Rt——电荷转移电阻,Ω·cm2;
RL——电感电阻,Ω·cm2。
根据公式(3)利用Rp可计算出EIS法的ηR。

图5 拟合EIS的等效电路图Fig.5 Equivalent circuit used to fit the EIS

表2 20 ℃ 铝在不含和含SDS的1.0 mol/L HCl溶液中的EIS参数Table 2 EIS parameters for aluminium in 1.0 mol/L HCl containing SDS at 20 ℃
由表2可知,Rs的数值低于4 Ω·cm2,说明1.0 mol/L HCl电解质溶液中导电性强,溶液电阻基本可以忽略。Rt和Rp在空白HCl溶液中仅分别为7.51,0.66 Ω·cm2,但加入稀土盐 Ce(SO4)2·4H2O 后其值显著升高,且随稀土盐 Ce(SO4)2·4H2O 浓度用量的增加而增大,说明 Ce(SO4)2·4H2O 对铝在HCl中的腐蚀产生了良好的缓蚀作用。Q也随稀土盐的增加而增大,此结果与有机缓蚀剂在铝表面的吸附后常相位角元件下降相反,这可能是由于稀土盐在水中电离成离子,离子的介电常数高于吸附在铝表面水分子,故吸附后常相位角元件反而上升。弥散效应系数(n)稍小于1,表明电极/溶液界面的频率弥散效应较弱,在1.0 mol/L HCl溶液中添加 Ce(SO4)2·4H2O后 n值下降,且偏离1的程度增加,这可能是由于缓蚀体系中电极表面的竞争吸附反应较强,频率弥散效应有所增强。
与低频区相关的L值在空白溶液体系中为4.6 H·cm2,但在添加Ce(SO4)2·4H2O后的缓蚀体系中L值急剧增大,当浓度为100 mg/L时,L值高达30.8 H·cm2,表明空白溶液体系中引起电感效应的电极表面中间吸附-脱附不平衡产物主要是H3O+、Cl-,而缓蚀体系中引起电感效应的电极表面中间吸附产物主要是缓蚀剂分子[8],也进一步表明稀土盐Ce(SO4)2·4H2O在铝电极表面发生吸附。缓蚀效率随缓蚀剂浓度的增加而增大,当缓蚀剂浓度增加至100 mg/L时缓蚀率高达85.4%,进一步表明稀土盐具有良好的缓蚀性能。
2.4 铝表面的SEM图像
由图6a可知,经过表面处理后的铝片,表面光滑平整,也可观察到系列砂纸打磨留下的条痕。由图6b可知,铝在1.0 mol/L HCl溶液中全部浸泡2 h后,铝表面遭受到HCl介质的严重腐蚀,表面呈蜂窝状位错致密排列,极其粗糙。在1.0 mol/L HCl溶液中加入100 mg/L Ce(SO4)2·4H2O后,由图6c可知,铝表面的腐蚀程度明显降低,可观察到浸泡前铝表面残留的打磨痕迹,表明Ce(SO4)2·4H2O对铝在1.0 mol/L HCl溶液中的腐蚀有极好的抑制作用,即稀土盐Ce(SO4)2·4H2O具有优良的缓蚀作用。



图6 铝表面的SEM微观形貌Fig.6 SEM micro-morphology of aluminum surface
a.浸泡前;b.20 ℃时1.0 mol/L HCl溶液中浸泡2 h;c.20 ℃时在添加100 mg/L Ce(SO4)2·4H2O的1.0 mol/L HCl溶液中腐蚀浸泡2 h
2.5 铝表面的3D-AFM图像
由图7a可知,铝表面处理后表面光滑平整,但也有起伏,也可观察到砂纸打磨后留下的痕迹。由图7b可知,铝表面在1.0 mol/L HCl溶液腐蚀2 h后,表面腐蚀严重,粗糙不平,表面覆盖有大量的块状的腐蚀产物。由图7c可知,在添加100 mg/L Ce(SO4)2·4H2O 后铝表面较为平整,腐蚀程度急剧下降,仔细观察后可看到一些砂纸打磨的痕迹,表明稀土盐对铝表面在HCl中腐蚀产生了明显的抑制作用。



图7 铝表面的3D-AFM微观形貌Fig.7 3D-AFM micro-morphology of aluminum surface
2.6 铝表面的接触角测试
图8为铝表面的接触角测试。

图8 铝表面的接触角图片Fig.8 Contact angle images of aluminum surface
由图8a可知,浸泡前,表面处理好的铝表面接触角较大,达到77.2~76.8°,这是由于刚表面处理好的铝片表面光滑所致,但接触角为锐角,表明铝表面具有亲水性,故HCl水溶液容易接近铝表面进而发生腐蚀。由图8b可知,铝片在1.0 mol/L HCl溶液浸泡后,接触角急剧减小,说明铝表面腐蚀剧烈,表面腐蚀产物粗糙,且具有较强的亲水性,故HCl可持续不断地穿透腐蚀产物层,进而腐蚀铝表面基体。由图8c可知,加入100 mg/L Ce(SO4)2·H2O后铝表面的接触角比图8b增大了近40°,说明稀土盐在铝表面发生吸附后疏水性增强,对腐蚀介质有一定的屏蔽效应,从而起到了缓蚀作用。
2.7 腐蚀及缓蚀作用机理
铝为活波金属,在HCl溶液中发生全面析氢腐蚀:
Al +3H+→Al3++3/2H2↑
(7)
整个电化学腐蚀由共轭的阳极氧化反应(Al-3e-→Al3+)和阴极还原反应(2H++2e-→H2)组成。Cl-会通过特性吸附参与阳极反应,机理历程为:
Al+Cl-↔(AlCl-)ads
(8)
(9)
AlCl-2→Al3++2Cl-
(10)
阴极析氢反应为H+得电子的反应,机理历程为:
Al+H+↔(AlH+)ads
(11)
(AlH+)ads+ e-↔(AlH)ads
(12)
(AlH)ads+H++e-↔Al+H2↑
(13)
稀土盐Ce(SO4)2·4H2O在水溶液中发生电离:

Ce4++ 6Cl-→[CeCl6]2-
(15)

3 结论
(1)硫酸高铈对铝在1.0 mol/L HCl溶液中具有良好的缓蚀性能,随着稀土盐浓度的增加而不断增大,100 mg/L Ce(SO4)2·4H2O缓蚀率可高达94.3%;硫酸高铈在铝表面的吸附符合Langmuir吸附等温式,吸附作用方式为混合吸附。
(2)在1.0 mol/L HCl溶液中添加硫酸高铈后未改变腐蚀电化学机理,但对阴极反应产生显著抑制作用,腐蚀电流密度下降,为阴极抑制型缓蚀剂。Nyquist图谱在高频区为容抗弧,低频区为低频感抗弧,整个图谱近似为椭圆形,添加硫酸高铈后电荷转移电阻、极化电阻和常相位角元件均增加。
(3)SEM和AFM微观形貌表明,铝表面在 1.0 mol/L HCl溶液中腐蚀程度严重,但加入硫酸高铈后,降低铝的腐蚀程度,表面粗糙度降低,对铝的腐蚀有很好的抑制作用;缓蚀体系铝的表面接触角增大,疏水性增强。

