海岛植物大叶胡颓子扦插繁育技术研究
庄文峰,高亚军,王 圳,黄建庭
(1.连云港市花果山风景区管理处, 江苏 连云港 222061;2.连云港市林业技术指导站, 江苏 连云港 222000)
大叶胡颓子(ElaeagnusmacrophyllaThunb.)为胡颓子科胡颓子属常绿直立灌木,主要分布于我国山东、江苏、福建、浙江、上海和台湾等沿海部分地区,日本和韩国等邻国也有野生分布[1]。大叶胡颓子具有较高的观赏、药用和食用价值,是滨海及海岛重要的野生木本植物资源之一,极具开发潜力。有大量研究表明,其根、茎、叶、果均可入药,含多种药理活性成分,具有平喘、止泻、止咳、收敛、抑菌和抗癌等功效,对治疗吐血不止和妇科疾病也有一定的效果[2-15]。成熟的大叶胡颓子果实颜色艳丽鲜红,营养成分丰富,味道甘甜,果实不仅可代替丹皮应用,民间还作为野生水果采食[16],并成为滨海及岛屿生存的鸟类丰富的食物[17]。果肉被鸟类取食后,将难以消化的种子混入粪便中排出,这些种子在水分、光照、温度及土壤立地条件适宜的环境中可能会萌发,并生长成为新的植株,这也将对大叶胡颓子野生种群的扩散提供有利的条件。大叶胡颓子拱形枝条优美,叶片在风吹拂下,深绿色与银白色的正背面叶片交替形成良好的对比效果。花期9—10月,果期翌年3—4月,花果期正好是多数观花观果植物的“空窗期”。适应性强,耐土壤瘠薄,耐盐碱[18],耐寒,耐修剪,病虫害少,根系发达,抗海风、海雾能力强[19],已在山东的青岛、威海及荣成等地逐渐得到栽培利用。由于大叶胡颓子分布的生境多位于我国沿海地区的滨海及岛屿,特殊的地理环境易造成生境破碎化,影响其野生种群的自然扩张,导致种群分布狭窄,居群间缺乏有效基因交流[20]。另外,随着人为活动干扰和破坏导致大叶胡颓子的野生种群自然分布范围、数量与日俱减[21]。因此,在有效保护野生种质资源的基础上,开展繁育技术的系统研究,实现规模化扩繁,使其在资源保护与利用方面步入良性循环,对于沿海地区城市景观绿化、困难立地造林和海岛植被恢复具有重要的意义。
大叶胡颓子在我国大部分地区尚处于野生状态,人工引种繁育体系还不够完善,而扦插育苗技术作为重要的林木种苗繁育手段之一,已在各类林木育苗中得到广泛应用。目前,关于大叶胡颓子扦插繁育技术研究的相关报道较少,袁雪丽等[19]在研究中探讨了大叶胡颓子扦插育苗的方法;李瑞等[22]采用速蘸处理大叶胡颓子插穗的方法,发现2 000 mg/L的ABT-1生根剂能显著提高其插穗的成活率。吲哚丁酸(IBA)对巴东胡颓子(Elaeagnusdifficilis)[23]、胡颓子(E.pungens)[24]、金边胡颓子(Elaeagnus×ebbingeiBoom.‘Gilt Edge’)[25]等胡颓子属其他植物扦插的影响已见报道,而对大叶胡颓子扦插的影响未见报道。本研究通过设置不同质量浓度IBA与不同浸泡时间,探索2者对大叶胡颓子扦插生根的影响,并筛选出最佳的处理组合,为其开发利用和人工繁育提供技术支撑。
1 材料与方法
1.1 插穗制备
试验所用的穗条采自前三岛大叶胡颓子1年生健壮枝条,尽量选择向阳侧树冠的枝条进行采集,采集后的枝条放于保湿箱中带回试验地。选择粗细程度一致的穗条,剪成长度为10—12 cm的插穗,保证每个插穗中上部至少有芽3个,保留顶部2个叶片,剪掉每个叶片面积的1/2,下切口剪成45°斜角,上切口为平截口。将插穗用提前配制的0.5%高锰酸钾溶液消毒备用。
1.2 试验设计和方法
先分别称量IBA药品0.1,0.3,0.6,1 g,倒入提前准备好的各个烧杯中,然后加入适量的无水乙醇,用玻璃棒搅拌使其充分溶解,最后移入刻度1 L容量瓶定容,配制成IBA溶液各供试质量浓度,以蒸馏水作对照(CK)[26]。设置插穗各浸泡时间。每个处理设置重复3个,每个重复插穗50根,并按照试验设计(如表1)进行扦插试验。

表1 试验设计
1.3 扦插方法
5月中旬,在位于连云港市海州区锦屏镇的连云港市乡土树种繁育中心智能温室的扦插池中进行扦插试验。该温室内配有水肥一体化智能设备,实时监测温室内温度和湿度,可实现喷淋、遮阳及顶部天窗的自动开启与关闭,并调节温室内风机的转动与停止,能为扦插试验创造适宜的环境条件。以珍珠岩作为扦插基质,先用国光牌多菌灵粉剂稀释500倍液均匀喷洒扦插池的珍珠岩基质进行消毒,再以塑料薄膜覆盖密封24 h,然后将扦插池的珍珠岩基质整平[27]。扦插试验前,先用略比插穗粗的小木棍,在整平的珍珠岩基质上按10 cm×15 cm的密度进行打孔,防止插穗下端皮部机械损伤影响生根,再将处理后的插穗插入,以插穗长度的 2/3作为插入珍珠岩基质的深度,插穗周边的珍珠岩用手指轻轻按压一下[28],增加插穗与基质间的接触面。
1.4 插后管理
按照全光照喷雾扦插育苗管理的方法,在扦插初期(即生根前),为保持育苗环境湿度在70%—80%,以保障叶片表面湿润。由于扦插处于夏季,特别是晴天10:00至17:00,植物蒸腾作用强烈,可间隔8 min喷雾3 min;17:00以后至次日10:00前,蒸腾作用慢慢减弱,每间隔15—20 min喷雾1 min。另外,阴天或雨天尽量少喷或不喷。通过温控系统控制顶部天窗、遮阳网和温室内风机工作使扦插温度不超过28 ℃。当插穗生根后,要逐渐延长间隔时间,减少喷雾量,避免插穗腐烂。应定期清理插穗凋落的叶子,避免滋生细菌和病虫害。在扦插生根的过程中,每隔7—10 d傍晚喷施1次上述国光牌多菌灵500倍液进行杀菌[27]。
1.5 数据统计及分析
从扦插后20 d开始,每隔2—7 d随机抽取插穗5—10株,查看愈伤组织形成情况,记录生根率(RR)、生根数(RN)及根长(RL)。在复置抽查的过程中,如发现插穗已开始有不定根形成时不再拔出插穗观察,避免拔出过程中损伤新形成的幼嫩根[24],以有不定根形成即作为判定生根时间(RT)。70 d后统计各组最终的RR,RN及RL。采用Excel,SPSS 20.0等统计软件进行数据分析及处理。
2 结果与分析
通过IBA不同质量浓度与浸泡时间对大叶胡颓子插穗的RR,RN,RL和RT等指标影响的方差分析结果发现(见表2,3),IBA不同质量浓度对上述4项生根指标的影响均达到极显著水平。浸泡时间对插穗的RR,RL和RT指标影响亦均达到极显著水平,而对指标RN的影响不显著,即在2个主效应因素中,IBA质量浓度对大叶胡颓子插穗生根指标影响大于浸泡时间。另外,IBA不同质量浓度与浸泡时间之间的交互作用也同样对RR,RL和RT指标影响达到极显著水平,而对RN的影响不明显。这表明不仅IBA质量浓度、浸泡时间影响大叶胡颓子扦插生根效果,2者之间存在的交互作用也对插穗生根产生不同程度的影响。
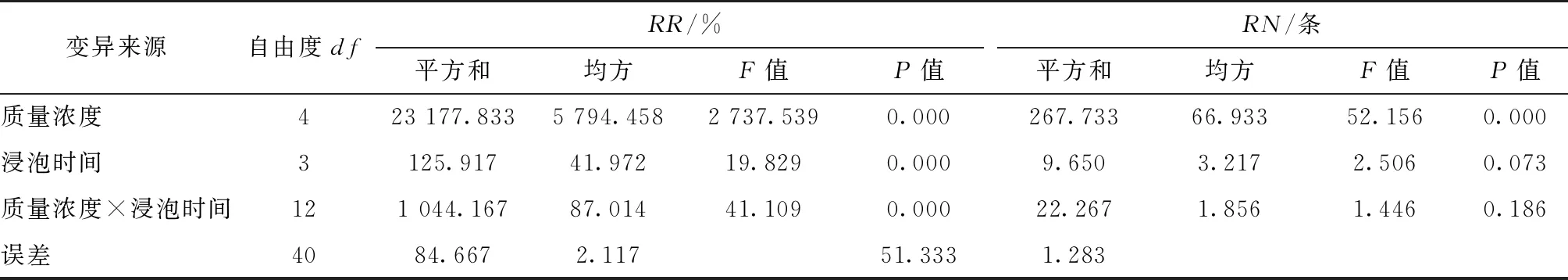
表2 IBA不同质量浓度与浸泡时间对大叶胡颓子插穗生根率和生根数的影响
采用外源生根剂浸泡大叶胡颓子插穗的处理组这3项生根指标较CK组均有较大程度的提高(见表4)。随着生根剂质量浓度增加,插穗的RR,RN及RL总体上均呈现先上升后下降的变化趋势。其中,在100—300 mg/L IBA质量浓度下,随着浸泡时间的延长插穗RR和RL呈不断增加趋势,而RN在IBA质量浓度为300 mg/L才出现较为显著的上升;当IBA质量浓度达到600 mg/L时,随着浸泡时间的延长插穗RR,RL和RN均出现不同程度先上升后下降的变化;而当IBA质量浓度达到1 000 mg/L时,随着浸泡时间的延长插穗RR和RL均出现较大幅度的减小,而RN的减小不明显。对试验结果进行多重对比发现,以C3T3交互作用(即600 mg/L的IBA浸泡60 min)的大叶胡颓子插穗RR最高,RN最多,RL最长,这3个指标分别为78.67%,10.67条和5.23 cm,较同等浸泡时间的对照C0T3(即0 mg/L蒸馏水浸泡60 min)分别提高59.34%,7.34条和3.83 cm。说明适宜的IBA质量浓度与浸泡时间的交互作用可诱导大叶胡颓子扦插后产生较多数量的不定根,并有效促进其根伸长生长,使插穗的根系发达,从而有利于其扦插成活。
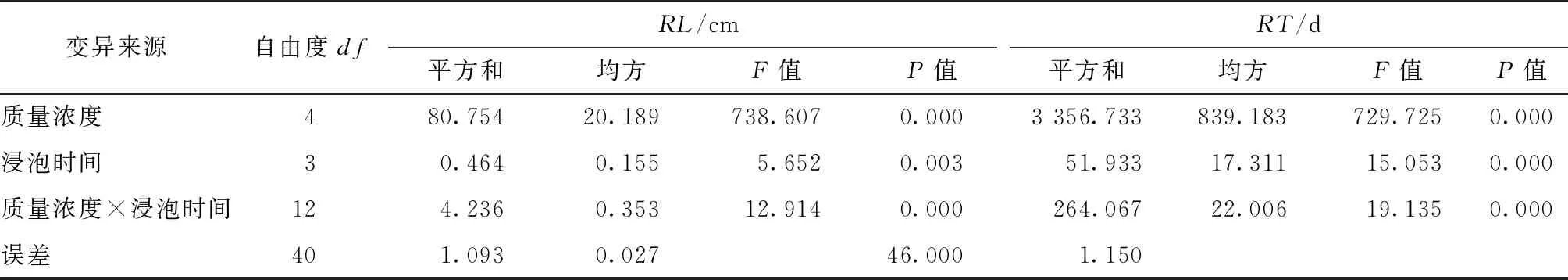
表3 IBA不同质量浓度与浸泡时间对大叶胡颓子插穗根长和生根时间的影响
采用IBA不同质量浓度与浸泡时间处理大叶胡颓子的RT较CK组均明显缩短(见表4)。随着生根剂浓度的增大,插穗的生根时间整体上呈先下降后上升的变化趋势,其中在IBA相对较低的质量浓度(100—300 mg/L)下,随着浸泡时间的延长插穗RT呈下降趋势,当IBA质量浓度达到600 mg/L时,随着浸泡时间的延长插穗RT呈先下降后上升的趋势,当IBA质量浓度的增大到1 000 mg/L时,随着浸泡时间的延长插穗RT则呈上升的趋势。从多重比较的结果可以看出,以C3T3组合处理的插穗RT最短,最短为39.33 d,与同等浸泡时间的C0T3相比,RT缩短了27 d。表明适宜质量浓度的IBA激素浸泡产生的交互作用会加快插穗形成愈伤组织,并促进插穗不定根的形成,有效缩短其平均生根时间。另外,IBA低质量浓度与较短浸泡时间的交互作用对其生根的作用较小,而IBA高质量浓度与较长浸泡时间产生的交互作用可能会对其生根产生抑制作用,这2者交互作用均表现出不同程度的延长生根时间。
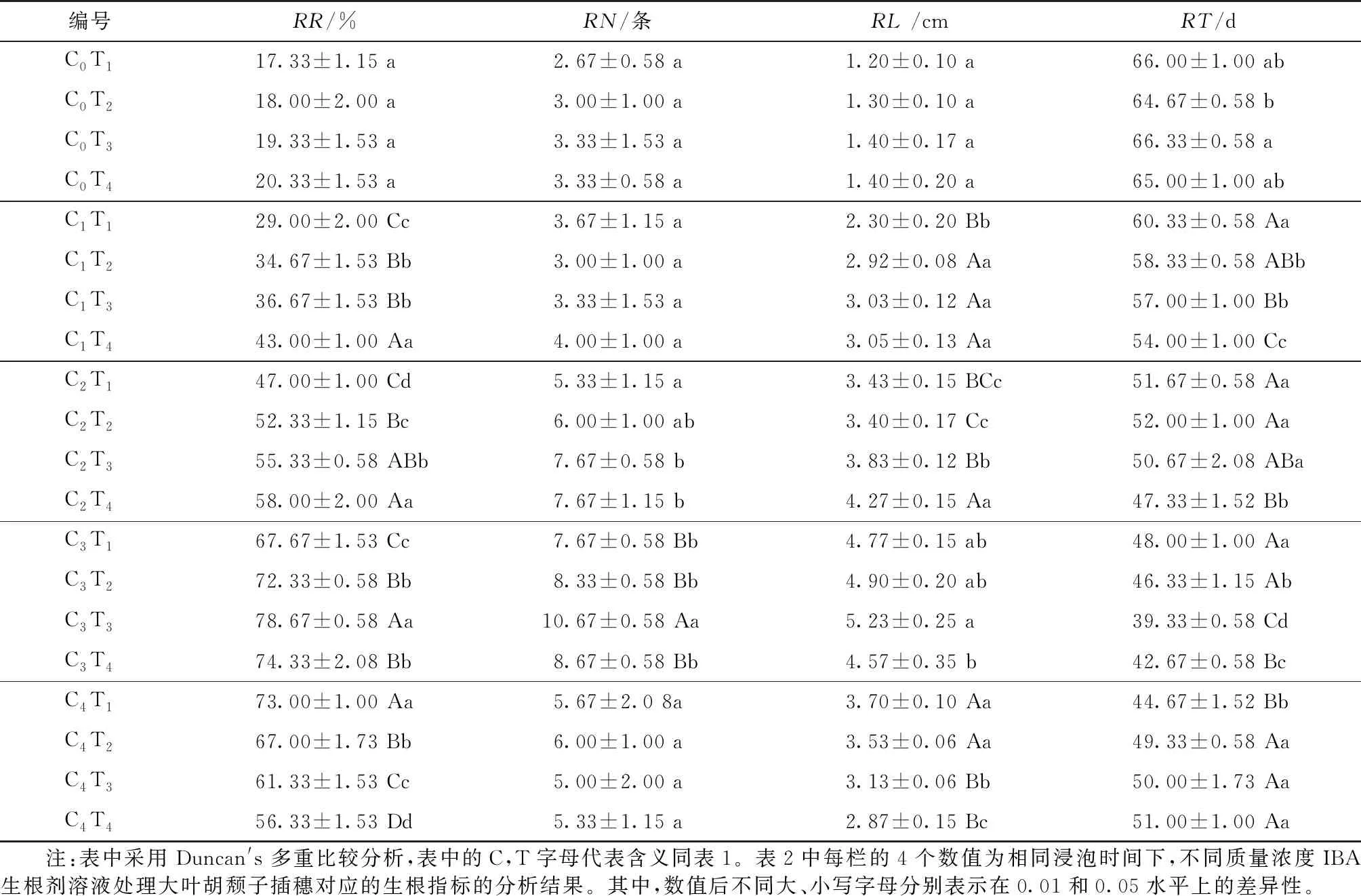
表4 IBA不同质量浓度与浸泡时间对大叶胡颓子插穗生根的影响
3 结论与讨论
影响扦插生根效果的因素很多,主要归结于内、外因素的共同作用。内部因素如树种自身遗传特性、采集穗条在母树上的位置、穗条的类型(硬枝和嫩枝)、穗条的生理年龄(采穗母树的树龄及穗条年龄)、规格(长度与粗度)、插穗上保留叶片和芽的数量、插穗基部形状等;外部因素如扦插环境的温度、湿度和光照,扦插季节、扦插基质、处理方法(选用外源植物生长激素的种类、浓度、浸泡时间)等[29-31]。
外源植物激素是影响植物扦插生根效果的关键因素之一,不同种类生根剂对插穗生根效果的影响不同,IBA作为生根剂被生产上广泛使用,这与适宜的IBA质量浓度能够有效促进植物扦插生根有关。本研究中,IBA各处理组对大叶胡颓子插穗的4项生根评价指标较对照组均有显著或极显著差异。但从生根效果来看,随着IBA质量浓度的增大,插穗的生根率、生根数和根长等指标总体上呈先上升后下降的变化趋势,而生根时间则呈先下降后上升的变化趋势,表明插穗对生根剂质量浓度的响应有一定的范围,质量浓度过高或过低均不利于大叶胡颓子插穗生根。
浸泡时间作为影响扦插生根的另一重要因素,其时间长短是相对而言的,目前常见有浸泡时间较短的“速蘸”和浸泡时间较长的“慢浸”2种方式[23]。在本研究120 min较长的浸泡时间下,100—300 mg/L相对较低质量浓度的溶液插穗生根效果好;在浸泡10 min 的较短时间下,IBA质量浓度为1 000 mg/L,插穗生根效果反而好;在中等浸泡时间60 min时,中等质量浓度的600 mg/L处理,扦插效果在整个试验结果中达到最佳。这说明浸泡时间并不是越长越好或者越短越好,插穗对外源激素生根剂的吸收只有累积到一定量时才会起作用,短时间浸泡于低质量浓度生根剂中的插穗,其基部对外源生根剂的吸收有限,从而降低了外源生根剂诱导生根的效果,但在较高质量浓度的生根剂中浸泡过长时间可能会对插穗生根产生抑制作用,因此选取适宜的浸泡时间有助于插穗生根。
目前,在外源生根剂质量浓度与浸泡时间对水栒子[32]、闽楠[33]、软枝黄蝉和黄蝉[34]等植物扦插生根影响的研究中,均发现生根剂质量浓度与浸泡时间之间存在一定的交互作用影响插穗的生根效果。本研究结果也表明,不同IBA质量浓度与浸泡时间之间存在交互作用对大叶胡颓子插穗生根有不同程度的影响,这可能与IBA在插穗生根过程中所起的作用有关,即通过调节插穗内的酶活性、营养物质和激素水平等来影响生根[35]。适宜IBA质量浓度与浸泡时间之间的交互作用能够增加插穗基部细胞膜的透性,促进插穗基部细胞从基质中吸收水分,激活水解酶、过氧化酶、吲哚乙酸氧化酶等的活性,加快水解插穗中贮存的蛋白质和淀粉等营养物质,产生大量的能量,加强插穗基部呼吸作用,同时调节插穗的内源激素水平,提高了插穗内源IAA含量,并抑制内源GA形成[36],促进根原基诱生过程中的细胞分裂活动,从而加快不定根的形成。在低质量浓度生根剂中浸泡过短时间对大叶胡颓子插穗生根的促进作用不强,这与该处理的插穗内酶活性启动较慢、营养物质水解转化的过程持续时间较长、对内源激素的调节能力较弱有关。而插穗长时间浸泡于IBA高质量浓度溶液中短期内会使细胞膜透性增加,但长时间浸泡可能会对插穗产生毒害作用,破坏细胞膜,并使插穗内激素紊乱,增加扦插生根过程中插穗基部的腐烂率,反而抑制插穗生根。
本研究通过测定和分析大叶胡颓子插穗扦插后的一系列生根指标,综合考虑多种因素,采用IBA质量浓度为600 mg/L浸泡60 min组合处理大叶胡颓子插穗的生根效果较好,可作为生产上扦插育苗的处理方法之一。另外,此次研究仅选择了生产上常用的单一种类生根剂研究对大叶胡颓子扦插的影响,而对于多种植物激素以不同配比作为生根剂使用后对大叶胡颓子生根的效果,以及不同扦插基质配比对大叶胡颓子扦插生根的影响,大叶胡颓子扦插生根过程中插穗内起调节作用的内源激素的变化等方面尚未进行系统研究,因此,不同比例的多种生根剂混合、不同扦插基质配比等多因素对大叶胡颓子插穗生根的影响,以及大叶胡颓子扦插生根的机理等方面有待后续进行深入研究。

