柳树种质核DNA含量的流式测定
何旭东,郑纪伟,王 宇,教忠意,诸葛强
(1. 江苏省林业科学研究院,江苏 南京 211153; 2. 江苏省农业种质资源保护与利用平台柳树资源圃,江苏 南京 211153;3. 南京林业大学,江苏 南京 210037)
基因组大小是生物最基本的特征之一,通常用未复制的单倍体或配子细胞核DNA的总含量来估算,即C值(C-value),一般用皮克(10-12g)表示[1]。DNA含量C值的研究意义重大,特别是在细胞生物学、发育生物学、进化生物学、分子生物学、分类学、生理学与古生物学等研究领域[2-4]。近年来,大量的研究发现,C值还与种子质量、光合速率、叶细胞大小、气孔密度、基因组进化模式等存在一定的相关性[5]。Bennett等[6]建立了植物C值数据库(https:∥cvalues.science.kew.org),截止目前共收录了12 273 个物种核DNA含量的C值信息,包括被子植物类、裸子植物类、蕨类、苔藓类和藻类。不同植物间C值差异较大,已知几种藻类如红藻(Galdieriasulphuraria)、微藻(Ostreococcustauri)、类蓝藻(Cyanidiumcaldarium)的C值最小,只有0.01 pg,最大的为日本重楼(Parisjaponica),C值达到152.23 pg。
柳树属杨柳科(Salicaceae),通常指钻天柳属(Chosenia)和柳属(Salix)包含的所有树种。全世界柳树有500种以上,而中国是柳树的分布中心,据中国植物志记载,我国有柳树257种,其中2/3为灌木柳。自古以来,柳树是我国重要的园林绿化树种,也是不可或缺的防护及用材树种[7]。在北美及欧洲,柳树还被广泛用于生物质能源[8]。柳树生长迅速、繁殖容易、基因组大小适中,是木本植物开展遗传学与基因组学研究的理想模式树种[9]。由于柳树种类繁多、变异丰富、种间及种内杂交极为容易,导致其系统分类极为复杂,迄今为止国内外学者仍有较大争议。根据植物C值数据库查询,目前国外仅有15份(14个种)的柳树C值检测结果,占柳树总数量的3%不到,而国内尚未见相关报道(见表1)。鉴于此,本研究利用流式细胞仪检测22份柳树不同种质的核DNA含量,并估算其基因组大小,旨在为柳树系统分类、细胞生物学及基因组学的研究提供理论依据。
1 材料与方法
1.1 试验材料与标样
本研究试验材料包含柳树14个自然种和8个品种,共计22份种质材料,其中乔木柳10份,灌木柳12份(见表2)。所有植株均定植于江苏省林业科学研究院柳树种质资源圃内。采集各植株幼嫩叶片备用。大豆(Glycinemax,1C=1.13 pg)由南京农业大学惠赠,在本试验中作为灌木柳样品的内标;水稻日本晴(Oryzasativasubsp.Japonica‘Nipponbare’, 1C = 0.397 5 pg)由江苏省农业科学院惠赠,在本试验中作为乔木柳样品的内标。
1.2 试验方法
1.2.1 解离液与荧光染料 选用LB01为解离液,具体配方为:15 mmol/L Tris, 2 mmol/L EDTA,0.5 mmol/L 四盐酸精胺,20 mmol/L NaCl,80 mmol/L KCl,0.1%(V/V)TritonX-100,pH值为7.0—8.0;选用终浓度为50 μg/mL的碘化丙啶(PI)为荧光染料。均于冰箱4 ℃保存备用。
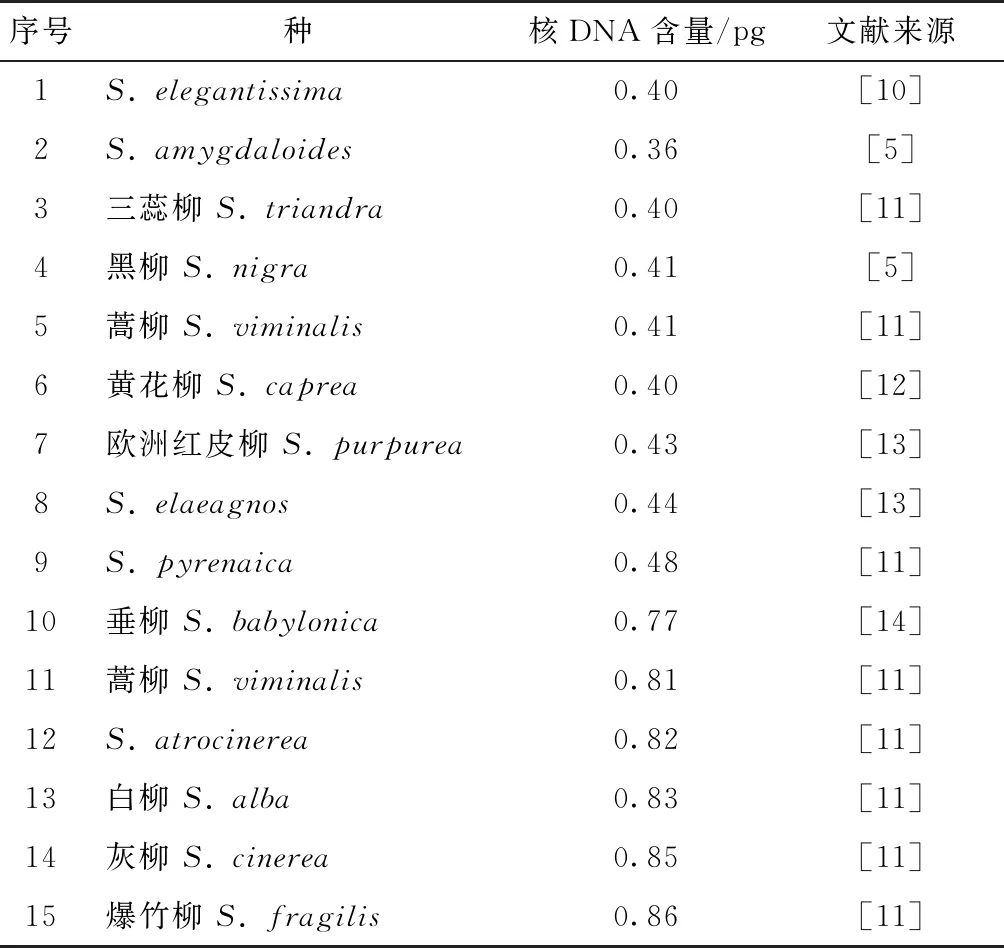
表1 已发表的柳树不同个体核DNA含量(1C值)
1.2.2 细胞核悬液制备与染色 各取1 g左右待测样品及内标材料幼嫩叶片置于培养皿中,加入1 mL LB01解离液,用刀片快速切碎叶片。吸取上清液于400目滤网过滤,置于冰上孵育5 min,4 ℃,1 000 r/min离心5 min。吸取上清并加入10 μg/mL的RNase,随后加入0.5 μL PI荧光染料,混匀后置于冰上避光孵育20 min上机检测。
1.2.3 上机检测 流式细胞仪为美国BD公司的Influx系统,荧光激发波长为488 nm,低速检测,每次收集颗粒10 000个。先分别以大豆和水稻单独上机检测,记录相对荧光强度范围。每个样品重复检测3次。变异系数(CV)控制在5%以内。
1.3 数据分析
利用流式细胞仪自带软件FACSTM Software进行数据采集及分析。待测样品核DNA含量(1C值)计算表达式为(待测样本G0/G1峰荧光强度 / 标样G0/G1峰荧光强度)×标样细胞核DNA含量(1C值)[5]。DNA含量与基因组大小换算表达式为1 pg DNA=978 M bp[15]。利用SPSS软件进行统计与方差分析。
2 结果与分析
2.1 标样荧光范围的确定
为减小试验误差,本研究采用待测样品与内标混合测定的方法进行检测。混合检测前,单独对内标进行上样检测。结果表明:水稻‘日本晴’的荧光强度在10 000附近,大豆荧光强度在22 000附近。经查询,已发表的灌木柳自然种基因组C值为0.4 pg左右,乔木柳自然种基因组C值为0.8 pg左右(见表1)。由于核DNA含量与荧光强度成正比,为使待测样品与内标荧光强度峰值能有效区分,因此选择水稻为乔木柳待测样品内标,且样品峰位于内标峰的右侧;选择大豆为灌木柳待测样品内标,且样品峰位于内标峰的左侧。
2.2 基因组C值的测定
分别将22个柳树待测样品与内标混合上机,检测结果如图1,2所示,样品峰与内标峰清晰且无重叠,区分度较好,表明本试验结果可靠。经系统自带软件收集数据并经统计分析后,得到22个个体的核DNA含量与基因组大小值(见表3)。
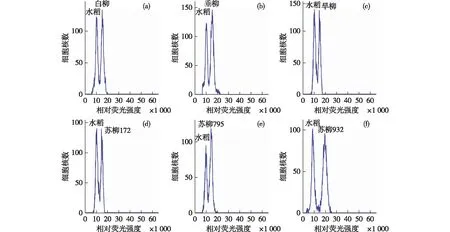
图1 部分乔木柳种质与内标水稻‘日本晴’混合上样检测结果
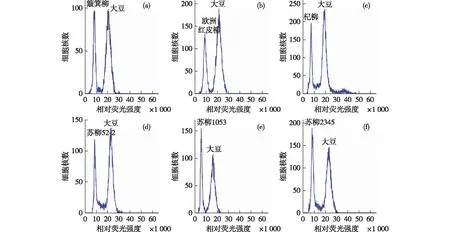
图2 部分灌木柳种质与内标大豆混合上样检测结果

表2 试验材料
按自然种与品种不同类型分析,自然种中,龙爪柳核DNA含量1C值最大,为0.67 pg,基因组大小为660 M bp;其次为垂柳,核DNA含量1C值为0.60 pg,基因组大小为582 M bp;蒿柳核DNA含量1C值最小,为0.38 pg,基因组大小为369 M bp。品种中,苏柳932核DNA含量1C值最大,为0.90 pg,基因组大小为876 M bp;其次为苏柳1011,核DNA含量1C值为0.87 pg,基因组大小为847 M bp;苏柳1053最小,核DNA含量1C值为0.39 pg,基因组大小为385 M bp。
按乔木柳与灌木柳不同类型分析,乔木柳中,苏柳932核DNA含量1C值最大,其次为苏柳1011,粉枝柳核DNA含量1C值最小,为0.43 pg,基因组大小为417 M bp。灌木柳中,灰柳核DNA含量1C值最大,为0.60 pg,基因组大小为588 M bp;其次为欧洲红皮柳,核DNA含量1C值为0.47 pg,基因组大小为459 M bp;蒿柳核DNA含量1C值最小。
2.3 基因组C值的比较
多重比较分析表明:柳树大部分个体间核DNA含量1C值存在显著差异(P<0.05),部分个体间没有显著性差异,如垂柳、灰柳与苏柳795,细柱柳、银柳、苏柳2345、苏柳52-2与苏柳9-6(见表3)。进一步将22个个体划分成乔木柳和灌木柳2个组,方差分析结果表明:乔木柳和灌木柳组间存在极显著差异(P<0.01,见表4)。
3 结论与讨论
早期的研究认为,物种的DNA C值具有特异性,是恒定不变的,但随着样本来源的多样化及检测量的增加,越来越多的研究表明同一物种的不同个体间DNA C值也存在一定的差异[16]。本研究选取的22个待测样本中,有5个与C值数据库中已公布的种相同。其中,蒿柳(0.38 pg)和欧洲红皮柳(0.47 pg)与数据库中公布的C值数据差异不大(蒿柳0.41 pg,欧洲红皮柳0.43 pg),但垂柳(0.60 pg)、白柳(0.59 pg)和灰柳(0.60 pg)与数据库中公布的C值数据差异较大(垂柳0.77 pg,白柳0.83 pg,灰柳0.85 pg)。类似的结论在木兰科[17]及鸢尾属[18]的研究中也所有发现。推测其原因,最主要的可能是由于林木世代周期长、高度杂合而引起遗传背景的差异而导致。此外,不同的气候条件、生态环境、种群大小、发育阶段、取样部位等也可能导致检测的差异[16,19]。

表3 不同柳树种质的核DNA含量(1C值)
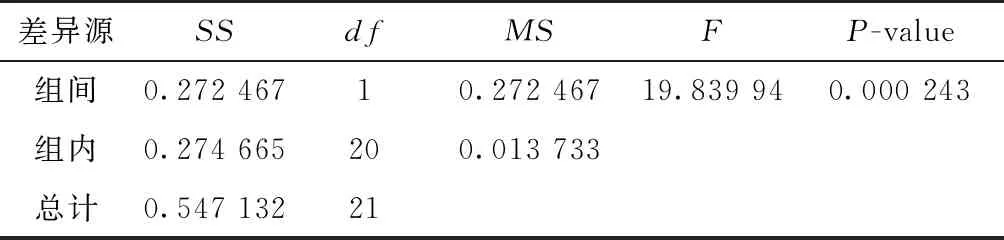
表4 不同类型柳树核DNA含量的方差分析
基因组中重复序列的变化和多倍化事件是真核生物基因组进化产生差异的主要原因。杨柳科植物起源于同一个古四倍体祖先,在逐步进化过程中,重新二倍化后形成杨树和柳树2大进化分支[20]。相比杨树,柳树进化更加完全,由于其独特的生物学特性而导致基因组不断的多倍化,形成了从二倍体(2n=38)到十二倍体(2n=228)的完整倍性体系[7]。有研究表明,同一类群中,物种的DNA C值与倍性水平呈正相关,即C值随着倍性的增加而增大[21]。本研究中,通过表4方差分析可知,乔木和灌木2种类型间核DNA含量存在极显著差异,且乔木类型要高于灌木类型。在自然界中,通常情况下灌木柳大多为二倍体,如簸箕柳、杞柳欧洲红皮柳等,而乔木柳大多为多倍体,如垂柳、白柳、旱柳等,多为四倍体[7]。
在乔木类型中,钻天柳属于钻天柳属,而钻天柳属是介于杨属和柳属之间的过渡类型。据文献记载,钻天柳是二倍体[7],因此其核DNA含量(0.48 pg)相比较其他乔木柳要小很多。而几个乔木柳品种如苏柳172、苏柳932和苏柳1011由不同乔木柳杂交而来,属异源多倍体,其核DNA含量相比较其他乔木柳自然种要大很多。但几个灌木柳品种如苏柳2345、苏柳52-2和苏柳9-6在杂交后其核DNA含量相比其他灌木柳自然种差异不大。推测其原因,一方面可能是由于本研究中的待测样本与杂交亲本个体本身差异引起,另一方面可能是由于多倍体染色体组配对与重组更为复杂造成的[16]。此外,乔木类型中的粉枝柳(0.43 pg)和灌木类型中的灰柳(0.60 pg)在各自类型中与其他个体数值差异较大,推测可能是由于倍性差异而导致,有待于进一步的核型分型来确认。

