白藜芦醇通过抑制系膜区细胞增殖下调PDGF-B、TGF-β1表达减缓大鼠IgAN进展
冀 贺,王艳红,于 洋,常思佳,黄太平,王娟娟,杨 佳,田继华
(1.山西医科大学微生物学与免疫学教研室; 2.太原钢铁(集团)有限公司总医院病理科,山西 太原 030001)
IgA肾病(IgA nephropathy,IgAN)是全球最常见的肾小球疾病[1],由Berger J于1968年首次报道。IgAN的病理特点是IgA在肾小球系膜区沉积,沉积物主要由IgA组成,有时与IgG或补体成分如补体C3结合。患者血清IgA水平升高,出现蛋白尿、镜下或肉眼血尿。该病患者易进展成为终末期肾病(end-stage renal disease,ESRD),确诊后的20年内发病率超过25%[2]。就IgAN全球的发病率来看,该病在亚洲地区的发病率最高,而且亚州IgAN患者更易进展为ESRD,这一点也已经到得证实,因此,IgAN是亚洲人群发生ESRD最主要的原发性肾小球疾病[3]。
SirT1是存在于哺乳动物中的一种依赖NAD+的去乙酰化酶[4],可以对组蛋白、相关转录因子、信号传导分子中特定的赖氨酸残基进行脱乙酰化,导致异染色质形成和基因沉默,从而参与调控多种代谢途径及细胞过程,包括细胞增殖与分化、葡萄糖稳态、脂肪代谢、细胞凋亡、衰老和长寿等。白藜芦醇是SirT1的一种常用激活剂,它存在于葡萄等天然植物中,是一种多酚化合物[5]。它的功能繁多,具有抗氧化、抗自由基、抗癌、抗突变以及心脏保护、神经保护、预防肝脏损伤等作用。本研究主要探讨SirT1激动剂白藜芦醇对IgAN大鼠的治疗效果及作用机制。
1 材料与方法
1.1 药物白藜芦醇(货号:V900386-5G,美国Sigma公司),在生理盐水中加入羧甲基纤维素钠(CMC-Na)制备0.5% CMC-Na溶液,再将白藜芦醇加入CMC-Na溶液中,得到均匀分散的白藜芦醇悬浮液,浓度为20 g·L-1。根据查阅文献和前期的预实验结果将白藜芦醇灌胃浓度定为200 mg·kg-1·d-1。
1.2 试剂白藜芦醇购自美国Sigma公司;牛血清白蛋白(BSA)购自北京索莱宝科技有限公司;蓖麻油、四氯化碳(天津市光复精细化工试剂有限公司);丽春红S购自上海生物工程有限公司;PAS染液、Masson染液(山西百奥生物技术有限公司);Anti-PDGF B抗体、Anti-TGF-β1抗体、兔抗大鼠IgG H&L(HRP)、FITC标记兔抗鼠IgA抗体、兔抗大鼠IgA和FITC标记羊抗兔IgG均购自美国Abcam公司;抗荧光衰减封片剂(武汉博士德生物)。
1.3 动物健康清洁级Wistar大鼠24只, 雄性,6周龄,体质量(150±10)g,由山西医科大学动物实验中心提供(合格证号为SCXK(晋)2019-0004)。大鼠适应性喂养1周,状态良好,反应灵敏、毛发整齐有光泽,两次尿蛋白定性试验均为阴性。
1.4 方法
1.4.1IgAN大鼠动物模型的建立 脂多糖+四氯化碳+牛血清白蛋白的方法建立IgAN模型是国内IgAN最常应用的造模技术,我们采用此方法进行造模。IgAN模型建立:实验d 1牛血清白蛋白灌胃(400 mg·kg-1·d-1),连续6周;皮下注射蓖麻油0.5 mL+四氯化碳0.1 mL,1周1次,持续9周;第6周、8周尾静脉注射脂多糖(0.05 mg/只),观察至12周末。将肾皮质组织切成3 μm的冰冻切片,采用兔抗大鼠IgA和FITC标记羊抗兔IgG间接免疫荧光染色,荧光显微镜下观察肾小球系膜区IgA沉积阳性,PAS和Masson染色显示系膜细胞增生和系膜基质产生沉积表明造模成功。
1.4.2实验分组及药物干预 将所有大鼠随机分成以下4组:正常对照组、IgAN组、正常对照+Res组(200 mg·kg-1·d-1)和IgAN+Res组(200 mg·kg-1·d-1),每组8只;IgAN组按上述造模方法给药,正常对照组给予生理盐水,12周末,正常对照组和IgAN组各处死2只大鼠,观察造模情况;Res给药组12周末开始灌胃给药,16周末剩余大鼠股动脉取血,之后将所有大鼠处死。将大鼠肾脏取出,一部分肾组织于4%多聚甲醛中固定,用于后续免疫荧光和免疫组化等各项检测。
1.4.3尿蛋白检测及生化指标检测 在实验的第4、8、12和16周末,各组大鼠禁食、不限制饮水,代谢笼收集大鼠24 h尿液。采用丽春红S法进行尿蛋白定量分析。16周末腹腔静脉取血5 mL,室温静置30 min后,离心分离血清,用DxC800型自动生化分析仪检测各项生化指标,包括血肌酐(Scr)、尿素氮(BUN)、血清总蛋白(TP)和白蛋白(ALB)。
1.4.4PAS和Masson染色法观察肾脏病理改变 肾组织在10%中性福尔马林中固定24 h以上,然后用酒精对组织进行脱水,经二甲苯透化、浸蜡、石蜡包埋,切片,置于60 ℃烤箱2 h之后,进行PAS(过碘酸雪夫)染色及Masson染色,封片后显微镜下观察结果,摄片并分析。
1.4.5免疫荧光观测IgA沉积 取新鲜肾组织于OCT包埋液中进行快速冷冻,组织冰冻块固定在组织卡盘中,置于冰冻切片机进行连续切片,厚度为4 μm,逐片收集;用丙酮固定10 min后放置室温进行干燥;擦去多余的OCT,4%马血清37 ℃封闭1 h,PBS洗3次,每次10 min,之后置于室温下微干,滴加FITC标记的兔抗鼠IgA抗体(1 ∶100)置于暗盒中4 ℃过夜;放置室温晾干并进行封片,之后共聚焦显微镜下观察,摄片。
1.4.6免疫组化法检测PDGF-B、TGF-β1 肾组织在10%中性福尔马林中固定24 h以上,制备组织切片。首先对组织切片进行脱蜡复水处理:切片室温放置1 h后浸泡二甲苯2次,每次10 min,切片放入梯度乙醇,每次处理均为5 min,孵育;微波抗原修复,之后10%羊血清进行封闭并置于室温60 min,去除封闭液后加PDGF-B、TGF-β1的一抗(1 ∶100稀释),湿盒4 ℃孵育过夜;d 2滴加二抗工作液,37 ℃孵育30 min,显色剂(DAB)显色,脱水封片后镜下观察,摄片。

2 结果
2.1 白藜芦醇明显减少24 h尿蛋白量造模前各组大鼠蛋白尿定性阴性,IgAN组在造模第4周末开始出现少量的尿蛋白,后持续升高,12周末达到(19.67±4.15) mg·d-1,与对照组比较有显著差异(P<0.01);16周末,IgAN组蛋白尿仍继续增长,而白藜芦醇干预治疗组,尿蛋白由(21.45±3.98)mg·d-1降低至(12.32±2.86) mg·d-1,差异具有显著性(P<0.01)(Tab 1)。
2.2 白藜芦醇对IgAN大鼠肾功能的影响16周末,干预组与对照组TP、ALB均未明显改变(P>0.05);与对照组比较IgAN组BUN、Scr略微升高,差异具有统计学意义(P<0.05);白藜芦醇干预4周后,BUN、Scr恢复为正常值,与IgAN组比较差异有显著性(P<0.05)(Tab 2)。

Tab 2 The biochemical indexes in different

Tab 1 The urine protein quantification in different mg·d-1,n=8)
2.3 白藜芦醇减少肾小球IgA的沉积12周末可见IgAN组系膜区已有显著的荧光沉积,16周末正常对照组只有很少的荧光,IgAN组可以观察到大量荧光沉积在系膜区,而白藜芦醇干预的IgAN组,荧光沉积明显减少,说明白藜芦醇可以有效抑制IgA在肾小球的沉积,见Fig 1。
2.4 白藜芦醇抑制IgAN大鼠模型系膜区细胞增殖,减少系膜基质沉积PAS和Masson染色结果光镜下可以观察到,对照组大鼠肾组织结构正常,IgAN组在12、16周末主要表现为系膜区细胞及基质的增生,肾小球出现肿胀、体积增大,与临床IgAN病理改变一致;而白藜芦醇干预治疗4周后肾小球体积显著减小,系膜区细胞及基质增生明显受到抑制,见Fig 2。
2.5 白藜芦醇可抑制IgAN大鼠TGF-β1、PDGF-B的表达IgAN系膜区细胞增殖后,会释放一系列细胞因子,其中PDGF-B、TGF-β1是重要的纤维化因子,可促进细胞外基质的释放。结果显示,IgAN组PDGF-B、TGF-β1表达较对照组明显增高(P<0.01),IgAN+Res组较IgAN组的表达显著减少(P<0.01),通过棕色颗粒光密度分析,可观察到白藜芦醇显著下调PDGF、TGF-β1的表达,见Fig 3。
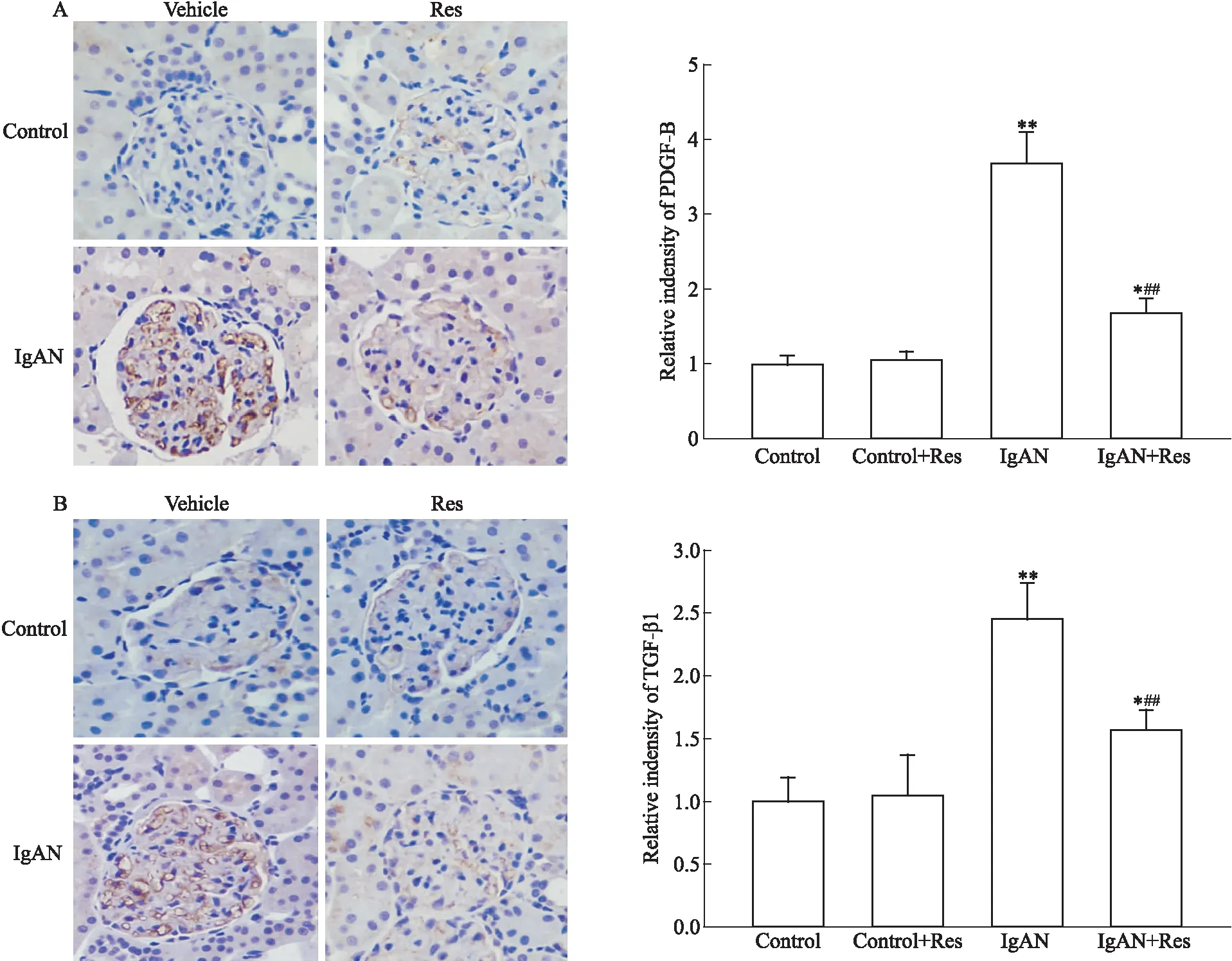
Fig 3 Expression of PDGF-B and TGF-β1 after resveratrol A:PDGF-B; B:TGF-β1. *P<0.05,**P<0.01 vs control group;##P<0.01 vs IgAN group
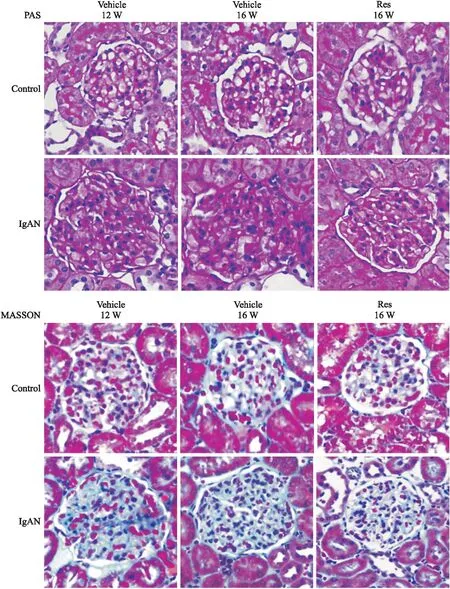
Fig 2 Changes of glomerular mesangial cells and matrix after resveratrol intervention

Fig 1 IgA fluorescence deposition in glomerular mesangial area after resveratrol intervention(confocal microscope, ×200)
3 讨论
近些年,白藜芦醇对肾脏的保护作用引起了越来越多研究者的关注[6]。在糖尿病肾病小鼠模型中,白藜芦醇可有效缓解小鼠模型的高血糖、高血脂,改善肾脏结构与功能,同时降低氧化应激水平、减轻炎性细胞浸润。在肾小球肾炎、肾纤维化、多囊肾病等疾病中,经白藜芦醇干预后的动物模型的肾功能也都得到了相应改善。另外,在临床实验中,白藜芦醇给药可以使慢性肾脏病患者的肾脏滤过率增加。以上这些均说明白藜芦醇对人的肾脏具有潜在的保护作用,白藜芦醇对健康的益处是广泛存在的。但是,目前关于白藜芦醇治疗IgAN的研究报道非常少。Chang等[7]研究证实:白藜芦醇通过保持线粒体完整性和增强自噬作用来抑制NLRP3炎症小体的激活,从而减轻IgAN小鼠模型的肾小球增生、硬化和炎症。周敏[8]证实:白藜芦醇可以明显下调IgAN大鼠IL-5的表达,同时降低血清循环免疫复合物的浓度。本实验证明:白藜芦醇可以通过3个关键环节延缓IgAN的进展。因此,白藜芦醇对IgAN的治疗作用是毋庸置疑的,只是具体的机制并不十分明确,还有待进一步研究。
本次实验,我们使用的是IgAN的大鼠模型。实验第4周,IgAN大鼠开始出现蛋白尿,之后不断增加,在第16周时达到最高值。12周末使用白藜芦醇进行干预,4周后观察到大鼠蛋白尿明显减少。在本次实验中,IgAN大鼠的肾脏功能参数并没有发生明显变化。在第16周时,肾病组的肌酐值高于对照组,但白藜芦醇干预组没有发现肌酐变化。以上结果表明,IgAN在疾病的早期肾功能可以维持正常,而后期持续性蛋白尿使肾功能受到影响,因此蛋白尿是该病发展为慢性肾病的危险因素。虽然在一开始肾功能变化并不非常明显,但它们会继续恶化;而白藜芦醇能够显著减轻蛋白尿,从而起到保护肾功能的作用。
IgAN至今仍然病因不明,其发病机制也与多种因素相关,目前公认的观点是:IgAN是一种由免疫复合物沉积引起的肾小球疾病[9]。IgAN患者体内含有大量缺乏半乳糖残基的IgA[10],结构的异常使其能够逃避肝细胞和单核细胞的吞噬作用,并形成免疫复合物沉积在系膜区;IgA与肾小球中性粒细胞和系膜细胞受体结合后刺激细胞增殖,之后导致多种细胞因子释放,这些细胞因子继续加重细胞和细胞外基质增殖与聚集,最终导致间质纤维化[11-13]。
此次实验的结果表明,白藜芦醇能够明显减少IgA免疫复合物在系膜区的沉积。IgAN患者大多存在半乳糖链缺失型IgA的升高,但这仅仅是发展为IgAN的一个诱发因素,IgA必须形成复合物并沉积在肾小球系膜区才能引发IgAN[11]。经过白藜芦醇4周的治疗,与对照组比较可以观察到IgA的荧光强度明显减弱,证明白藜芦醇能够抑制IgA沉积;只是经过白藜芦醇干预后仍然存在较明显的IgA沉积,这一结果提示,白藜芦醇无法起到逆转已沉积IgA的作用。那么白藜芦醇是如何抑制IgA的沉积的呢?这可能与白藜芦醇能够抑制淋巴细胞的增殖和功能相关,但具体的作用机制有待我们进一步研究。细胞增殖在IgAN的整个发病过程中起着重要作用,而免疫复合物的沉积可以刺激系膜区细胞增殖,其大量增殖又可以导致细胞因子和细胞外基质的释放,最终引起肾小球硬化[14]。本实验在白藜芦醇干预治疗4周后,我们用PAS和Masson染色,结果显示肾小球体积明显减小,同时系膜区细胞与基质增生受到明显抑制。
系膜细胞和炎性细胞的异常增殖能够使它们产生大量的细胞因子,如血小板源性生长因子(platelet-derived growth factor,PDGF)和转化生长因子-β1(transforming growth factor β1,TGF-β1)。PDGF是间充质细胞的有丝分裂原和趋化剂,是一种重要的促有丝分裂因子,能促进纤维母细胞、平滑肌细胞、神经胶质细胞等分裂。PDGF是参与肾脏疾病整个疾病过程最具特征的生长因子之一,激活的PDGF信号诱导纤维样母细胞合成大量细胞外基质并沉积于细胞间质,从而促进纤维化的发生。PDGF有3种二聚体结构形式:PDGF-AA,PDGF-BB和PDGF-AB,其中促进纤维母化作用最强的是BB型式。TGF-β超家族有调节细胞生长和分化的作用,TGF-β1为其中的一员,它对细胞的形态、增殖和分化过程起着重要的调节作用,能通过诱导细胞凋亡、细胞骨架移位或细胞骨架丢失而导致足细胞损伤。已有研究证实,TGF-β1及PDGF-B表达增多与肾小球硬化关系密切[15-16]。我们发现,与对照组相比,IgAN组中两者的表达均有明显增加,而白藜芦醇则可以明显减少肾小球PDGF-B和TGF-β1的表达。肾小球系膜细胞、细胞因子和细胞外基质3者之间相互影响,相互促进是IgAN进展的主要原因,而白藜芦醇则可以分别作用于3者,从而起到了阻止IgAN进展的作用。
IgAN的治疗主要包括免疫治疗和非免疫治疗,治疗方案主要包括以下四个方面[17-18]:使IgA免疫复合物的合成减少;限制IgA免疫复合物在系膜区的沉积;通过拮抗PDGF和TGF的作用,达到抑制细胞增殖和细胞外基质释放的作用;减轻浸润性中性粒细胞对肾小球的损害作用。而此次研究证明,白藜芦醇能够直接或间接通过多个关键环节干扰IgAN发展为ESRD。这些关键环节包括:使IgA免疫复合物的沉积减少;使系膜区细胞增殖及细胞外基质的分泌得到抑制;还可以使促纤维化生长因子PDGF-B和TGF-β1的表达下调,从而起到减缓IgAN进展的作用。
综上所述,白藜芦醇作为一种细胞保护性药物可以通过多个环节对 IgAN起到明显的改善作用和延缓疾病进展的作用。此次实验也将为 IgAN患者的临床治疗提供新的思路。

