孕期糖皮质激素暴露所致子代长骨发育异常研究进展
王佳琪,倪曲波,肖 浩,汪 晖,陈廖斌
(1.武汉大学中南医院骨科, 2.发育源性疾病湖北省重点实验室, 3.武汉大学基础医学院药理学系,湖北 武汉 430071)
糖皮质激素(glucocorticoid,GC)是肾上腺皮质产生的主要激素,在妊娠过程中对胎儿各脏器的分化发育有一定促进作用。人工合成GC用于治疗有早产风险的孕妇已有近40年历史,其能通过促进肺表面活性物质的合成,增强肺表面张力,实现促胎肺成熟,有效减少早产儿呼吸窘迫综合征发生和死亡率,但可使胎儿内源性GC水平降低。同时,临床回顾性研究及动物实验发现,母亲在妊娠期间暴露于尼古丁、乙醇、咖啡因[1]等外源物可导致母体血GC水平异常升高,其可通过胎盘进入胎儿体内,导致胎儿血GC高于正常生理浓度。近年来研究表明,孕期使用人工合成类GC或暴露于不良环境后所致胎儿血GC水平异常,可引起胎儿神经内分泌代谢编程改变,导致胎儿低出生体重及多种脏器发育障碍。已有研究表明,胎源性骨质疏松症与孕期异常GC暴露有关[2]。因此,胎儿血GC是影响胎儿包括骨在内的多器官分化发育的重要因素。基于此,该综述着眼于当下孕期GC暴露现状,对孕期内外源性GC暴露所致胎儿长骨发育异常现象进行总结,并概述其表观遗传学和内分泌代谢编程机制。
1 孕期糖皮质激素暴露现状及分类
由于工业化导致环境中各种污染物水平增加,女性孕期与各种不良环境的接触机会增多。作为孕期一类常用药物,人工合成GC(如地塞米松等)在临床中的应用也较为广泛。
1.1 孕期不良环境所致母源性糖皮质激素过暴露孕期不良环境是指包括外源环境因素(如:外源物暴露、微生物感染等)和母体健康因素(如:营养不良、妊娠合并疾病等)在内的多种负面因素。宫内发育迟缓(intrauterine growth retardation,IUGR)是指各种原因导致的胚胎或胎儿生长发育限制,表现为多器官功能发育障碍、生长迟缓及低出生体重。不良环境是除先天因素以外造成胎儿IUGR的重要因素。已知,宫内GC对胎儿各脏器的分化发育有一定促进作用,但过高水平GC则会导致胎儿发育障碍(如:IUGR等),其潜在机制可能与母体高水平血GC通过胎盘到达胎儿血中,抑制胎儿下丘脑-垂体-肾上腺(hypothalamic-pituitary- adrenal,HPA)轴,进而影响诸多器官发育有关。有动物研究表明,大鼠妊娠d 9~20接受尼古丁(2.0 mg·kg-1·d-1)皮下注射,产后早期(出生后d 1、d 7)后代体内皮质酮水平明显升高[3],而产后晚期(出生后d 35、d 60、d 100)则降低,原因是孕期尼古丁暴露导致胎儿母源性GC过暴露,限制了胎儿HPA轴的发育。同样,在孕期通过灌胃法给予乙醇4 g·kg-1·d-1的大鼠,检测到孕d 20胎儿的血清皮质酮水平明显升高[4]。此外,孕期多种不良环境暴露如外源物、微生物感染、营养、抑郁[5]等,均可导致母源性GC水平升高,使得胎儿血GC也升高,阻碍胎儿宫内发育。以上研究提示,孕期母体外源物暴露会导致胎儿母源性GC过暴露。
1.2 孕期合成类糖皮质激素应用孕妇在孕期可能使用到的有指征的外源性糖皮质激素主要包括:泼尼松、地塞米松、倍他米松、丙酸倍氯米松和氢化可的松。其具体适应症及建议用量详见Tab 1。值得注意的是,使用这些糖皮质激素治疗孕期并发症的同时,会对胎儿产生不良影响。已有文献报道,孕期使用大剂量(≥20 mg·d-1)泼尼松有可能导致死胎;孕期使用地塞米松有可能导致胎儿宫内发育迟缓,且会导致子代成年后多种代谢性疾病易感;孕期使用倍他米松有可能导致胎儿宫内发育迟缓及成年后代谢综合征易感;孕期大剂量(≥1 000 μg/次)使用吸入性糖皮质激素倍氯米松有可能导致胎儿先天畸形(主要是肌肉骨骼、心脏发育畸形)等。根据美国妇产科医师协会实践标准,妊娠24~34周合并早产风险的妇女应接受单疗程地塞米松或倍他米松肌肉注射,接受该治疗后d 7~14仍在怀孕的妇女,建议在短期效应的基础上进行多次人工合成GC治疗,以此来降低早产风险和胎儿死亡率。随着产前地塞米松治疗在临床上的广泛应用,人们更加需要考虑潜在的后续不良反应。有报道称,产前地塞米松暴露(prenatal dexamethasone exposure,PDE)与胎儿低出生体重和体型缩小有关,在妊娠d 9-20的大鼠皮下注射0.2 mg·kg-1·d-1地塞米松,在孕d 20检测到雌性胎儿血地塞米松浓度为267 nmol·L-1,为母体血清地塞米松浓度的31.6%[6],即母体内地塞米松可进入胎儿循环,并导致胎儿体重下降,IUGR率升高。这提示,将胎儿过度暴露于人工合成GC,增加了后代发育异常的风险。
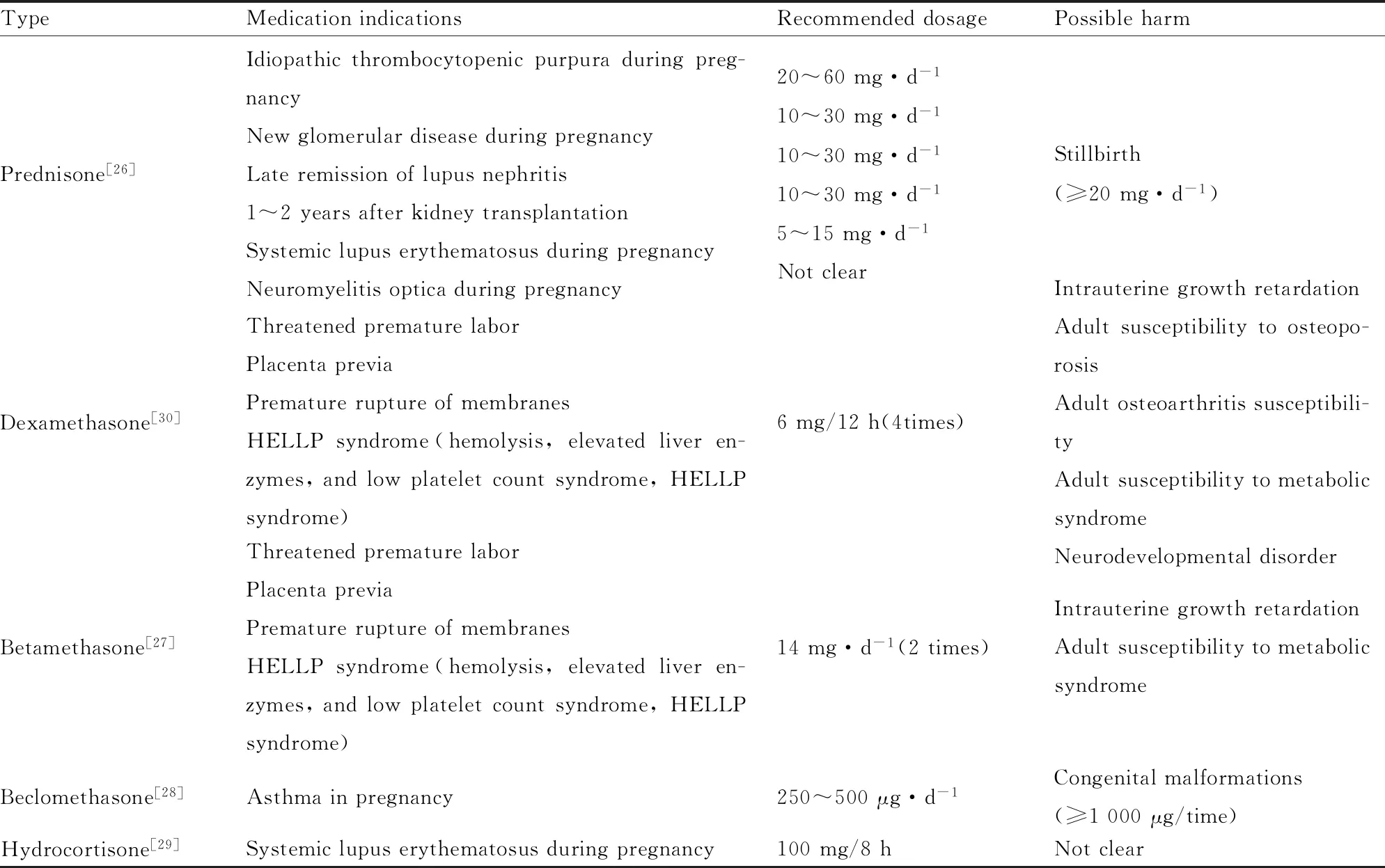
Tab 1 Indications and dosage of possible glucocorticoid use during pregnancy
2 孕期糖皮质激素暴露对子代长骨发育的近、远期影响
骨的发生起始于胚胎时期,来源于间充质,主要有两种方式,即膜内成骨和软骨内成骨。人体大多数骨,如四肢骨、躯干骨等,都以软骨内成骨方式发生。人胚胎从第四周末即开始进行软骨内成骨过程。胎儿长骨发育受血GC调控,正常的成骨过程建立在合适的血GC水平之上,过早的暴露于高GC(包括内源性和外源性)环境将阻碍长骨发育过程。
孕期内外源性GC暴露对骨发育具有近期影响和远期编程效应。其不仅可以在宫内阻碍胎儿长骨发育进程,还可引起子代成年后一系列长骨发育相关的健康问题和疾病易感。
2.1 出生前后长骨发育异常生长板(growth plate)是骨骺与骨干之间在次级骨化中心出现后保留的一层软骨细胞,是胎儿出生后长骨纵向生长的基础。在母猪妊娠最后45 d,每2 d肌肉注射地塞米松会导致其雄性后代股骨、胫骨生长板增生、肥大区厚度明显变薄[7]。多项流行病学调查表明,孕妇摄入咖啡因与胎儿体长增长受损有关。有动物研究提示,从孕d 11-20给予大鼠咖啡因(120 mg·kg-1·d-1)灌胃,母婴血GC水平均升高,胎儿体长明显减少,胎儿股骨生长板中细胞外基质成分合成明显抑制,生长板中软骨生成延迟[8]。在另一项动物研究中,用地塞米松诱导骨发育受损模型,构建的大鼠模型也表现出骨生长板狭窄、生长板软骨细胞增殖减少、凋亡增加的现象[9]。在小鼠(怀孕平均持续36~38 d)妊娠d 20开始皮下注射125 mg·kg-1·d-1地塞米松,直至产前,其后代生长板肥大区厚度明显变薄,生长板软骨细胞蛋白聚糖含量明显降低[10],地塞米松暴露会上调胫骨生长板中糖皮质激素受体(glucocorticoid receptor,GR)的表达,抑制骨的纵向生长。以上研究结果表明,孕期GC暴露会明显抑制长骨生长板的发育。
骨化中心包括初级骨化中心和次级骨化中心,是软骨内成骨过程中长骨中央和两端软骨内首先骨化的区域。孕期给予地塞米松的大鼠,H&E染色显示股骨初级骨化中心明显缩短,矿化区域变小,骨小梁长度变短,进一步研究发现,产前咖啡因暴露导致的宫内高GC环境也导致胎儿股骨长度明显缩短,初级骨化中心长度也缩短[11]。另外,孕期外源性地塞米松多次、高浓度、早期暴露对长骨和软骨发育有更强的毒性[12],表现为子代股骨初级骨化中心长度显著缩短。这些结果都表明,孕期高GC会显著影响长骨初级骨化中心的发育。
2.2 成年后骨质疏松症易感及可遗传性峰值骨量是人或动物一生中骨矿物质组织的最高含量,它可以反映骨骼的健康状况。在人类中,青春期骨质积聚的峰值率在11~14岁之间(6~12周龄的幼鼠),成年后最高峰在20~35岁之间(7~9月大鼠)。出生前24 d给予地塞米松的仔猪出生时即表现为长骨骨密度、骨矿含量降低[13]。一项对鸡胚的研究证明,产前地塞米松暴露可致发育中的鸡胚长骨缩短,并加速钙盐的沉积,降低骨量[14]。本实验室动物研究表明,产前地塞米松暴露可显著降低雄性子代峰值骨量,其骨量的降低从孕20 d一直持续到生后28周,并可以延续到孙代(雄性),其机制与地塞米松介导的血管紧张素转换酶(angiotensin-converting enzyme,ACE)组蛋白乙酰化增强有关。
孕期不良环境暴露和直接使用人工合成GC都会导致母婴血GC水平升高,引起胎儿发育迟缓和低出生体重,最终导致成年后骨质疏松症易感。对大量临床随访总结发现,在怀孕期间暴露于地塞米松会影响胚胎的成骨作用,主要原因可能是地塞米松在发育过程中对骨祖细胞产生不利影响。部分较早的临床研究表明,孕期因治疗早产所使用地塞米松治疗会影响产后胎儿的骨矿化[15]。
最新研究提示,孕期咖啡因暴露所致的母源性高GC,可以通过激活后代骨局部肾素-血管紧张素系统(renin-angiotensin-system,RAS)、抑制胰岛素样生长因子1(insulin-like growth factor-1,IGF1)的表达,抑制后代长骨发育,导致子代成年后骨质疏松症易感。孕期尼古丁暴露可以通过升高母体皮质酮,影响成骨细胞、破骨细胞的分化进程,延迟后代初级骨化中心的形成。后续研究表明,孕d 9~20适量地塞米松暴露会延缓胎鼠长骨发育、降低后代峰值骨量、增加成年鼠骨质疏松症易感性[16],并且胎鼠峰值骨量的降低具有代际遗传效应。以上研究结果都提示,孕期内源性高GC以及一定剂量的地塞米松暴露,可以导致后代成年后骨质疏松症的易感性显著升高,且这一改变具有代际遗传的特点。
3 孕期糖皮质激素暴露所致长骨发育异常的发生机制
宫内长骨的发育异常机制,主要与宫内异常GC暴露下骨发育过程中相关细胞的发育异常、骨发育相关基因表观遗传学修饰和内分泌代谢编程改变有关。孕期不良环境所致的母体内分泌代谢紊乱是后代多种代谢性疾病易感的一个主要因素。HPA轴是机体重要的神经内分泌轴,孕期不良环境(如:外源物暴露、合成类糖皮质激素直接应用)一方面可以破坏胎盘中灭活GC的11β-羟类固醇脱氢酶2(11β-HSD2),破坏胎盘对母体来源GC的屏障功能;另一方面可直接或间接使母亲HPA轴活性增加,使其效应器官——肾上腺分泌功能旺盛。两者合力使得胎儿血GC水平异常,导致胎儿包括骨在内的多器官发育障碍。
参与骨发育的细胞主要包括软骨细胞、成骨细胞、破骨细胞和血管内皮细胞。软骨内骨化过程中软骨细胞的肥大、凋亡与后续成骨细胞分化关系密切。肥大前及肥大早期由软骨细胞分泌的印度刺猬(Indian hedgehog ,IHH)蛋白控制着成骨细胞分化的开始。成骨细胞和生长板软骨细胞可以表达肾上腺素B2(Ephrin B2)等多种蛋白,促进成骨细胞分化并抑制破骨细胞形成,同时破骨细胞以打隧道的方式溶解吸收退化的软骨组织。由肥大的软骨细胞高度表达和分泌的血管内皮生长因子(vascular endothelial growth factor,VEGF)能直接刺激骨血管内皮细胞趋化、增殖和分裂,从而刺激骨血管生成。综上所述,在软骨内骨化过程中各细胞分化发育息息相关。
3.1 软骨细胞相关机制早在1997年就有研究指出,产前用人工合成GC(曲安奈德)处理的母鼠,其子代肱骨生长板软骨细胞排列更加紊乱[17]。长骨生长板软骨细胞分泌的细胞外基质(extracellular matrix,ECM)在宫内骨骼生长中起着重要作用。IGF1相关信号通路是机体内调控内分泌系统的主要通路之一,其参与包括骨在内的多种组织和器官的分化发育,IGF1/IRS途径通过调节软骨细胞早期发育过程中PI3K/Akt磷酸化来调节ECM蛋白的合成。表皮生长因子受体(epidermal growth factor receptor,EGFR)信号也参与各种骨细胞的存活、粘附、增殖、迁移和分化。内源性高GC首先通过降低胎儿生长板软骨细胞中IGF1启动子区域的H3K9和H3K27乙酰化水平,导致IGF1蛋白表达水平降低,且IGF1R、IRS1和AKT1/2的蛋白表达水平也呈降低趋势,整体上降低软骨细胞ECM合成[18];其次,内源性高GC上调丝裂原诱导基因6(mitogen-inducible gene,Mig-6)的表达,由此抑制软骨细胞中EGFR / c-Jun N末端激酶(JNK)信号通路和末端分化基因的表达并减少软骨细胞凋亡,延缓软骨内成骨进程[19],两者合力最终导致胎儿长骨发育迟缓。以上研究提示,内源性高水平GC在降低软骨细胞外基质合成的同时延缓软骨细胞终末分化和凋亡,阻碍软骨内成骨的进程。
3.2 成骨细胞相关机制成骨细胞是贴附于软骨基质表面形成新生骨组织的主力军。RAS具有调节局部细胞分化的作用,包括细胞增殖、分化和凋亡。另外,在软骨ECM合成调节中发挥主要作用的IGF1,在间充质干细胞的定向分化中也起到至关重要的作用。外源性GC(地塞米松)一方面增强骨局部ACE启动子区H3K9和H3K27乙酰化水平,并增加血管紧张素II(angiotensin II,Ang II)表达水平,表现为骨局部RAS激活,从而降低骨髓间充质干细胞的成骨分化。此外,该表观遗传学改变原理还与孕期接触外源物种类有关。如导致内源性GC水平升高的乙醇(ethanol)会介导早期生长反应因子1的高表达并促进其进入骨髓间充质干细胞核,介导ACE启动子区乙酰化水平升高[20];导致内源性GC水平升高的尼古丁(nicotine)通过作用于α4β2-烟碱乙酰胆碱受体(α4β2-nAChR),诱导组蛋白乙酰化酶p300进入骨髓间充质干细胞核,导致ACE启动子区H3K9乙酰化水平增加等[21]。另一方面内源性高GC通过诱导糖皮质激素受体(GR)进入骨髓间充质干细胞核内,募集增强子结合蛋白α,分别降低成骨细胞中IGF1的 H3K9和H3K14组蛋白乙酰化水平,导致长骨局部IGF1表达降低,使得长骨内诸如Runx2、Osterix、Ⅰ型胶原等多种成骨分化相关标志物表达降低[22],最终导致成骨分化障碍,此表观遗传学改变可以延迟到出生后。本实验室由此提出胎源性疾病宫内编程的GC-胰岛素样生长因子1(GC-insulin-like growth factor 1,GC-IGF1)轴理论:即宫内高浓度的GC通过表观遗传学机制抑制IGF1的表达,骨发育受到影响;胎儿出生后脱离宫内高GC环境,IGF1表达有所恢复,但个体对环境刺激的敏感性增加,更易受到环境对个体造成的损伤作用。GC对胎儿产生的表观遗传学影响大多是通过促进局部组织细胞内GR核转位实现的。
3.3 破骨细胞相关机制在骨发育过程中,随着血管、成骨细胞、破骨细胞及其祖细胞侵入肥大软骨细胞区,破骨细胞降解矿化的肥大软骨细胞,为骨细胞的沉积提供空间。因此从长骨发生的角度来讲,破骨细胞数量的增加会加速矿化软骨基质的降解,从而增强软骨内骨化。核因子κB受体活化因子配体(receptor activator of nuclear factor-κB ligand,RANKL)及其受体RNAK和其诱饵受体骨保护素(osteoprotegerin,OPG)是调节破骨细胞形成的关键分子,参与骨发育和骨代谢。孕期内源性高GC暴露的胎儿经TRAP染色显示,股骨软骨-骨交界处破骨细胞数量明显减少。虽然RANKL的mRNA表达没有明显受到GC的影响,但骨局部OPG mRNA表达明显上调,使得骨局部RNAKL/OPG比值显著降低,因此软骨-骨交界处破骨细胞数量也降低,延迟了软骨内成骨进程[23]。但在体外,外源性GC(如地塞米松)可以刺激破骨细胞的增殖和分化,抑制成熟破骨细胞的骨吸收活性[24],体现GC作用的双相性,原因可能和个体发育阶段有关。
3.4 血管内皮细胞相关机制VEGF-A是血管内皮细胞特异性的结合生长因子,可在体内诱导血管内皮细胞增殖、增加血管通透性。外源性GC(如地塞米松)暴露可使软骨细胞VEGF-A表达增强,促进雏鸡胚胎中趾骨内的血管生成、增殖和迁移。内源性高GC还会降低胎盘VEGF120和VEGF188亚型的表达,并在短期内阻止正常胎盘迷宫血管的发育[25]。由于GC可以通过胎盘进入胎儿体内,由此我们可以推测,内、外源性GC可能通过诱导骨局部VEGF相关亚型表达降低,从而抑制骨局部血管生成,抑制骨发育。
4 总结展望
综上所述,孕期内、外源性GC暴露会对子代长骨发育产生深远的影响,其发生机制见Fig 1。由于临床产科地塞米松应用的剂量、时间、疗程不尽相同,因此不同孕期、不同浓度、不同疗程应用地塞米松对胎儿骨发育、出生后骨量增长、骨代谢性疾病易感性影响尚不明确。人们使用地塞米松等对早产、反复流产等进行预防与治疗的同时,有必要筛选合理的剂量、时间范围。另外,宫内GC对后代骨发育影响的代际遗传效应已经被证明,但这种代际遗传效应最终能持续多少代仍有待进一步研究。
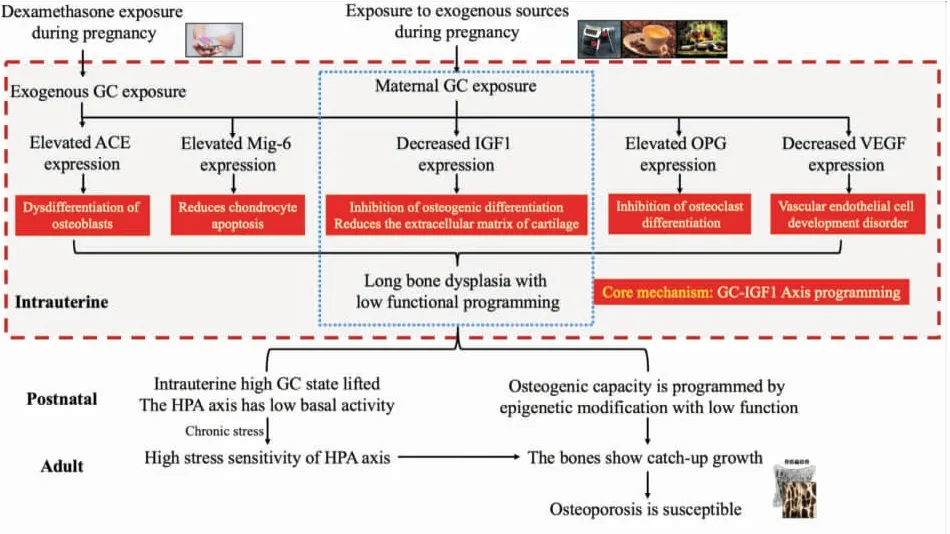
Fig 1 Long bone dysplasia mechanism caused by glucocorticoid exposure during pregnancy

