基于《课程标准》及《中国高考评价体系》的高考命题方案研究项目成果展示
江西河南
【例1】(超级全能生9月联考,3题)下列有关常见有机物的说法错误的是
( )
A.可用NaOH溶液或溴水区别开植物油和裂化汽油
B.氯乙烷(C2H5Cl)与NaOH溶液反应转化为C2H5OH属于取代反应
C.苯、甲苯、硝基苯均可与H2反应
D.淀粉、纤维素、蛋白质均为天然高分子化合物
【答案】A
【新课程标准考查要求】1.知道有机化合物分子是有空间结构的,以乙烯、乙醇、乙酸、乙酸乙酯为例认识有机化合物中的官能团。知道有机化合物存在同分异构现象。2.认识乙烯、乙醇、乙酸的结构及其主要性质与应用;结合典型实例认识官能团与性质的关系,知道氧化、加成、取代、聚合等有机反应类型。知道有机化合物之间在一定条件下是可以转化的。
【命题人命题角度】本题考查新课程标准要求中的第1点。常见有机物组成、性质、结构的考查属于高频考点。预设难度0.6。本题基于知识架构进行分析、推理及探究,设误点为取代反应含义的应用。复习中老师应引导学生记住典型物质的组成、理解结构与性质之间的关系。
【试题分析】

考向分析错误方向规避错误关键点取代反应含义的理解不理解取代反应含义取代反应是指用一种基团替代有机物中原有的基团
【例2】(超级全能生9月联考,4题)设NA为阿伏加德罗常数的值。下列有关说法错误的是
( )
A.常温下,10 L pH=12的氨水中所含OH-的数目为0.1NA
B.2.0 g正丁烷和3.8 g异丁烷的混合物中极性键数目为NA
C.标准状况下,22.4 L CH4与等体积的Cl2在光照条件下充分反应后,生成气体的分子数为NA
D.物质的量为2 mol的Na2S和Na2S2混合物中含有的阴离子总数为2NA
【答案】C
【新课程标准考查要求】1.了解物质的量及其相关物理量的含义和应用。2.认识构成物质的微粒之间存在相互作用,结合典型实例认识离子键和共价键的形成,建立化学键概念。3.认识原子结构、元素性质与元素在元素周期表中位置的关系。知道元素、核素的含义,了解原子核外电子的排布。4.能基于物质的量认识物质组成及其化学变化,运用物质的量、摩尔质量、气体摩尔体积、物质的量浓度之间的相互关系进行简单计算。
【命题人命题角度】本题考查新课程标准要求中的第4点。阿伏加德罗常数属于高频考点。预设难度0.5。本题的设问角度主要是基于多元知识综合考查,进行了基于知识架构下的分析、推理及探究。本题的设误点为微粒数目的计算,甲烷和氯气的反应。学生复习阿伏加德罗常数时,应综合运用各知识点间的联系对应典型例题练习,提升解题熟练程度。
【试题分析】

考向分析错误方向规避错误关键点微粒数目的计算认为氨水不能完全电离,则OH-的数目小于0.1 NA按公式要求求解,n(OH-)=c(OH-)·Vaq甲烷和氯气的反应认为反应停留在一阶段CH4与Cl2在光照条件下反应,可发生多步取代反应,生成物有CH3Cl、CH2Cl2、CHCl3、CCl4、HCl等
【例3】(超级全能生9月联考,7题)一种制备高效漂白剂NaClO2的实验流程如图1所示,下列说法正确的是
( )

图1
B.反应Ⅱ中H2O2发生还原反应
C.NaClO2有强氧化性,反应中只能作氧化剂
D.操作X为过滤、洗涤、干燥
【答案】A
【新课程标准考查要求】1.认识元素可以组成不同种类的物质,根据物质的组成和性质可以对物质进行分类。2.认识元素在物质中可以具有不同价态,可通过氧化还原反应实现含有不同价态同种元素的物质的相互转化。3.结合真实情境中的应用实例或通过实验探究,了解氯、氮、硫及其重要化合物的主要性质,认识这些物质在生产中的应用和对生态环境的影响。
【命题人命题角度】本题考查新课程标准要求中的第2点。元素性质属于常考知识点。预设难度0.6。本题的设问角度主要是基于多元知识综合考查,进行了基于知识架构下的分析、推理及探究。本题的设误点为氧化还原反应理论的应用。学生在复习中应明确典型元素常见价态具体的存在形式;教师要深入讲解如何利用化合价的变化分析知识间的转化及化合价与物质氧化性、还原性的关系。
【试题分析】

考向分析错误方向规避错误关键点价态变化不能正确运用价态变化分析判断物质的性质牢记价态升高的物质表现还原性,价态降低的物质表现氧化性
【例4】(超级全能生9月联考,10题)电流型一氧化碳传感器可用于室内CO含量的测定,其工作的原理可用如图2装置表示,传感器工作过程中,下列叙述错误的是
( )
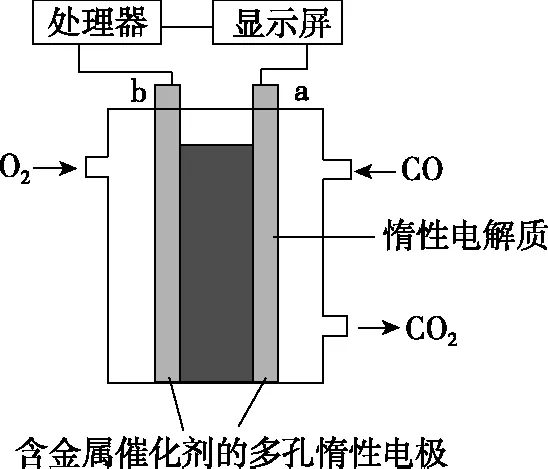
图2
A.b为正极,电极表面发生还原反应
B.工作一段时间后溶液的pH几乎不变

D.标准状况下,当室内有11.2 mL的CO被反应时,理论上需消耗室内氧气80 mg
【答案】D
【新课程标准考查要求】1.认识化学能与电能相互转化的实际意义及其重要应用。2.了解原电池及常见化学电源的工作原理。3.了解电解池工作原理,认识电解在实现物质转化和储存中的具体应用。4.了解金属发生电化学腐蚀的本质,知道金属腐蚀的危害,了解防止金属腐蚀的措施。
【命题人命题角度】本题考查新课程标准要求中的第2点。电化学题型属于高频考点。预设难度0.5。本题的设问方向主要是电池工作原理、pH判断、电极反应式正误的判断及相关计算等。本题的设误点为电极反应式正误的判断及相关计算。学生复习时,应熟练掌握原电池、电解池工作原理,能书写电极反应式和总反应方程式并进行相关的计算。教师讲解时要对这部分知识进行深度说明。
【试题分析】
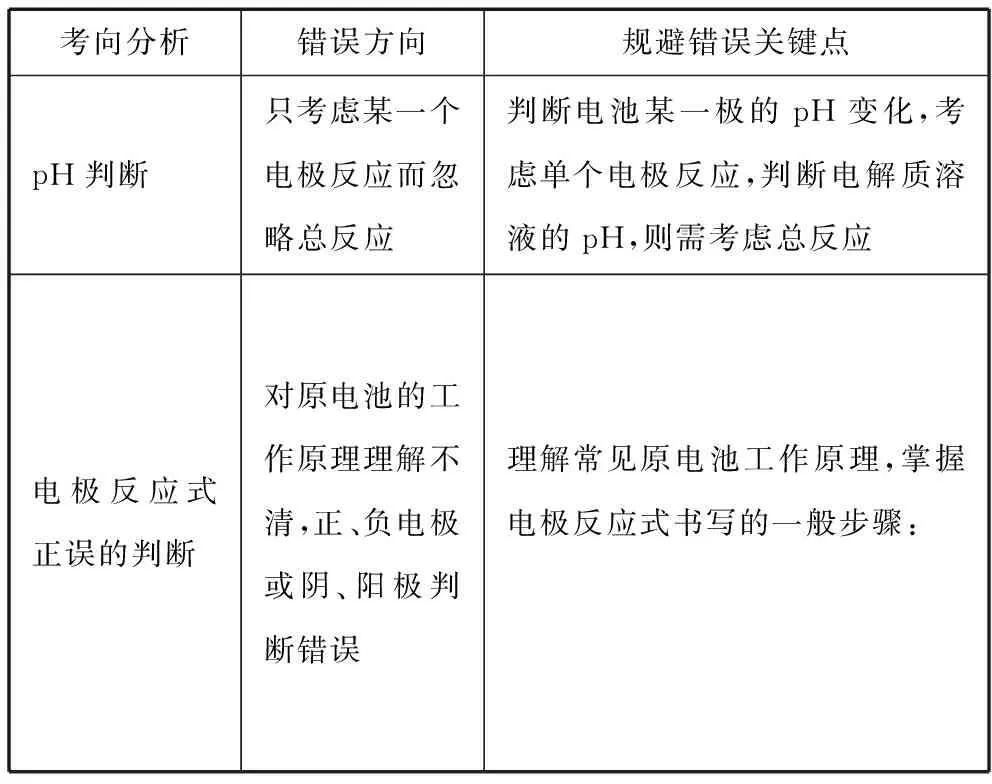
考向分析错误方向规避错误关键点pH判断只考虑某一个电极反应而忽略总反应判断电池某一极的pH变化,考虑单个电极反应,判断电解质溶液的pH,则需考虑总反应电极反应式正误的判断对原电池的工作原理理解不清,正、负电极或阴、阳极判断错误理解常见原电池工作原理,掌握电极反应式书写的一般步骤:
【规避错误应掌握的内容及习题选择】
此类电化学题属于难度中等考题。为避免出现错误则要熟练原电池工作原理,能书写电极反应和总反应方程式,能进行相关的计算。联系试题选择方向为电化学(电解)试题。如下:
【例题1】高铁酸钠(Na2FeO4)是一种新型绿色水处理剂。工业上可用电解浓NaOH溶液制备Na2FeO4,其工作原理如图3所示,两端隔室中离子不能进入中间隔室。下列说法错误的是
( )
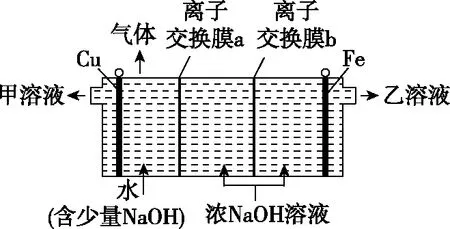
图3
B.甲溶液可循环利用
C.离子交换膜a是阴离子交换膜
D.当电路中通过2 mol电子的电量时,会有1 mol H2生成
【答案】C

【例5】(超级全能生9月联考,14题)在给定条件下,下列选项所示物质间的转化均能实现的是
( )


【答案】D
【新课程标准考查要求】1.认识元素在物质中可以具有不同价态,可通过氧化还原反应实现含有不同价态同种元素的物质的相互转化。2.结合实例认识金属、非金属及其化合物的多样性,了解通过化学反应可以探索物质性质、实现物质转化。
【命题人命题角度】本题考查新课程标准要求中的第1、2点。元素及其化合物的性质属于高频考点。预设难度0.5。本题的设问方向主要是元素及其化合物的性质等。本题的设误点为偏铝酸钠蒸干灼烧得偏铝酸钠固体,氯化钡溶液不与二氧化硫反应。学生复习时,应熟练掌握元素及其化合物之间的转化。教师讲解时要针对元素及其化合物之间的转化等进行专题训练。
【试题分析】

考向分析错误方向规避错误关键点偏铝酸钠溶液蒸干灼烧认为偏铝酸根会水解,蒸干灼烧得氧化铝熟练掌握如碳酸钠、硅酸钠、偏铝酸钠等溶液蒸干灼烧可得溶质氯化钡溶液与二氧化硫反应认为氯化钡溶液会与二氧化硫反应氯化钡溶液不会与二氧化硫反应,违背了强酸制弱酸的原理
【规避错误应掌握的内容及习题选择】此类元素及其化合物之间的转化题型属于难度中等考题。为防止出现错误要规避错误关键点。联系试题选择方向为元素及其化合物之间的转化试题。如下:
【例题1】工业上,常用铜阳极泥(主要成分是Cu2Te,含少量的Ag、Au)回收碲,其工艺流程如图4(已知TeO2微溶于水,易与浓强碱、浓强酸反应):

图4
下列叙述错误的是
( )
A.合理处理阳极泥有利于保护环境和资源再利用
B.操作1、2、3均为过滤
C.可由滤渣2提取金属Ag、Au
D.上述流程中用浓硝酸代替浓盐酸可提高碲的回收率
【答案】D
【解析】铜阳极泥主要成分为Cu2Te,含少量的Ag、Au,在稀硫酸中溶解,并通入O2,得到TeO2、Au、Ag、CuSO4溶液;然后过滤,滤液1含有硫酸铜溶液等,滤渣1含有TeO2、Au、Ag,加入浓盐酸过滤,则滤渣2含有Au、Ag,TeO2和加入的浓盐酸反应得到TeCl4溶液,通入SO2气体,可将溶液中的Te4+还原为Te,同时得到H2SO4。阳极泥中的Cu2Te可用于制备CuSO4、Te等,则合理处理阳极泥有利于保护环境和资源再利用,A项正确;由以上分析可知,操作1、2、3用于分离固体和液体,均为过滤,B项正确;可由滤渣2提取金属Ag、Au,C项正确;浓硝酸可氧化Ag,使制备的碲中混有杂质,则不能用浓硝酸,故D项错误。

(1)基态锰原子的价电子排布图为________,铜元素在周期表中位于________区。C、H、O、Cu四种元素的电负性由大到小的顺序为________________,试从结构角度解释在溶液中Mn2+比Fe2+稳定的原因:。
(2)上述反应前后,碳原子的杂化轨道类型分别为________,HCHO、CO2、H2O,三种分子中,HCHO分子构型是________,甲醛存在众多的同系物,如乙醛、丙醛、丁醛等,上述四种醛中,沸点最高的醛是________。
(3)铜可形成两种常见氧化物CuO、Cu2O,二者熔点依次为1 026℃、1 235℃,则二者的晶体类型是________。
(4)铜晶体中铜原子的堆积如图5所示,铜的一种氧化物的晶胞如图6所示。
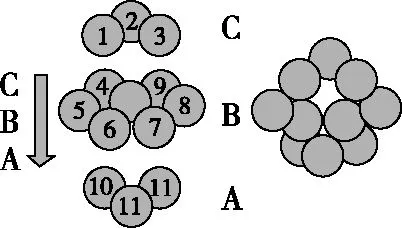
图5

图6
铜原子的堆积方式为____________________,未标号的铜原子形成晶体后的配位数为________,若晶胞参数为rpm,该氧化物的密度是ρg/cm3,则阿伏加德罗常数值NA=________。

(2)sp2、sp 平面三角形 丁醛
(3)离子晶体
【新课程标准考查要求】1.能结合能量最低原理、泡利不相容原理、洪特规则书写1~36号元素基态原子的核外电子排布式和轨道表示式,并说明含义。2.能描述主族元素第一电离能、电负性变化的一般规律,能从电子排布的角度对这一规律进行解释。3.能根据给定的信息分析常见简单分子的空间结构,能利用相关理论解释简单的共价分子的空间结构。4.能借助分子晶体、共价晶体、离子晶体、金属晶体等模型说明晶体中的微粒及其微粒间的相互作用。
【命题人命题角度】本题考查新课程标准要求中的第1、2、3、4点。属于选考题中的必考内容。预设难度0.55。本题的设问角度主要是基于多元知识综合考查,学生复习时要掌握三种结构与性质间的关系,掌握典型问题的分析思路。教师讲解时引导学生建立结构决定性质的观念,掌握问题的分析方法。
【试题分析】

考向分析错误方向规避错误关键点晶胞的计算NA计算掌握晶胞计算的一般方法

