鼠李糖乳杆菌LR ZB1107- 01的体外抗氧化活性
许喜林 周晓莉 郑柳青 刘冬梅
(华南理工大学 食品科学与工程学院,广东 广州 510640)
活性氧是机体在新陈代谢过程中的常见产物[1],当体内自由基产出与清除的平衡失调时,自由基清除剂的活性会快速降低,人体无法正常代谢自由基,导致自由基过度积累,引起氧化应激[2],从而出现代谢异常,最终导致机体衰老、肥胖,引起心血管疾病、癌症等疾病[3]。乳酸菌是一类革兰氏阳性、无芽孢的糖类发酵产乳酸的细菌[4],普遍应用于酸奶、泡菜、发酵肉等产品中[5]。乳酸菌的益生性研究在近30年间已经取得了很大的进展,有研究表明乳酸菌对于调节肠道菌群、降低胆固醇、抗肿瘤、抗氧化及某些疾病的治疗有很大的作用[6]。
很多学者对乳酸菌的抗氧化性进行了研究,陈佩等[7]研究了氧化应激状态下干酪乳杆菌对HepG2细胞抗氧化功能的影响,发现干酪乳杆菌通过提高抗氧化酶活力增强了细胞的总抗氧化能力,从而减轻了细胞的损伤。Marazza等[8]将鼠李糖乳杆菌CRL981用来发酵豆浆,发现发酵后的豆浆相比于未经发酵的豆浆,其抗氧化性明显提高,同时表现出更高的抗氧化活性。Bernini等[9]的研究发现,双歧杆菌HN019对健康个体和代谢综合征(MetS)患者的炎症和氧化应激状态均有有益作用,且对健康受试者显示出特定的抗氧化作用。此外,乳酸菌可借助清除体内自由基来发挥抗衰老等益生性能。研究表明,在日常饮食中添加一定量的乳酸菌可以减轻机体氧化损伤,但不同菌株的抗氧化能力差异较大,乳酸菌的抗氧化性研究主要集中在体外测定抗氧化性指标或者建立Caco- 2等细胞抗氧化模型[10]上。
笔者所在课题组前期从广州一月龄婴儿粪便中筛选获得了鼠李糖乳杆菌(Lactobacillusrhamnosus)ZB1107- 01(LR ZB1107- 01),其为革兰氏阳性菌且过氧化氢酶阴性,具有良好的胃肠道耐受和肠道黏附特性等益生功能,无溶血性,经体外体内实验证明其为安全菌株[11]。DPPH(1,1-二苯-三硝基苯肼)、·OH、O2-清除率是常用的抗氧化性能评价指标,有研究表明,乳酸菌发酵过程中不同组分具有不同的抗氧化性[12]。文中进一步检测LR ZB1107- 01发酵过程中不同组分的抗氧化指标,并建立Caco- 2细胞抗氧化模型,全面评价LR ZB1107- 01的抗氧化活性,以期为开发利用该菌株作为天然抗氧化剂提供理论依据。
1 实验
1.1 材料与试剂
LR ZB1107- 01由笔者所在课题组从婴儿粪便中筛选获得,于2019年4月16日保藏于中国微生物菌种保藏管理委员会普通微生物中心(CGMCC);LGG购自广东省微生物研究所;Caco- 2人结肠癌细胞购自丰晖生物科技有限公司。
MRS肉汤培养基,广州环凯生物科技有限公司生产;DPPH,Phygene飞净生物科技有限公司生产;1,10-邻菲罗啉,广州市锦源化学有限公司生产;SOD酶活检测试剂盒、GSH-Px酶活检测试剂盒,南京建成生物工程有限公司生产。
1.2 仪器与设备
MP502B型电子天平、752N型紫外可见分光光度计,上海精密科技仪器有限公司生产;FX303- 2型电热恒温培养箱,上海树立仪器仪表有限公司生产;25 cm2细胞培养瓶,美国Corning公司生产;Infinite pro 2000型多功能微板孔检测仪,新加坡ESECO公司生产;C- 32密封厌氧罐,三菱瓦斯化学株式会社生产;CLM- 170B- 8-NF CO2型恒温培养箱,新加坡艺思高科技有限公司生产;KA-1000型台式低速离心机,上海安亭科学仪器厂生产。
1.3 实验方法
1.3.1 菌株的培养及样品的制备
LR ZB1107- 01和LGG以3%(体积分数,下同)的接种量接种于MRS液体培养基中,传代2次,于37 ℃下培养22 h。
发酵液制备:将以上发酵液离心(5 000 r/min,10 min)后收集菌体,用无菌生理盐水洗涤3次,重悬于无菌生理盐水中,调节浓度为2.0×108、1.0×108、5.0×107、2.5×107CFU/mL。
上清液制备:菌株发酵液离心后取上清液,用孔径为0.22 μm的无菌滤膜过滤,制得不同浓度的上清液备用。
无细胞提取液制备:将以上不同浓度的发酵液置于冰浴中,以800 W、工作1.5 s后停1.5 s、总历时30 min的条件进行破碎,5 000 r/min下离心 10 min 后取上清液,得不同浓度的无细胞提取液。
1.3.2 DPPH自由基清除率的计算
参考Tang等[13]的方法并略作修改,在反应体系中加入2 mL待测样品以及2 mL 0.2 mmol/L的DPPH溶液,混合均匀,暗反应30 min,测定517 nm处的吸光度。对照组用无水乙醇代替样品,空白组用无水乙醇代替DPPH。DPPH自由基清除率计算公式为
式中,A样、A空、A对分别为样品、空白组和对照组的吸光度。
1.3.3 羟自由基清除率的计算
参考陈漪汶等[14]的方法并略作修改,在5 mL反应体系中加入0.25 mL 5 mol/L的邻菲罗啉溶液、2 mL PBS、0.25 mL 5 mmol/L的硫酸亚铁溶液,以及0.5 mL质量分数为3%的H2O2、1 mL样品,用蒸馏水补足5 mL,于37 ℃水浴70 min,在536 nm波长处测定其吸光度。对照组用蒸馏水代替样品,空白组用蒸馏水代替样品和H2O2。羟自由基清除率计算公式为
1.3.4 超氧阴离子自由基清除率的计算
参考张天博等[15]的方法并略作修改,在5 mL体系中加入3 mL 50 mmol/L的Tris-HCL、1 mL样品、1 mL 1.2 mmol/L的邻苯三酚,充分混匀,于25 ℃水浴25 min后,在325 nm处测定其吸光度。空白组用生理盐水代替样品。超氧阴离子自由基清除率计算公式为
1.3.5 LR ZB1107- 01对Caco- 2细胞抗氧化功能的影响实验
(1)Caco- 2细胞的培养
将Caco- 2细胞复苏后,置于7 mL完全培养基(含10%胎牛血清、1%双抗)中,在含5% CO2的培养箱中于37 ℃下培养至细胞贴壁面积达70%~80%时,加入3 mL 0.25%的胰酶进行消化传代。细胞贴壁生长,每24 h换一次培养基,连续培养18~21 d后,达到极化状态即可用于实验。
(2)Caco- 2细胞抗氧化模型的建立
用MTT(3-(4,5-二甲基噻唑- 2)- 2,5-二苯基四氮唑溴盐,商品名为噻唑蓝)法确定Caco- 2细胞氧化模型中H2O2的浓度,构建方法参考Hou等[16]的方法并略有修改。Caco- 2细胞以每孔3×105个的浓度接种于96孔板中,过夜培养,待细胞贴壁后用无菌PBS洗涤3次,加入200 μL不同浓度(0.0、12.5、25.0、50.0、100.0、200.0、250.0、500.0、1 000.0和2 000.0 μmol/L)的H2O2,在含5% CO2的培养箱中于37 ℃培养30 min后,吸去H2O2,再用无菌PBS洗涤3次,加入20 μL MTT和180 μL不含血清及双抗的DMEM细胞培养基,继续培养4 h后,吸去孔内液体,加入150 μL二甲基亚砜,震荡10 min使结晶物完全溶解,测定490 nm处的吸光度,细胞存活率计算公式为

式中,A处理组、A空白组分别为处理组、空白组的吸光度。
(3)实验细胞分组
将培养好的Caco- 2细胞以每孔3×105个的浓度接种于6孔板,培养24 h后细胞贴壁。将实验细胞分为4组,每组3个重复,具体分组如下:
①空白组——无菌PBS洗涤3次后,每孔加入不含血清和双抗的DMEM培养基3 mL;
②损伤组——用DMEM培养基配制500 μmol/L的H2O2,每孔加入600 μL,处理30 min后用无菌PBS洗涤,然后加入2 mL不含血清和双抗的DMEM培养基继续培养4 h;
③发酵液组——细胞经过500 μmol/L的H2O2氧化损伤处理后,用DMEM配制活菌浓度为1.0×108CFU/mL的发酵液,取2 mL加入每孔中,继续培养4 h;
④上清液组——细胞经过500 μmol/L的H2O2氧化损伤处理后,将1×109CFU/mL的菌株发酵液离心,再用DMEM将上清液稀释10倍,取2 mL加入每孔中,继续培养4 h。
(4)抗氧化酶活性的测定
Caco- 2细胞培养4 h结束后用无菌PBS洗涤5次,每孔中加入1 mL 1%的Triton-X- 100,冰浴 2 min,离心(1 000 r/min,4 min)后取上清液,根据试剂盒的使用方法测定不同处理组的SOD活性和GSH-Px活性(以U/μg表示,即1 μg酶所能产生的酶活力)。
1.4 数据统计与分析
实验数据以“均值±标准偏差”的形式表示,并采用SPSS 22.0进行统计学分析,采用单因素方差分析进行多组间的比较,显著水平设为P<0.05。
2 结果与讨论
2.1 DPPH自由基清除率
两株鼠李糖乳杆菌在2.0×108、1.0×108、5.0×107、2.5×107CFU/mL浓度下的DPPH自由基清除率如图1所示。由图可知,两株菌均表现出较强的DPPH自由基清除能力,且发酵液和细胞裂解液对DPPH自由基的清除能力随着菌浓度的升高而增强。LR ZB1107- 01各个浓度的发酵液对DPPH自由基的清除率显著高于LGG。就最高浓度(2.0×108CFU/mL)而言,LR ZB1107- 01和LGG发酵液对DPPH自由基的清除率分别为98.13%±1.30%和92.76%±0.90%,具有显著差异(P<0.05)。但LR ZB1107- 01上清液对DPPH自由基的清除率(98.71%±1.00%)与LGG的(99.16%±0.30%)相差不大,无显著差异(P>0.05)。两株菌的细胞裂解液对DPPH自由基的清除能力远不如发酵液和上清液,这可能是由于完整的菌体细胞在代谢过程中产生了胞外多糖等具有抗氧化活性的物质,多糖作为电子供体和自由基,发生DPPH自由基中和反应,在清除自由基的同时终止了其链式反应[17- 18]。


图中不同字母表示各组存在显著差异(P<0.05)
2.2 羟自由基清除率
LR ZB1107- 01和LGG对羟自由基的清除率如图2所示。可以看出,两株菌的不同组分对羟自由基的清除能力遵循剂量-效应关系,同组分下不同浓度样品的羟自由基清除能力有显著差异(P<0.05),且上清液对羟自由基表现出了最强的清除能力。在最高浓度(2.0×108CFU/mL)下,LR ZB1107- 01上清液对羟自由基的清除率(93.33%±4.30%)高于LGG上清液对羟自由基的清除率(90.11%±7.70%),LR ZB1107- 01发酵液对羟自由基的清除率(75.70%±0.60%)低于LGG发酵液对羟自
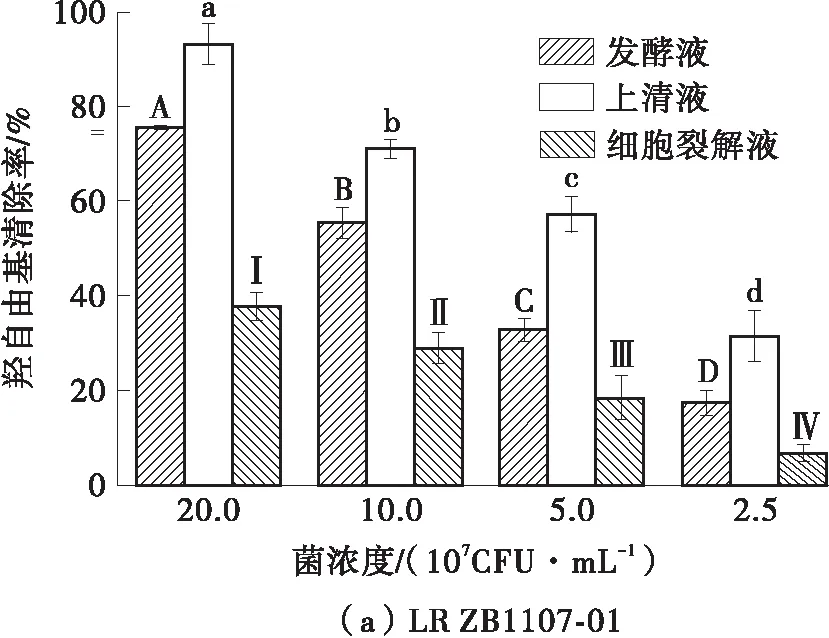

图中不同字母表示各组存在显著差异(P<0.05)
由基的清除率(80.22%±1.70%),LR ZB1107- 01细胞裂解液对羟自由基的清除率(37.85%±3.00%)低于LGG细胞裂解液对羟自由基的清除率(39.78%±4.50%)。从以上结果可以看出,两株鼠李糖乳杆菌细胞裂解液的羟自由基清除率最低,均低于40%,这与DPPH自由基清除率的结果类似。
2.3 超氧阴离子自由基清除率
如图3所示,LR ZB1107- 01和LGG对超氧阴离子自由基的清除能力显著低于其对DPPH自由基、羟自由基的清除能力(P<0.05),但仍遵循剂量-效应关系。LR ZB1107- 01各个浓度的细胞裂解液对超氧阴离子自由基的清除率均显著高于LGG。两株菌的上清液对超氧阴离子自由基的清除能力最强。在最高浓度(2.0×108CFU/mL)下,LR ZB1107- 01上清液对超氧阴离子自由基的清除率(50.53%±1.90%)低于LGG上清液对超氧阴离子自由基的清除率(54.43%±2.20%),LR ZB1107- 01细胞裂解液对超氧阴离子自由基的清除率(23.23%±2.20%)高于LGG细胞裂解液对超氧阴离子自由基的清除率(21.81%±1.60%),而LR ZB1107- 01发酵液对超氧阴离子自由基的清除率(18.44%±1.10%)要低于LGG发酵液对超氧阴离子自由基的清除率(23.15%±1.80%)。鼠李糖乳杆菌的超氧阴离子自由基清除能力最有可能来源于其细胞内或代谢产物中的SOD,研究表明,包括CAT、SOD和GSH-Px在内的抗氧化酶是乳酸菌对抗氧化应激的重要保护系统[19]。
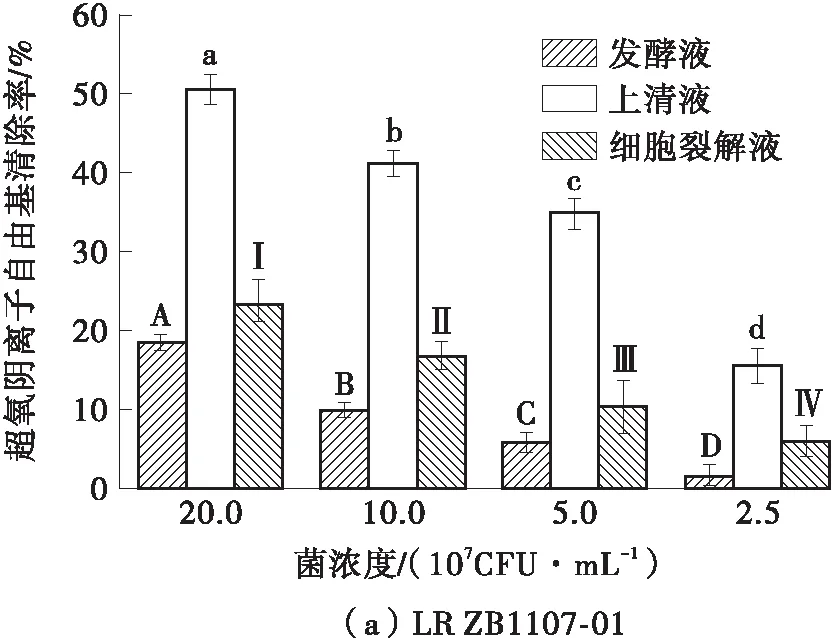
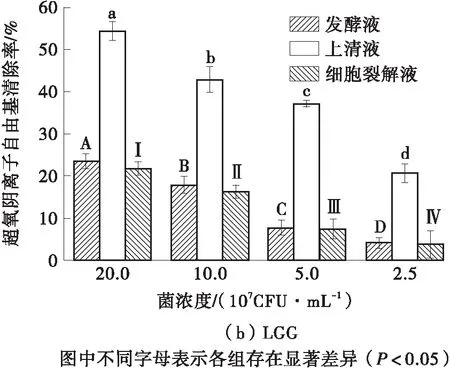
图3 LR ZB1107- 01和LGG的超氧阴离子自由基清除率
2.4 LR ZB1107- 01对Caco- 2细胞抗氧化功能的影响
将Caco- 2细胞置于不同浓度的H2O2中,诱导其氧化,构建合理的细胞氧化损伤模型。如图4所示,当H2O2浓度低于500 μmol/L时,其对细胞存活率的损伤不明显,当H2O2浓度超过500 μmol/L时,Caco- 2细胞的存活率急剧下降,且与H2O2浓度呈负相关,因此文中选择浓度为500 μmol/L的H2O2处理30 min以建立Caco- 2细胞氧化损伤模型。

图4 不同浓度H2O2处理下的Caco- 2细胞存活率
不同处理组的SOD、GSH-Px细胞内抗氧化酶活性见表1。损伤组的SOD活性显著低于空白组(P<0.05),表明Caco- 2细胞已受到氧化损伤。Wijeratne等[20]的研究表明,当受到外界氧化刺激时,细胞会优先增加SOD酶活来抵御自身受到的氧化损伤,随着来自外界的氧化刺激不断增强,SOD酶活会因细胞过度损伤而显著降低。相比于损伤组,经两株鼠李糖乳杆菌上清液和发酵液处理后的Caco- 2细胞胞内SOD活性显著上升。对于发酵液处理组中Caco- 2细胞的SOD活性而言,LR ZB1107- 01发酵液处理组要显著高于LGG发酵液处理组(P<0.05),但上清液处理组中Caco- 2细胞的SOD活性相差不大,无显著差异(P>0.05)。有研究[21]表明,胞外多糖等成分对细胞受到的外界氧化应激损伤有一定的保护作用,且能够提高体内抗氧化酶的活性,这与文中实验得出的结论一致。
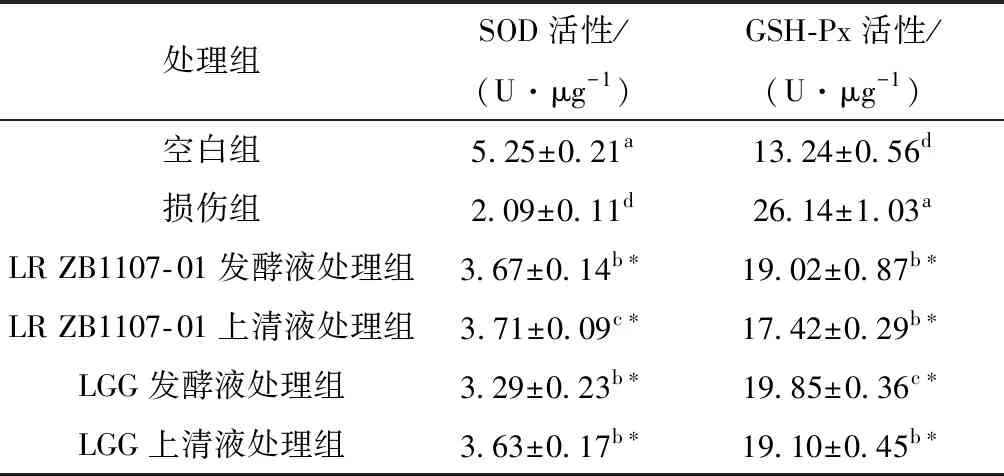
表1 不同处理组的抗氧化酶活性1)
就谷胱甘肽过氧化物酶活性而言,氧化损伤组的GSH-Px活性显著高于空白组(P<0.05),说明Caco- 2细胞处于H2O2环境中时会主动通过提高GSH-Px活性来抵御外界氧化刺激。有研究[22- 23]表明,当细胞受到外界极端条件胁迫时,GSH会以“自杀式”的消耗方式来发挥对细胞的保护作用,这很有可能与GSH-Px酶活的提高有关。与损伤组相比,两株鼠李糖乳杆菌发酵液和上清液处理过的Caco- 2细胞胞内GSH-Px活性均显著下降(P<0.05),说明两株菌的发酵液和上清液可以缓解GSH-Px受到的外界氧化刺激作用。LR ZB1107- 01发酵液处理组Caco- 2细胞的GSH-Px活性与LGG发酵液处理组无显著差异(P>0.05),而LR ZB1107- 01上清液处理组Caco- 2细胞的GSH-Px活性显著低于LGG上清液处理组(P<0.05)。
3 结语
文中研究表明,鼠李糖乳杆菌LR ZB1107- 01具有较好的抗氧化能力,其发酵液对DPPH自由基的清除能力、细胞裂解液对超氧阴离子自由基的清除能力均显著高于LGG。通过建立Caco- 2细胞抗氧化模型,对SOD、GSH-Px酶活性进行测定,可以进一步验证:LR ZB1107- 01能在一定程度上抑制或减少H2O2对Caco- 2细胞造成的氧化损伤,增强细胞的抗氧化作用。另外,鼠李糖乳杆菌LR ZB1107- 01的抗氧化效果与对照菌株LGG相当,这为今后开发利用该菌株作为天然抗氧化剂提供了一定的理论依据。

