妊娠期铅、镉暴露对新生大鼠海马BDNF及ZnT7蛋白表达的影响*
路艳清,孙 蕾,王雪芳
(1.甘肃省兰州市第二人民医院妇产科 730046;2.甘肃省武威市人民医院妇产科 733000)
随着工业化和城市化进程的加快,环境铅(plumbum,Pb)、镉(cadmium,Cd)污染对人体健康尤其是儿童生长发育及智力、行为健康的影响已成为社会关注问题之一[1-2]。Pb是一种具有神经毒性的重金属,Cd也是一种广泛存在于工农业和日常生活中的重金属类环境污染物,其环境含量呈逐年上升趋势,可毒害女性生殖系统、发育中的神经系统及小儿体格和神经发育[3]。以往研究证实,母体血Pb、Cd与脐血Pb、Cd有一定相关性[4],但关于妊娠期暴露Pb、Cd对新生儿的作用机制尚不完全清楚。脑源性神经营养因子(brain-derived neurotrophic factor,BDNF)在神经系统、内分泌系统等广泛表达,对神经元的生长、发育、分化及再生具有维持和促进作用[5-6]。锌在中枢神经系统中水平丰富,其稳态对维持脑正常生理功能起重要作用,其水平变化与锌转移体(Zinc transporter,ZnT)直接相关[7]。因此本研究拟通过对母鼠妊娠期Pb、Cd暴露进行研究,旨在探究其对新生大鼠海马中BDNF及ZnT7蛋白表达的影响,以期为Pb、Cd的神经毒性作用机制及临床预防和治疗Pb、Cd毒性损伤提供参考。
1 材料与方法
1.1 实验动物及分组
12只健康清洁级妊娠SD大鼠由广东省医学实验动物中心提供,分成4组:对照组(NC组,饮用蒸馏水)、铅组(Pb组,300 mg/L)、镉组(Cd组,10 mg/L)及铅镉联合组(Pb+Cd组,300 mg/L+10 mg/L),每组3只。均维持12 h光照/12 h黑暗循环,环境温度22~24 ℃,湿度45%~65%,自由采食,均从妊娠第1天至妊娠结束共饮水染毒21 d。动物的饲养和使用均符合美国国立卫生研究院指南及动物伦理保护有关准则。
1.2 主要试剂及仪器
醋酸铅(546-67-8)购自上海一基实业有限公司;醋酸镉(15280-53-2)购自湖北巨胜科技有限公司;蛋白抽提试剂盒(P0028)、BCA蛋白定量试剂盒(P0010S)购自上海碧云天有限公司;一抗兔源抗BDNF(ab108319)、抗ZnT7蛋白(ab223065)、抗GAPDH(ab181602)抗体购自英国Abcam公司等;FC酶标仪购自美国Thermo Fisher公司。
1.3 方法
1.3.1采样
每组选取16只21 d龄新生大鼠(每窝取5~6只)腹腔注射10%水合氯醛(0.3 mL/100 g)麻醉处死,采集各组新生大鼠腹主动脉血2 mL于肝素锂抗凝真空管中,置于-80 ℃冰箱保存备用。断头取脑部海马组织后迅速置于液氮中保存待用。
1.3.2新生大鼠认知能力评定
采样前采用水迷宫实验测定新生大鼠认知能力。水迷宫体积为80 cm×50 cm×20 cm,水深9 cm,水温(22±2)℃,内设多盲端曲折回路,终点处设置梯子供新生大鼠爬出水面进入可视平台。第1次训练前将新生大鼠放在梯子附近,使其自行爬上3次,以后每次训练前,均使其自行爬上梯子1次。每只新生大鼠每天训练1次,每次120 s,连续4 d。分别记录每只新生大鼠从入水至到达平台所需时间(逃避潜伏期)及进入盲端次数,以此作为新生大鼠的认知能力检测指标。
1.3.3血液及海马组织Pb、Cd水平测定
血液及海马组织标本经浓硝酸消解后,采用PE700Z型原子吸收光谱仪测定Pb、Cd水平。
1.3.4海马组织BDNF、ZnT7表达水平检测
采用蛋白免疫印迹(Western blot)法检测海马组织BDNF、ZnT7蛋白表达。首先提取新生大鼠海马组织总蛋白,采用BCA法测定蛋白浓度,置于-80 ℃保存备用。取50 μg蛋白样品进行十二烷基硫酸钠-聚丙烯酰胺凝胶(SDS-PAGE)电泳,将分离的蛋白转至PVDF膜转膜,脱脂奶粉室温封闭,分别加入一抗抗-BDNF(稀释比1∶2 000)、抗-ZnT7(稀释比1∶2 000),抗-GAPDH抗体(稀释比1∶10 000),4 ℃孵育过夜,洗膜,添加二抗IgG(1∶5 000)室温孵育1.5 h,洗膜,显色,曝片,观察并分析蛋白条带灰度值。
1.4 统计学处理
2 结 果
2.1 各组新生大鼠血液及海马组织Pb、Cd水平比较
与NC组比较,Pb组、Pb+Cd组新生大鼠血液及海马组织中Pb水平均显著增加(P<0.05),Cd组、Pb+Cd组新生大鼠血液及海马组织中Cd水平均显著增加(P<0.05),见表1。

表1 各组新生大鼠血液及海马组织Pb、Cd水平比较
2.2 各组新生大鼠认知能力比较
与NC组比较,Pb组、Cd组及Pb+Cd组新生大鼠逃避潜伏期及进入盲端次数显著增加(P<0.05),其中以Pb+Cd组最多(P<0.05),见表2。

表2 各组新生大鼠认知能力比较
2.3 各组新生大鼠海马BDNF、ZnT7水平比较
与NC组比较,Pb组、Cd组及Pb+Cd组新生大鼠海马组织中BDNF水平显著降低,其中以Pb+Cd组最低(P<0.05),ZnT7水平显著升高,其中以Pb+Cd组最高(P<0.05)。见表3、图1。

表3 各组新生大鼠海马BDNF、ZnT7蛋白相对表达水平比较
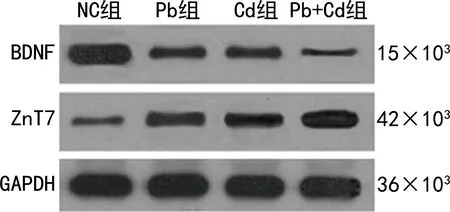
图1 Western blot检测新生大鼠海马组织中BDNF、ZnT7蛋白表达
2.4 相关性分析
Pb+Cd组新生大鼠海马组织中BDNF水平与血液及海马Pb、Cd水平均呈负相关(P<0.05),ZnT7水平与血液及海马Pb、Cd水平均呈正相关(P<0.05)。见表4。
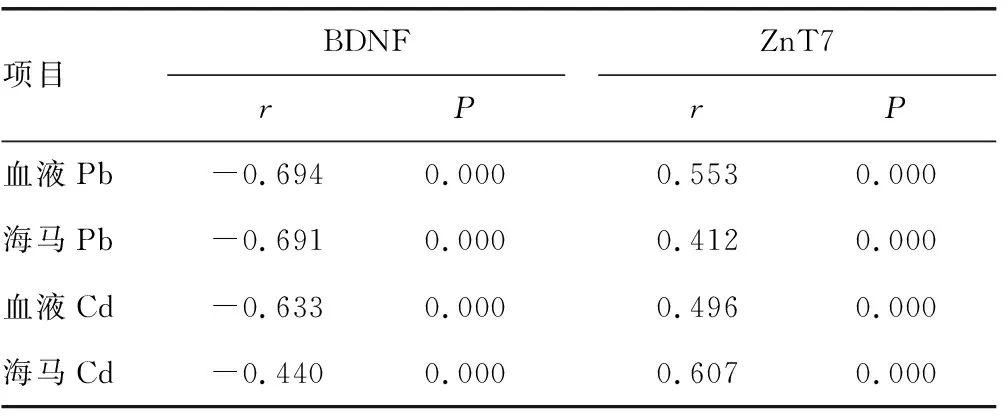
表4 Pb+Cd组新生大鼠海马组织中BDNF、ZnT7水平与血液及海马Pb、Cd水平的相关性
3 讨 论
环境重金属污染已成为严重影响人类健康的公共卫生事件之一,其中以Pb、Cd污染最为严重[8-9]。研究报道,我国育龄期妇女近20%血Pb超过100 μg/L,且母体血Pb极易通过胎盘转运给胎儿,对胎儿造成各种伤害[10]。Cd主要存在于尘埃、土壤、水和食物中,亦可通过胎盘屏障进入胎儿体内,母体Cd是胎儿Cd暴露的唯一来源,其在体内的生物半衰期长达10~30年,在体内蓄积可严重影响小儿生长发育[11]。孕期是母子两代生命衔接的非常时期,此时孕妇及胎儿对环境毒物更加敏感,所以与出生后暴露相比,各种毒性元素出生前暴露对生长发育的毒性作用更大。目前,单一重金属损害健康已得到广泛研究,但实际环境中,这些重金属并非单独存在。因此,为探究出生前Pb、Cd暴露对新生儿的毒害作用,本研究以妊娠SD大鼠为实验模型,分别通过Pb、Cd单独及联合饮水染毒,评价其对新生大鼠神经功能的影响及可能机制。彭博等[12]研究报道,Pb暴露可导致小鼠学习记忆功能障碍及海马蛋白激酶B表达降低。李宗光等[13]研究报道,低剂量汞、Pb、Cd联合暴露可起协同神经毒性损伤作用,与海马神经元凋亡、活性氧及钙离子变化有关。本研究结果显示,与NC组比较,Pb组、Pb+Cd组新生大鼠血液及海马组织中Pb水平均显著增加,Cd组、Pb+Cd组新生大鼠血液及海马组织中Cd水平均显著增加,提示妊娠期母鼠Pb、Cd暴露可能通过胎盘转运至新生大鼠,临床应建议女性孕前3个月进行血Pb、Cd检查,以防止其含量过高影响胎儿发育。本研究还发现,与NC组比较,Pb组、Cd组及Pb+Cd组21 d龄新生大鼠逃避潜伏期及进入盲端次数显著增加,其中以Pb+Cd组最多,提示妊娠期母鼠Pb、Cd暴露可能影响新生大鼠认知能力,且二者具有协同作用。
BDNF是神经营养因子家族成员,广泛分布于中枢、周围神经系统及内分泌系统等,可促进中枢神经元生长、分化、损伤修复、增强突触信息传递、存储及提高记忆、认知功能[14]。牛佳媛等[15]研究报道,缺血缺氧性脑损伤新生大鼠水迷宫实验中逃避潜伏期延长,海马组织BDNF水平显著降低。孙向峰等[16]研究报道,缺氧缺血性脑损伤新生大鼠学习记忆能力及海马BDNF水平显著降低。大脑发挥正常功能亦需要一定水平的Zn2+维持稳定,但过量的Zn2+可对大脑产生毒性,造成神经元损伤,而Zn2+转运需要以ZnT为载体[17]。粟立羽等[18]研究报道,锰中毒可破坏大鼠海马区神经元细胞结构,增加海马组织中Zn2+水平及ZnT3表达。ZnT7是一种定位在高尔基体复合体上的蛋白,可将Zn2+从细胞质中转运至高尔基复合体内,参与各种调解细胞基因表达的DNA结合蛋白等含Zn2+蛋白的合成与加工[19]。池志宏等[20]研究报道,ZnT7在阿尔兹海默症患者脑内高表达,沉默其表达可明显抑制APP细胞转基因β淀粉样蛋白(Aβ)分泌,可作为AD治疗的潜在靶点。FRAZZINI等[21]研究报道,Zn2+是神经元和大脑活动的多效性调节剂,脑Zn2+的药理学失衡会损害BDNF相关信号通路和幼鼠的认知能力。本研究结果显示,与NC组比较,Pb、Cd暴露可显著降低新生大鼠海马BDNF水平、提高ZnT7蛋白水平,均以Pb+Cd联合作用最显著,且Pb+Cd组新生大鼠海马BDNF水平与血液、海马Pb、Cd水平均呈负相关,Pb+Cd组新生大鼠海马ZnT7水平与血液、海马Pb、Cd水平均呈正相关,提示妊娠期Pb、Cd联合暴露降低新生大鼠的认知能力可能与BDNF表达降低、ZnT7表达升高有关,推测其原因可能是Pb、Cd增加导致Zn2+代谢紊乱、Zn2+稳态平衡破坏,进而影响ZnT7及BDNF表达水平。
综上所述,Pb、Cd联合表现为协同毒性效应,妊娠期Pb、Cd暴露可显著降低新生大鼠海马BDNF表达,提高ZnT7蛋白表达,影响新生大鼠认知能力,可能为临床预防和治疗Pb、Cd毒性损伤提供一定理论依据。但本研究尚存在不足之处,其中关于Pb、Cd影响BDNF、ZnT7表达的具体作用通路机制尚不清楚,有待进一步深入探究。

