可切除肺癌伴发肺结节良恶性的多因素分析*
白 洁 褚红玲 王京弟 王可毅 王 通 宋金涛 贺 未 金 亮 马少华
(北京大学第三医院胸外科,北京 100191)
肺癌病灶常同时存在其他肺结节[1],称为伴发肺结节。这些结节氟代脱氧葡萄糖(18F-fluorodeoxyglucose,18F-FDG)摄取值较低,PET-CT难以准确判断其良恶性[2],而且较小的结节行胸部CT引导下穿刺活检难度较高[3],难以在术前获得明确的病理诊断。对肺癌病灶进行手术切除的同时,如切除伴发的肺结节,难免会出现因为良性结节切除更多肺组织的情况,造成不必要的肺功能损失;如不切除,可能因结节在随访过程中增大,短期内经历二次手术,特别是同侧的伴发肺结节,既往手术史会造成手术难度增加,影响手术安全[4]。术前对伴发肺结节的良恶性进行准确评估,是临床抉择的关键。故此,我们分析可切除肺癌伴发的肺结节的临床特征,探讨伴发肺结节为恶性的预测指标,为优化手术切除范围提供科学依据。
1 对象与方法
1.1 研究对象
本研究经北京大学第三医院医学科学研究伦理委员会批准[(2021)医伦审第(019-01)号]。
检索2013年9月1日~2019年12月1日在我院接受外科手术治疗的肺癌患者资料,将符合以下入排标准的患者纳入本研究。
入选标准:①主病灶的病理诊断为肺癌(主病灶定义为直径最大或实性成分最多的结节,术前穿刺病理证实为肺癌或临床高度怀疑为肺癌,有典型的肺癌影像学特征,或结节在随访中增大或实性成分增多,有手术切除指征);②除主病灶外,手术切除的伴发肺结节≥1枚;③所有切除的肺结节均有明确的病理诊断;④术前胸部CT在影像系统中可查阅,可对所有切除的肺部结节进行观察和测量。
排除标准:①术前接受过新辅助化疗或放疗;②伴发肺结节术前已行穿刺,有明确的病理诊断;③除肺癌外的其他恶性肿瘤肺转移;④肺癌主病灶与伴发肺结节位于同一肺叶。虽然很多正在进行的临床试验试图证实早期肺癌行亚肺叶切除疗效与肺叶切除相当[5],但是目前肺癌治疗的金标准仍然为肺叶切除,同一肺叶的伴发肺结节可以在肺癌主病灶切除的同时一并切除,临床抉择并不困难,故此本研究将其排除。
符合入排标准的患者共93例,男21例,女72例(77.4%)。年龄34~80岁,中位数62岁。78例(83.9%)不吸烟,吸烟<30包年6例(6.5%),吸烟≥30包年9例(9.7%)。有肺癌家族史8例(8.6%)。其他恶性肿瘤病史7例(7.5%),包括乳腺癌2例,甲状腺癌2例,直肠癌1例,子宫内膜癌1例,喉癌1例。仅5例(5.4%)有咳嗽、咯血、发热等症状,余88例(94.6%)无明显临床症状,体检胸部CT提示肺部结节。
伴发肺结节数量1~4枚,其中1枚64例,2枚25例,3枚3例,4枚1例,共127枚。66枚(52.0%)位于肺癌主病灶同侧不同肺叶,61枚(48.0%)位于对侧肺。右肺上叶39枚(30.7%),右肺中叶20枚(15.7%),右肺下叶29枚(22.8%),左肺上叶18枚(14.2%),左肺下叶21枚(16.5%)。纯磨玻璃结节(pure ground-glass opacity,pGGO)108枚(85.0%),混合磨玻璃结节(mixed ground-glass opacity,mGGO)14枚(11.0%),实性结节(solid nodules,SN)5枚(3.9%)。伴发肺结节直径4.0~29.0 mm,中位数8.0 mm。平均CT值-806.4~-69.7 Hu,中位数-557.9 Hu。39枚(30.7%)有分叶征,21枚(16.5%)有毛刺征,38枚(29.9%)有空泡征,13枚(10.2%)有胸膜牵拉征,44枚(34.6%)有血管集束征,24枚(18.9%)有空气支气管征。
4枚主病灶在术前行CT引导下穿刺,其余均通过术中冰冻及术后石蜡病理诊断,93枚主病灶均为非小细胞肺癌,其中腺癌90例(96.8%)。伴发结节术前均未行CT引导下穿刺,通过术中冰冻病理及术后石蜡病理明确诊断,61枚(48.0%)伴发肺结节为恶性,均为肺腺癌,包括浸润性腺癌(invasive adenocarcinoma,IA)21枚(16.5%),微浸润腺癌(microinvasive adenocarcinoma,MIA)16枚(12.6%),原位腺癌(adenocarcinoma in situ,AIS)24枚(18.9%)。66枚(52.0%)伴发肺结节为良性,包括淋巴结反应增生14枚(11.0%),非典型腺瘤样增生(atypical adenomatous hyperplasia,AAH)13枚(10.2%),慢性炎症12枚(9.4%),纤维硬化结节8枚(6.3%),肺泡上皮增生4枚(3.1%),错构瘤4枚(3.1%),硬化性血管瘤2枚(1.6%),未分类良性结节9枚(7.1%)。
1.2 方法及观察指标
1.2.1 CT检查及阅片方法 采用德国西门子Deffinitions AS 64排多层螺旋CT进行胸部CT扫描。扫描参数:层厚5.0 mm,层间距5.0 mm,管电压120 kV,管电流110~450 mAs,肺窗采用1685 Hu窗宽、-565 Hu窗位,纵隔窗采用360 Hu窗宽、55 Hu窗位。扫描范围从肺尖到肺底,所有图像数据用迭代重建算法以0.75 mm的切片厚度重建。
肺癌结节和伴发肺结节的影像学特征,包括结节的位置、大小、密度,以及形态特征(包括分叶征、毛刺征、胸膜牵拉征、空泡征、支气管充气征、血管集束征)。
伴发肺结节影像学阅片方法:专人在影像系统(Picture Archiving and Communications System,PACS)中选择术前最后一次胸部CT图像集中阅片,根据纵隔窗显示的实性成分不同将病灶分为纯磨玻璃结节(全部为磨玻璃成分)、混合性磨玻璃结节(由实性成分和磨玻璃成分共同组成)[6]及实性结节(全部为实性成分),前两者总称为磨玻璃结节。记录结节位置,测量结节直径。结节直径定义为肺窗病变的最长径,通过PACS影像系统中的标尺工具测量,以mm为单位,精确到0.1 mm。在肺结节上设定尽可能大的兴趣区(region of interest,ROI),取同一层面,兴趣区占结节直径的50%以上,避开钙化、坏死区,避开边缘区域,以减少部分容积效应,测量结节平均密度值。所有测量数据均经2次测量后取平均值。
1.2.2 手术方法及病理诊断 手术均在胸腔镜下进行,包括亚肺叶(楔形切除或肺段切除)+亚肺叶切除52例,肺叶切除+亚肺叶切除37例,肺叶切除+肺叶切除3例,肺叶切除+肺叶切除+亚肺叶切除1例。
肺癌结节和伴发肺结节的病理类型,根据2011版肺腺癌分类标准[7],非典型腺瘤样增生定义为良性病变,原位癌、微浸润性肺腺癌、浸润性肺腺癌定义为恶性,其他恶性病变还包括鳞癌、腺鳞癌、类癌等。
1.3 统计学方法
使用SPSS25.0和Excel2019处理数据。连续变量均为偏态分布,使用M(P25,P75)描述,Mann-WhitneyU检验评估2组间的差异;分类变量使用χ2检验评估2组间的差异。进行单因素分析,将P<0.05的自变量纳入二分类logistic回归模型,得到伴发肺结节为恶性的独立危险因素。以P<0.05为差异有统计学意义。绘制伴发肺结节的直径与恶性比例的剂量-反应曲线。
2 结果
良性和恶性伴发肺结节的临床及影像学特征的单因素及多因素分析见表1、2。单因素分析显示,伴发肺结节是否为恶性与患者的一般情况、肺癌主病灶的特征无明显关系,伴发结节直径>8 mm(P=0.000)、分叶征(P=0.000)、空泡征(P=0.000)、胸膜牵拉征(P=0.001)、血管集束征(P=0.000)、空气支气管征(P=0.003)为伴发肺结节为恶性的危险因素(P<0.05)。对这些因素进行多因素分析,结果显示:血管集束征(OR=12.94,95%CI:4.02~41.67,P=0.000),空泡征(OR=7.29,95%CI:1.99~26.74,P=0.003),分叶征(OR=3.82,95%CI:1.14~12.78,P=0.029),伴发结节直径>8 mm(OR=3.41,95%CI:1.07~10.85,P=0.037)为伴发肺结节为恶性的独立危险因素。伴发肺结节大小与恶性比例的剂量-反应曲线见图1。
3 讨论
文献[8~10]报道,24%~57%的肺癌同时存在伴发肺结节。伴发肺结节可能为良性疾病、转移瘤或同时性多原发肺癌[11],不同性质的结节外科处理的策略不同,良性结节可以定期随访观察,而恶性结节则需考虑外科手术干预。不同位置的伴发结节外科处理策略亦有不同。与主病灶位于同一肺叶的伴发肺结节,Stiles等[12]推荐行肺叶切除将主病灶与伴发肺结节一并切除;而与主病灶不同肺叶的伴发肺结节,建议评估恶性风险,对高风险的结节行楔形切除或肺段切除。如何有效评估肺癌伴发肺结节的恶性风险,对临床决策尤为重要。
本研究共纳入127枚伴发结节,其中122枚(96.1%)为磨玻璃结节,磨玻璃结节的比例远远高于Ruppert等[9]报道的7.6%和Stiles等[12]报道的21%;本研究48.0%(61/127)的伴发结节为恶性,这一比例也高于Ruppert等[9]报道的27%和Stiles等[12]报道的39%。这一结果与高分辨率胸部CT的广泛应用和肺癌早期筛查的普及使肺磨玻璃结节的检出率大幅提高有关。Mironova等[13]报道磨玻璃结节的恶性比例高达60%~70%。本研究中所有(61/61)恶性伴发肺结节均为肺腺癌,包括原位腺癌、微浸润腺癌及浸润性腺癌,这些结节多在CT上表现为磨玻璃结节。
本研究中良恶性伴发结节在性别、吸烟史、肺癌家族史、结节位置方面无显著性差异,这些都反映出以磨玻璃结节为主的恶性伴发肺结节区别于传统肺癌结节,具备不同的临床病理特征,如女性患者比例增加,吸烟不是危险因素,良恶性与结节位置无关等。Hattori等[14]及Kang等[15]也报道了相似的结果。
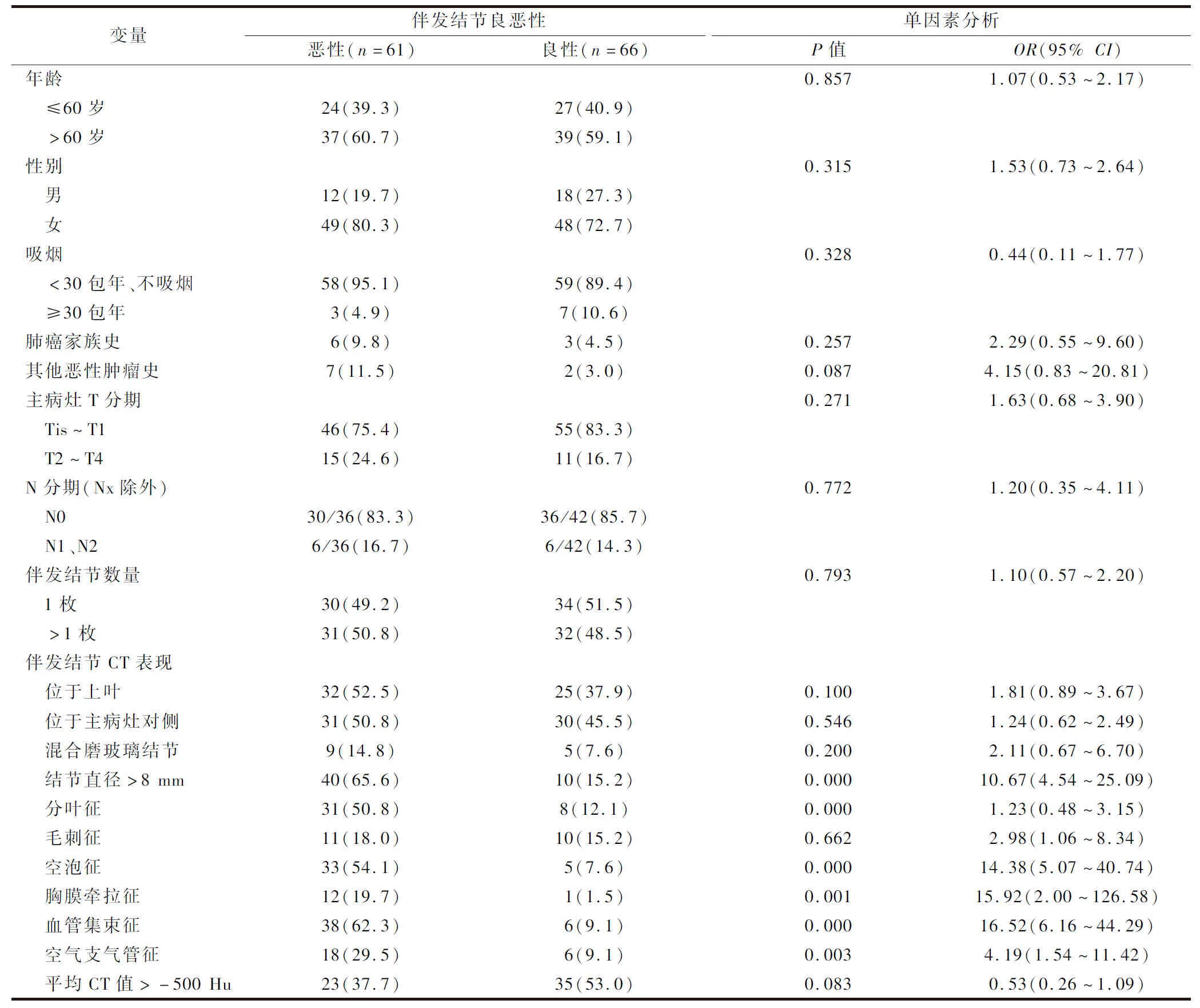
表1 127枚良性和恶性伴发肺结节临床及影像学特征的单因素分析
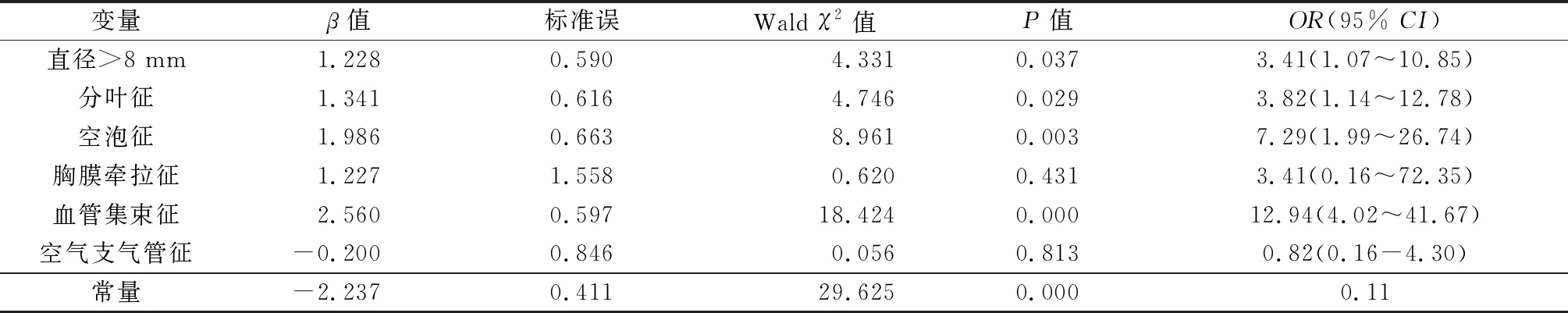
表2 127枚良性和恶性伴发肺结节临床及影像学特征的多因素分析
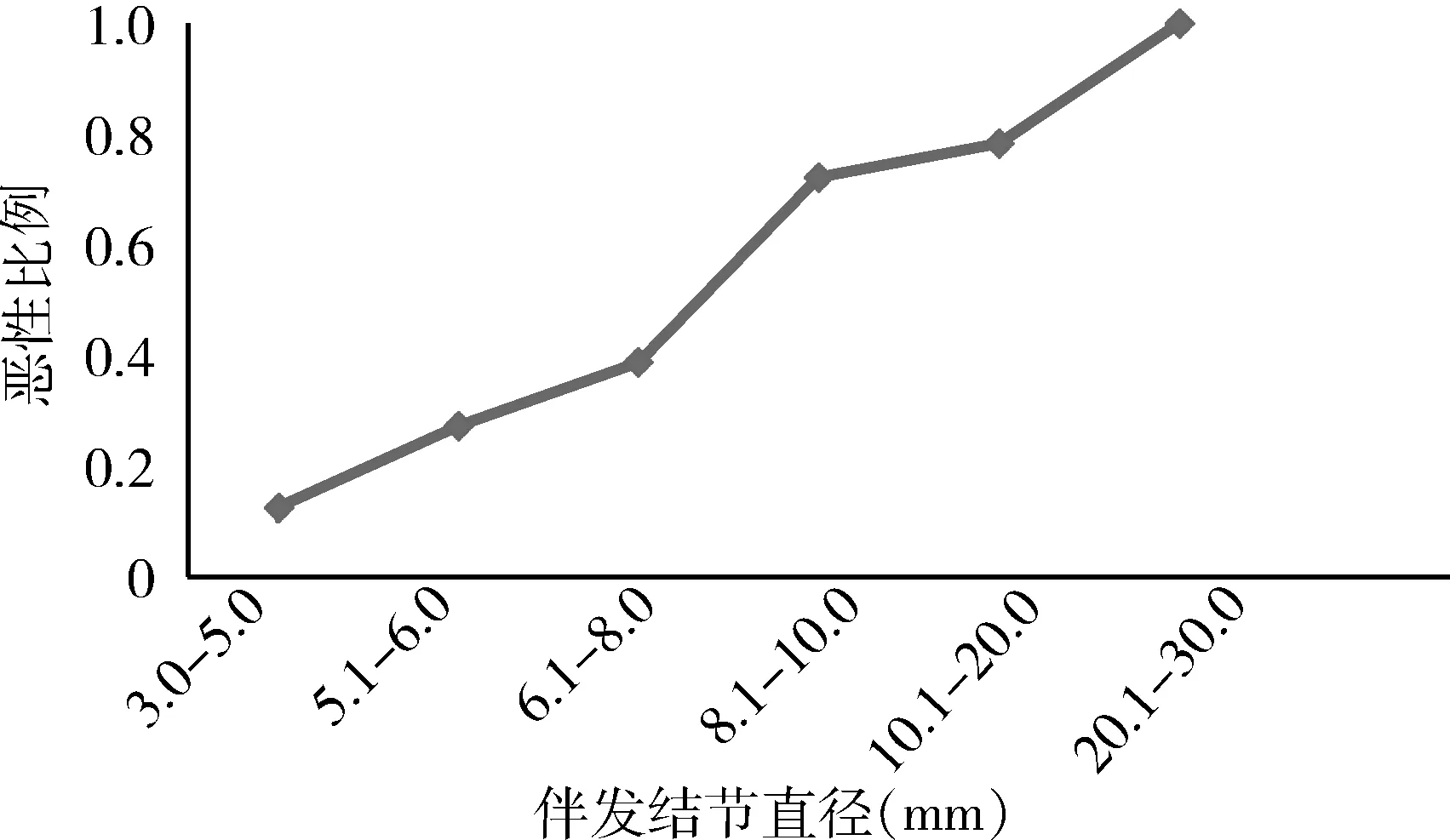
图1 伴发肺结节大小与恶性比例的剂量-反应曲线
多原发肺癌(multiple primary lung cancer,MPLC)是指在同一患者肺内同时或先后发生2个或2个以上的原发性恶性肿瘤[16],根据Martini标准[11]及美国胸科学会(American College of Chest Physicians,ACCP)指南的更新[17],本研究中91.8%(56/61)的恶性伴发肺结节为同时性多原发肺癌。多原发肺癌的病灶起源不同,彼此相对独立。这也解释了我们的结果:伴发肺结节的良恶性与肺癌主病灶的特征(T分期,是否存在淋巴结转移)及相对位置无明显关联。这一现象Dai等[18]也有报道。故此,在判断伴发结节的良恶性时,应该更多地关注伴发肺结节自身的特征。
结节大小是伴发肺结节是否为恶性的独立危险因素,Dai等[18]的研究也得到同样的结论。剂量-反应曲线显示:伴发肺结节的直径越大,恶性的比例越高。故此,应该根据伴发结节不同直径的分组,制定不同的治疗策略。本研究中直径>20.0 mm的伴发肺结节,均为恶性(9/9),对这些结节建议在主病灶切除的同时一并切除;直径为10.1~20.0 mm及8.1~10.0 mm的伴发结节,恶性率分别为78.3%(18/23)和72.2%(13/18),这些结节恶性比例较高,建议参考影像特征积极干预;直径为6.1~8.0 mm及5.1~6.0 mm的伴发结节恶性率分别为38.7%(12/31)和27.3%(6/22),建议根据影像学特征谨慎切除;而直径≤5.0 mm的伴发结节恶性率为12.5%(3/24),其中浸润性肺腺癌为8.3%(2/24),较MacMahon等[19]报道的孤立性肺结节的恶性比例(<1%)高,这样的结果可能与伴发肺结节不同于孤立性肺结节的临床病理特征有关,也可能源于伴发结节的高选择性,但是这一结果仍然提醒我们需要在肺癌主病灶切除前充分评估≤5.0 mm的伴发肺结节的恶性可能。
分析肺结节的影像学特征,对于预测结节的良恶性具有重要价值[20]。Hou等[21]的研究显示分叶征、血管集束征、空气支气管征、空泡征等在肺良恶性结节间具有明显的统计学差异。本研究结果显示分叶征、空泡征、血管集束征是伴发肺结节为恶性的独立危险因素,这些征象在恶性伴发结节中都有较高发生率,分别为50.8%(31/61)、54.1%(33/61)和62.3%(38/61),而胸膜牵拉征、空气支气管征并不是独立的危险因素,这2个征象在恶性伴发结节中的比例为19.7%(12/61)和29.5%(18/61)。喻微等[22]对实性肺结节的研究显示,分叶征、空气支气管征是恶性结节的独立危险因素,其CT特征在恶性结节中的比例,分叶征88.9%(144/162),空泡征24.7%(40/162),血管集束征5.6%(9/162),胸膜牵拉征45.1%(73/162),空气支气管征35.2%(57/162)。对比一下,分叶征在恶性伴发肺结节中的占比小于实性肺结节,但是仍然高达50.8%;空泡征、血管集束征比例相对较高,而胸膜牵拉征和空气支气管征的比例相对较低。CT特征比例的不同可能导致本研究多因素分析结果与实性肺结节为主的研究的差异。我们的结果与其他以肺磨玻璃结节为研究对象的研究相似。肖飞等[23]的研究显示分叶征是肺磨玻璃结节为恶性的独立危险因素,而胸膜牵拉征不是。吴芳等[24]的研究显示,在≤1 cm的磨玻璃结节中,血管改变在不同病理亚型的肺腺癌中有显著差异,而空气支气管征无显著差异。这些结果反映磨玻璃结节区别于实性肺癌结节,具备不同的CT特征。虽然胸膜牵拉征、空气支气管征在logistic回归分析中尚不能作为伴发肺结节为恶性的独立危险因素,但是单因素分析差异仍然显著,也能够为临床初步鉴别诊断提供重要参考。
本研究有一定的不足之处:首先,由于本研究是一项单中心回顾性研究,且纳入研究的病例较少,可能影响研究结果的可靠性,需要大样本量研究进一步验证;其次,没有纳入未手术切除的伴发肺结节,可能对最终的结论产生一定的影响。尽管CT灌注成像+动态增强检查鉴别肺结节的良恶性已有很多报道,但是卫健委《原发性肺癌诊疗规范(2018年版)》[25]中,胸部增强CT并不作为周围型肺结节的必检项目。本研究虽然缺乏伴发结节增强CT的边界特征,但本研究的结论对无CT增强病例良恶性肺结节的判断有借鉴价值。
综上,本研究结果显示,伴发结节大小、分叶征、空泡征、血管集束征有助于对肺癌伴发的肺结节的良恶性进行判断。

