锂电解过程中杂质元素的电化学行为
王世栋,叶秀深,李 权,火 焱,李明珍,张慧芳,庞全世,吴志坚
(1.中国科学院青海盐湖研究所,中国科学院盐湖资源综合高效利用重点实验室,青海西宁810008;2.青海省盐湖资源化学重点实验室;3.青海金昆仑锂业有限公司)
锂是世界上最轻的金属,电位最负(-3.043 V),其理论比容量高达3 860 mA·h/g, 因此由锂作为电子受体或供体设计的电池的比能量最高, 被认为是最理想的负极材料。 由于锂优异的储能性能,被称为“二十一世纪的能源金属”,战略地位显著[1-2]。 国内外金属锂的生产方法有熔盐电解法和金属热还
原法, 目前工业上普遍采用氯化锂-氯化钾熔盐电解法。在熔盐电解法制备金属锂过程中,影响金属锂产品质量的杂质主要为Mg、Ca、Na、Fe 等,因MgCl2、CaCl2、NaCl、FeCl3的 分 解 电 位 小 于LiCl 的 分 解 电位,电解过程中原料中的Mg、Ca、Na、Fe 将全部进入产品。 研究金属锂及杂质元素从熔盐体系中析出的电化学行为, 明晰其在阴极析出的电位范围及控制步骤,得出熔盐电解过程中的反应机理,对熔盐电解制备金属锂优化工艺条件、 提高电流效率和降低生产能耗具有重要的理论和现实意义[3-4]。 本文通过电化学方法研究了杂质在50%LiCl-50%KCl 熔盐体系中的还原过程,讨论了杂质对电解过程的影响。
1 实验部分
实验所用原料均为分析纯化学试剂。 电解质体系按50%LiCl-50%KCl 进行配比(其中50%LiCl-50%KCl 在500 ℃下的密度经RT-4 熔体测试仪测定为1.55 g/cm3),称量50 g KCl、50 g LiCl 及少量杂质放入Φ60 mm×60 mm 的刚玉坩埚中, 将坩埚放入电阻炉中加热至500 ℃熔化, 并在此温度下保温进行实验。 以Φ6 mm 的光谱纯石墨棒为对电极,Φ1 mm 的钼丝为工作电极和准参比电极,工作电极面积为0.165 cm2,所有电位均以钼电极为参比,采用AUTOLAB PGSTAT128N 电化学工作站进行测量。测试前,每个电极用SiC 纸进行彻底抛光,用乙醇进行超声波清洗,然后擦干。
2 实验结果分析
2.1 电解过程中MgCl2 的电化学行为
图1a 为500 ℃时LiCl-KCl 熔盐体系中加入MgCl2前后的循环伏安曲线,扫描速度为0.1 V/s。 曲线1 为空白体系的循环伏安曲线,阴极信号B 是金属锂的沉积,在反向扫描方向,阳极峰B′对应于锂的溶解, 锂离子开始发生还原反应析出金属锂的电位为-2.299 V,在金属锂析出之前,没有其他还原电流出现。 曲线2 为添加1%MgCl2后的循环伏安曲线,在-1.748 V 检测到还原信号峰A 对应于Mg2+的还原; 在-2.148 V 出现的峰值C 对应于锂在镁上(镁预先沉积在钼电极上)欠电位沉积形成镁锂合金;随后出现的峰B/B′为锂的沉积和溶解。在阳极扫描方向,峰C′和A′分别为镁锂合金中锂和镁的阳极氧化峰。 这表明在电解质体系中若存在少量的无水氯化镁,在电解过程中首先析出金属镁,然后是金属锂的欠电位沉积形成镁锂合金, 最后才是金属锂的析出, 锂离子开始发生还原反应析出金属锂的电位为-2.239 V。
图1b 为500 ℃含1%MgCl2的LiCl-KCl 熔盐在钼电极上不同扫描速度下的循环伏安曲线。 其氧化还原峰电流IA′/IA大于1, 表面产物Mg 部分可溶[5]。图1c 为500 ℃含1%MgCl2的LiCl-KCl 熔盐中阴极峰电流随扫描速度平方根的变化关系。由图1c 可以看到,阴极峰值电流Ip与扫描速度的平方根呈线性关系,表明Mg2+的还原电极过程受扩散控制,这与文献的研究结果一致[5-8]。 根据直线的斜率可以用Berzins-Delahay 方程计算扩散系数[6]:

式(1)中,n 为 电 子 转 移 数;F 为 法 拉 第 常 数,96 485 C/mol;R 为气体常数,8.314 J/(mol·K);T 为绝对温度,K;S 为电极面积,cm2;C0为电活性物质的浓度,mol/cm3;D 为扩散系数,cm2/s;v 为电位扫描速度,V/s。 经计算Mg2+的扩散系数为1.44×10-5cm2/s,与文献报道值为同一个数量级, 差异主要与准确确定活性电极区域的难度有关[5-8]。
2.2 电解过程中CaCl2 的电化学行为
图2 为500 ℃时LiCl-KCl 熔盐体系中加入CaCl2前后的循环伏安曲线,扫描速度为0.1 V/s。曲线1 为空白体系的循环伏安曲线,阴极信号B 和阳极信号B′对应于金属锂的沉积和溶解。 曲线2 为添加1%CaCl2后的循环伏安曲线,其与曲线1 一样,只有一组B/B′信号峰。由于Ca 与Li 的析出电位非常接近,阴极信号B 应是液态Ca-Li 合金的沉积, 钙和锂的共沉积电位为-2.266 V 略大于锂金属的沉积电位-2.299 V[9]。
当两种金属离子的沉积电位相等时, 电解时发生共沉积,如下式:

式中,E1和E2为电解时离子1 和离子2 在阴极上的沉积电位,V。

式中,Er为相应离子的平衡电位,V;η为离子的超电势,V。
在可逆或准可逆情况下, 离子的平衡电位符合Nernst 方程:
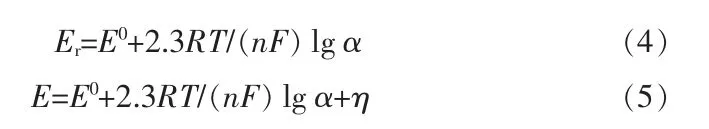
式(5)为离子的沉积电位E(V)与析出电位E0(V)、活度α(mol/cm3)以及析出时在阴极材料上超电势η(V)的关系。
单纯考虑热力学方程(Nernst 方程),即只考虑浓度的变化是否能实现钙锂合金的共电沉积。 500 ℃时,Ca2+和Li+的标准电极电位为:E0Ca=-3.534 V,E0Li=-3.646 V。
设定η1=η2且远远小于1,不予考虑,同时假定离子的活度系数γCa2+=γLi+,令ECa=ELi,即:

经计算, 电解质体系中CLi=0.018 3 mol/cm3,则CCa=1.14×10-5mol/cm3,CaCl2在电解质体系中的质量分数为0.08%, 说明电解质体系中有微量的Ca2+即发生钙锂共沉积。
2.3 电解过程中NaCl 的电化学行为
图3a 为500 ℃时LiCl-KCl 熔盐体系中加入NaCl 前后的循环伏安曲线,扫描速度为0.1 V/s。 曲线1 为空白体系的循环伏安曲线,曲线2 为添加1%NaCl 后的循环伏安曲线,曲线3 为添加15%NaCl后的循环伏安曲线。 实验结果表明,曲线2 和曲线3与曲线1 一样,只有一组B/B′信号峰。由于Na 与Li的析出电位也非常接近, 本文对电解过程中是否共电沉积析出钠锂合金进行了分析。
500 ℃时,Na+和Li+的标准电极电位为:E0Na=-3.519 V,E0Li=-3.646 V。 设定η1=η2且远远小于1,不予考虑,同时假定离子的活度系数γNa+=γLi+,令ENa=ELi,即:
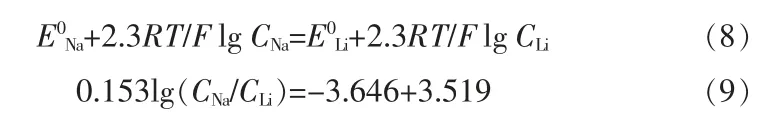
经计算,电解质体系中CLi=0.018 3 mol/cm3,则CNa=2.71×10-3mol/cm3,NaCl 在电解质体系中的质量分数为10.22%,说明电解质体系中的NaCl 质量分数达到10.22%才发生钠锂共沉积。由于Na 与Li 的析出电位非常接近,见图3a,含15%NaCl 的LiCl-KCl 熔盐循环伏安曲线只发现钠锂合金的析出峰。
图3b 为金属锂中钠含量随NaCl 添加量的变化关系图,可以看出,随着电解质体系中NaCl 含量的增加,金属锂中的钠含量有较大的增加,几乎呈线性变化。 这是由于金属锂非常活泼,有强的还原性,假定金属锂中的钠是由金属锂还原而来的, 如式(10)所示:

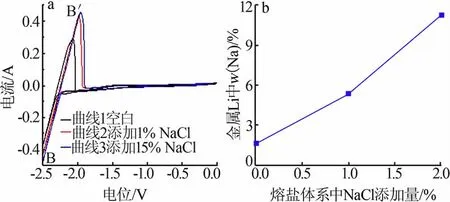
图3 LiCl-KCl 熔盐体系中加入NaCl 前后的循环伏安曲线(a)和金属锂中钠含量随NaCl 添加量的变化(b)Fig.3 Cyclic voltammetry curves performed in LiCl-KCl melt before/after adding NaCl(a)and relationship between Na content in Li metal with addition of NaCl(b)
根据表1 反应过程中各物质的热力学数据可以求得反应的吉布斯自由能:


经计算,在500 ℃下,反应的ΔG0500℃<0,反应可以自发进行,所以熔盐体系中微量的NaCl 可以被金属锂还原成金属钠。
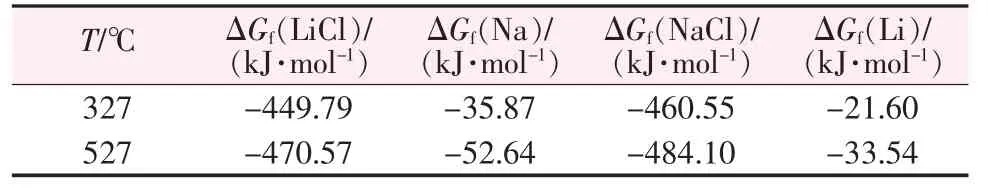
表1 Na,Li 及其氯化物的热力学数据[10]Table 1 Thermodynamic data of Na,Li and their chlorides
2.4 电解过程中FeCl3 的电化学行为
图4a 为500 ℃时LiCl-KCl 熔盐体系中加入FeCl3前后的循环伏安曲线,扫描速度为0.1 V/s。 曲线1 为空白体系的循环伏安曲线,阴极信号B 和阳极信号B′对应于金属锂的沉积和溶解。 曲线2 为添加1%FeCl3后的循环伏安曲线,在-0.75 V 检测到还原信号峰A 对应于Fe3+的还原, 随后出现的峰B/B′为Li 的沉积和溶解。 在阳极扫描方向,峰A′为还原Fe 的溶解峰[11-12],C′峰值是由于氯气的形成导致了附近熔体中离子浓度的变化, 增加了周围离子的还原速率,增大了电流[13-15]。 加入1%FeCl3后,熔盐体系Li 的析出电流急剧降低,这是由于Fe3+在阴极被还原成海绵铁使阴极钝化引起的[11-12]。
图4b 为500 ℃含1%FeCl3的LiCl-KCl 熔盐在钼电极上不同扫描速度下的循环伏安曲线。图4c 为500 ℃含1%FeCl3的LiCl-KCl 熔盐中阴极峰电流随扫描速度平方根的变化关系。 由图4c 可以看到,阴极峰值电流Ip与扫描速度的平方根呈线性关系,表明Fe3+的还原电极过程受扩散控制,这与文献的研究结果一致。 根据直线的斜率可以用式(1)的Berzins-Delahay 方程计算扩散系数,经计算Fe3+的扩散系数为3.14×10-5cm2/s,与文献报道值接近[11-14]。
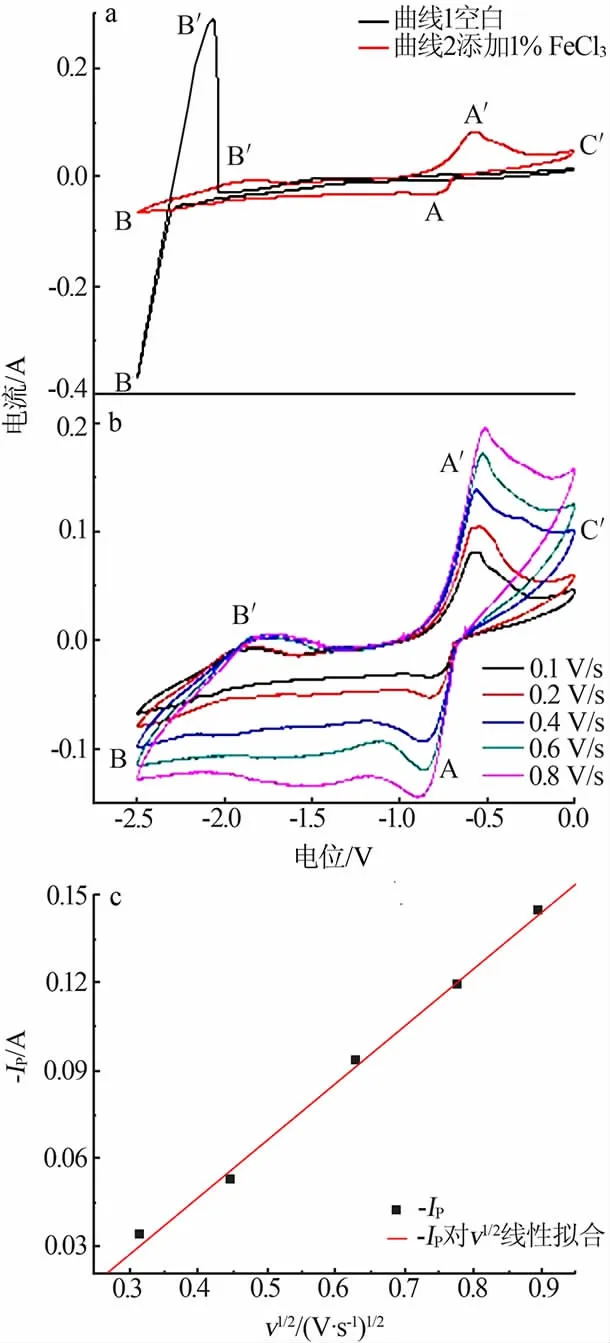
图4 LiCl-KCl 熔盐体系中加入FeCl3 前后的循环伏安曲线(a)、不同扫描速度下的循环伏安曲线(b)以及阴极峰电流随扫描速度平方根的变化关系(c)Fig.4 Cyclic voltammetry curves performed in LiCl-KCl melt before/after adding FeCl3(a),cyclic voltammetry curves at different scanning rates(b)and relationship between peak cathode current and square root of scanning rate(c)
3 结论
通 过 对 锂 电 解 过 程 中 杂 质MgCl2、CaCl2、NaCl、FeCl3在LiCl-KCl 熔体中的电化学行为的研究,主要获得以下结论。
1)杂质元素Mg 将优先于Li 在阴极析出,并与金属锂合金化形成合金。 其中Mg2+的还原电极过程受扩散控制,扩散系数为1.44×10-5cm2/s。 2)电解质体系中有微量的Ca2+即发生钙锂共沉积,由于Ca 与Li 的析出电位非常接近,循环伏安曲线只发现钙锂合金的析出峰。 3)在含少量NaCl 的熔盐体系中,杂质元素Na 被Li 还原并形成合金, 随着电解质体系中NaCl 含量的增加,金属锂中的钠含量有较大的增加,几乎呈线性变化。 只有当电解质体系中的NaCl质量分数达到10.22%才发生钠锂共沉积, 由于Na与Li 的析出电位非常接近,循环伏安曲线只发现钠锂合金的析出峰。 4)杂质元素Fe 优先于Li 在阴极析出,由于Fe3+在阴极被还原成海绵铁使阴极钝化,引起熔盐体系Li 的析出电流急剧降低。 Fe3+的还原电极过程受扩散控制,扩散系数为3.14×10-5cm2/s。5)杂质元素Mg、Ca、Na、Fe 对锂电解的电化学过程都有影响,在电解过程中均会进入金属锂产品,影响产品质量, 尤其是Fe 会引起电解过程电流的下降,导致电解无法进行。

