浓香型白酒酿造车间空气中酵母菌的分离鉴定及生长特性研究
黄治国 彭思婕 李 浩 钟姝霞 邓 杰 任志强 卫春会
(1. 四川轻化工大学酿酒生物技术及应用四川省重点实验室,四川 宜宾 644000;2. 四川水井坊股份有限公司,四川 成都 610036;3. 自贡检验检测院,四川 自贡 643000)
浓香型白酒又称泸香型白酒,是中国四大典型香型白酒之一,以泸州老窖特区酒为典型代表,属于大曲酒,其主要的香型物质为己酸乙酯,酒体无色透明、窖香浓郁、绵软甘冽、香味协调、尾净爽口[1]。其中最能体现浓香型大曲酒酿造工艺独特之处是“泥窖固态发酵、续糟配料、混蒸混烧”[2-3]。
传统固态白酒酿造过程中,微生物对白酒的质量、品质、风味等有重要作用[4],多数微量物质都是微生物的代谢产物[5]。大曲作为糖化发酵剂,是多种微生物群的混合体系[6],微生物的生长繁殖形成了种类繁多的代谢产物,进而赋予大曲酒独特的风格和特色[7]。曲中的微生物主要是从环境中富集而来,各种微生物互相作用进而影响发酵过程[8]。游玲等[9]研究表明窖泥、空气、糟醅之间的微生物存在相互转移,酿造过程中的霉菌、细菌、酵母菌大部分来自空气,酿造环境空气中的微生物是否在酿造特性方面有发展取决于环境条件。
目前,有关白酒微生物的研究主要是以酒醅或酒曲为出发点[10],从微生物的角度探究白酒的发酵机理,并提出白酒微生物与风味之间的联系是今后研究的重点[11],尤其是不同香型白酒具有不同的风味特征,其中微生物的作用十分重要[12]。目前有关酿造过程中的细菌和霉菌的群落结构变化、群落结构与风味组分以及微生物群落与氨基酸含量的相关关系研究较多[13-17],但未进行大量的菌落筛选,且空气中酵母菌的产酒产香作用尚未见报道。文章拟以浓香型白酒酿造车间空气微生物为研究对象,利用YPD培养基和麦芽汁培养基,对浓香型白酒酿造车间空气微生物进行分离鉴定,并从中筛选出酵母菌;对酵母菌进行耐受特性分析,并采用GC-MS分析其代谢产物。旨在为白酒酿造机理以及引进新型养生酒的同时提高白酒质量提供依据。
1 材料与方法
1.1 材料与试剂
空气微生物样品:将取样机置于酿造车间,对酿造车间空气进行多点取样并混合均匀作为试验分析样品,密封后于4 ℃保藏,川北某浓香型白酒厂;
琼脂、葡萄糖、95%乙醇、浓盐酸等:分析纯,成都科龙化工试剂公司;
酵母浸膏、蛋白胨等:北京双旋微生物培养基制品厂。
1.2 仪器与设备
气相色谱质谱联用仪:7890A-5975B型,美国安捷伦科技公司;
紫外可见分光光度计:A360型,上海翱艺仪器有限公司;
双色荧光定量PCR仪:CFX96 型,美国BIO-RAD公司;
化学发光成像系统:ChemiDoc XRS型,美国BIO-RAD公司;
正置生物显微镜:DM3000型,德国Leica公司;
菌落计数分析仪:ProtoCOL3型,广州市华粤行仪器有限公司;
电泳仪:Mini-subce11型,美国BIO-RAD公司;
高性能台式离心机:X1R型,赛默飞世尔科技(中国)有限公司;
离心机:5418型,艾本德(中国)有限公司;
均质器:Precellys24型,奥然科技有限公司;
恒温培养振荡器:ZWYR-D2403型,上海智城分析仪器制造有限公司;
微生物培养箱:LS-I201型,上海桑戈生物科技有限公司;
大型台式恒温冷冻摇床:MaxQ4000型,赛默飞世尔科技(中国)有限公司;
超净工作台:SW-CJ-2D型,上海实业苏净有限公司。
1.3 试验方法
1.3.1 培养基制备
(1) YPD培养基:酵母膏10 g,蛋白胨20 g,葡萄糖20 g,琼脂粉20 g,蒸馏水1000 mL,121 ℃灭菌15 min。
(2) 马铃薯液体培养基:去皮马铃薯200 g,葡萄糖20 g,蒸馏水1 000 mL,121 ℃灭菌15 min。
(3) 高粱汁培养基[18]:高粱粉250 g,耐高温α-淀粉酶(10 U/g原料)45 mg,糖化酶(250 U/g原料)20 mg,酸性蛋白酶(30 U/g原料)30 mg,蒸馏水1 000 mL,糖度20 °Bx,115 ℃灭菌15 min。
1.3.2 空气中微生物的分离纯化及形态观察 无菌条件下,取1 mL空气样品,加入9 mL无菌水,充分摇匀,振荡5~10 min,梯度稀释,选取10-3、10-5、10-7稀释液各1 mL,均匀涂布于酵母膏胨葡萄糖琼脂培养基,30 ℃培养48 h,根据菌种的生长状况,选取适当的平皿,挑取单菌落,转接于另一平皿。按此法重复转接2~3次进行分离纯化,根据菌落特征及镜检确认后,挑取单菌落移入斜面,培养后备用。对分离纯化培养筛选出的菌株进行镜检,确定菌落形态。
1.3.3 酵母菌DNA的提取 取1 mL菌悬液进行活化,采用酶破碎法结合玻璃珠破碎法提取DNA。采用正向ITS1(5’-TCCGTAGGTGAACCTGCGG-3)和反向引物ITS4(5’-TCCTCCGCTTATTGATATGC-3’)进行PCR扩增。具体反应程序:94 ℃预变性8 min;94 ℃变性30 s,53 ℃退火30 s,72 ℃延伸90 s,共29个循环;72 ℃延伸8 min,对扩增产物进行电泳检测。
1.3.4 酵母菌的生长曲线及对乙醇、温度、酸的耐受性
(1) 生长曲线:采用紫外可见分光光度计测定酵母菌数量,并绘制曲线图。
(2) 乙醇耐受性:分别添加0%,3%,5%,7%,9%,11%乙醇至酵母菌液中,测定其吸光值。
(3) 温度耐受性:取1 mL酵母菌悬液接种至马铃薯液体培养基中,以3 ℃为增长梯度,从20~41 ℃,共9个培养基,培养24 h,测定其吸光值。
(4) 酸耐受性:各取1 mL菌悬液接种至马铃薯液体培养基中,调节pH以0.5为梯度,从pH 2.0~6.0,每组9个培养基,28 ℃培养24 h,测定其吸光值。
1.3.5 酵母菌代谢产物分析 采用高粱汁培养基,分别接种酵母菌,28 ℃发酵3 d。采用GC-MS进行鉴定,利用NIST数据库,分析发酵液中的代谢产物。
1.3.6 数据处理 采用SPSS软件和Excel、Origin软件等对数据进行处理分析。
2 结果与分析
2.1 空气中酵母菌的分离纯化
从川北某浓香型白酒厂酿造车间的空气微生物样品中分离纯化得到4株酵母菌,分别编号为nz2、nz3、nz4、nz8,其菌落形态特征见表1。

表1 各菌株的菌落形态特征
2.2 基于5.8S rDNA-I TS区的分子鉴定结果
对分离纯化后的4株酵母菌DNA进行提取,使用引物ITS1和ITS4对其5.8S rDNA-ITS区基因进行PCR扩增。由图1可知,4株酵母菌的DNA扩增产物长度为500~750 bp。利用NCBI对菌株序列进行BLAST比对,并构造发育树如图2所示。
由图2可知,nz2和nz3同属于胶红酵母(R.mucilaginosa),nz4和nz8同属于季也蒙毕赤酵母(M.guilliermondii)。赵春海等[19]研究发现胶红酵母和季也蒙毕赤酵母均属产油脂酵母类,可在一定条件下水解碳源、氮源产生脂肪酸。胶红酵母包含独特酶系,能很好分解酒中不良物质[20],季也蒙毕赤酵母可将丰富原料发酵转换成油脂和其他微量物质[21],这两株酵母均可适应环境并代谢产生有益物质,在酿造白酒的环境下,能够产香、产醇,在筛选菌株时这两株菌在培养基上生长繁殖会产生酒的香气。叶伟庆[22]发现胶红酵母菌可产生类胡萝卜素、粗多糖、蛋白酶、淀粉酶、纤维素酶、维生素B1、维生素B2、维生素B6等物质,其中类胡萝卜素和维生素都是对人体有益的微量元素[23-24]。故可将胶红酵母引入到白酒中使之发展成为新型养生酒。因此,选用其中的nz3和nz4两株酵母进行生长曲线、耐受特性以及代谢产物分析。
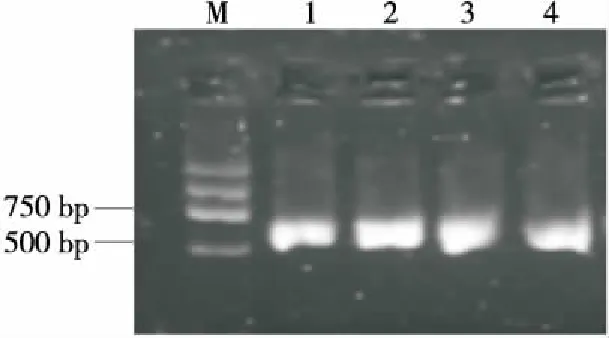
M. DL2000 DNA marker 1. nz2的PCR产物 2. nz3的PCR产物 3. nz4的PCR产物 4. nz8的PCR产物图1 酵母菌株的5.8S rDNA-ITS区基因PCR扩增结果Figure 1 DNA amplification resuLts of the strains

图2 比对结果发育树Figure 2 Phylogenetic tree analysis of the results compared
2.3 酵母菌生长曲线
由图3可知,菌株nz3和nz4的生长趋势大体一致,均先升高后降低。当培养时间为10~12 h时,两株菌的OD值增长幅度相近,但变化不大,此期间为生长曲线中的延滞期;当培养时间为12~22 h时,两株菌的OD值增长速率较大,接近于倍数增长,nz4的OD值较nz3更大,此期间为生长曲线中的对数期;当培养时间为22~33 h时,两株菌的OD值的变化趋于平稳,先逐渐增大至最大值后降低,nz3的增长速率由小变大再降低,OD值在29 h处达最大,nz4的增长速率保持平稳再降低,OD值在30 h处达最大值且大于nz3的,此期间为生长曲线中的平稳期;当培养时间为33~34 h时,两株菌的OD值均下降,且下降幅度较大,此期间为生长曲线的衰亡期。综上,两种酵母菌在29~30 h范围内生长更好。
2.4 酵母菌的耐受性
2.4.1 耐乙醇性 由图4可知,两种酵母菌在不同乙醇浓度下变化趋势基本一致,OD值逐渐减小并趋近于0。当乙醇体积分数为0%~5%时,两种酵母菌的OD值下降幅度较大,当乙醇体积分数为5%时,nz3、nz4的OD分别为0.1,0.5左右;当乙醇体积分数为5%~11%时,nz3的OD值变化幅度较小,在乙醇体积分数为11%时变为0,nz4的OD值在乙醇体积分数5%~7%时下降幅度较大,在乙醇体积分数为7%~11%时,nz4的OD值持续减小并接近于0。同样的生长条件下,nz4的OD值比nz3的更大,说明nz4的乙醇耐受性比nz3的更好。
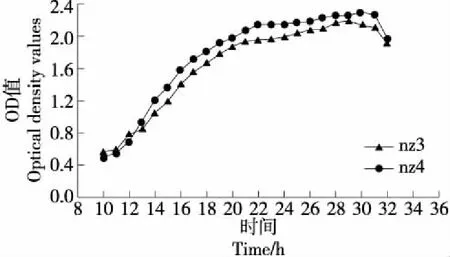
图3 两株酵母菌的生长曲线Figure 3 The growth curve of two yeast strains
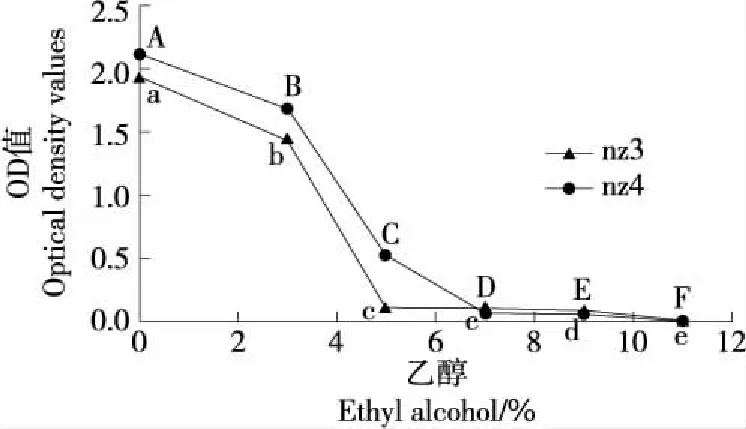
字母不同表示差异显著(P<0.05)图4 两株酵母菌的乙醇耐受性Figure 4 Study on ethanol tolerance of two yeast strains
2.4.2 耐温性 由图5可知,两种酵母菌的OD值变化趋势一致,均先升高后降低。当温度为20~29 ℃时,两种酵母菌的OD值持续上升,在29 ℃时达最大值,且nz4的增长幅度更大;当温度为29~44 ℃时,两种酵母菌的OD值持续下降,nz3的下降幅度较大,在44 ℃时接近0,nz4在29~38 ℃时下降幅度较小,在38 ℃后急剧下降,44 ℃时接近0。同样的生长环境下,nz4的OD值高于nz3,因此nz4的耐温性更好。
2.4.3 耐酸性 由图6可知,两种酵母菌的OD值变化趋势一致,均先平稳后上升再下降。当pH为2.0~3.5时,nz3的OD值是pH 3.0开始大幅度上升,在pH 3.5时达1.4左右,nz4的OD值从pH 2.0开始急剧增长,在pH 3.5 时达1.8左右;当pH为3.5~5.5时,nz3的OD值仍在增长,从1.4增长至1.6左右,而nz4的增长幅度较小,变化趋于平缓,在pH 5.5时达最大值1.9;当pH从5.5增加至6.0时,两种酵母菌的OD值均下降至1.6左右。
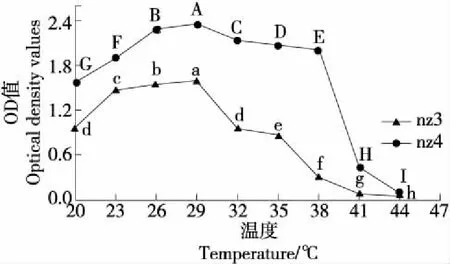
字母不同表示差异显著(P<0.05)图5 两株酵母菌的温度耐受性Figure 5 Study on temperature tolerance of two yeast strains
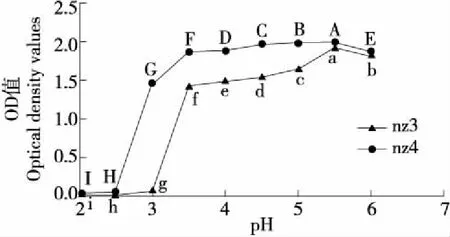
字母不同表示差异显著(P<0.05)图6 两株酵母菌的酸度耐受性Figure 6 Study on the acidity tolerance of two yeast strains
同样的生长环境下,nz4的OD值高于nz3,说明nz4在酸性条件下比nz3更适合生存。
综上,空气中的酵母菌在酿造特性方面表现优良,与酒醅或大曲中的酵母菌性能[25]相近,表明空气中的酵母菌也能在酿造环境下很好地生长并代谢出有益物质,可进一步将空气中微生物进行培养优化,使酒质更优、风味更佳。
2.5 酵母菌代谢产物
由表2可知,两种酵母菌的优势产物均为乙醇和己酸乙酯,并含有少量的酸、高级醇、酯类、酚类等芳香类物质,可构成白酒香味成分[26],其中己酸乙酯是浓香型白酒的香味主体成分。nz3的代谢产物中乙醇和己酸乙酯含量较高,还产生了苯乙醇和2,3-丁二醇,这两种物质是发酵产生的中间物,可以构成一些香味物质,能对酒体产生正面影响;nz4的代谢产物中乙醇、丁醇、苯乙醇、己酸乙酯、辛酸乙酯含量高于nz3,其发酵效果优于nz3。综上,nz4的产酒能力和产香能力都较好,可对其进行进一步发酵试验,并且通过观察其产物的含量变化,利用生理生化试验优化其产醇和产香的能力。此外,生香酵母用于浓香型白酒、酱香型白酒生产中对白酒产量的提高具有明显效果[27-28]。因此,可以从生香方向研究筛选出的胶红酵母和季也蒙毕赤酵母,对酵母菌的代谢产物进行分析,进一步探究其产酒、产香作用,使之可应用于白酒生产,赋予白酒风味物质,提高白酒质量。
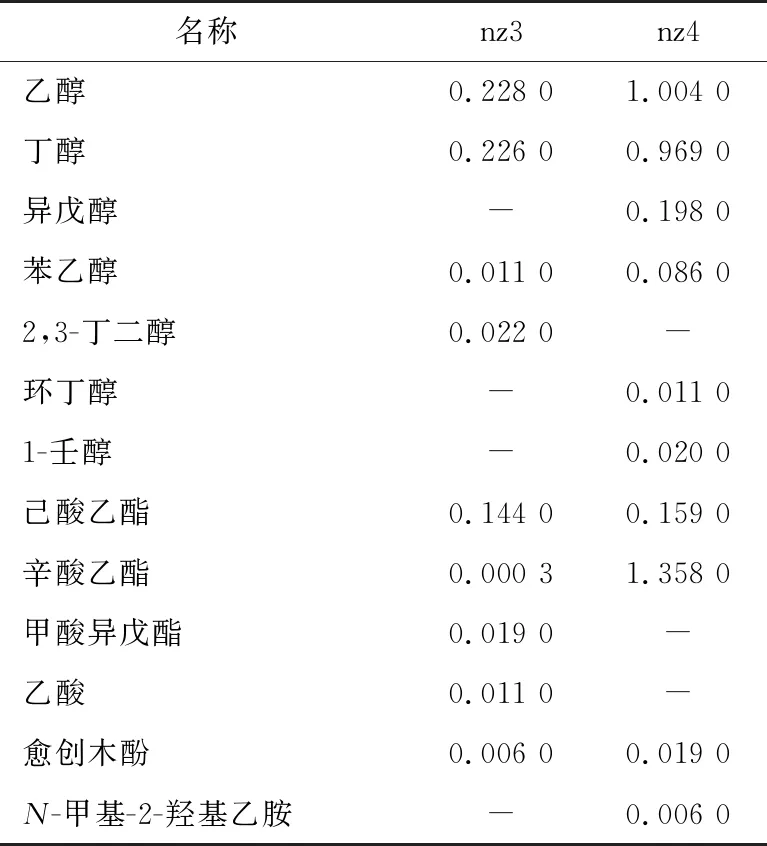
表2 两株酵母的发酵产物†
3 结论
以浓香型白酒酿造车间空气微生物为研究对象,利用YPD培养基和麦芽汁培养基对其进行分离鉴定,并采用GC-MS分析技术,对空气微生物中的酵母菌进行代谢产物分析。结果表明:① 空气微生物中大部分可培养的微生物包含细菌、霉菌和酵母菌,并筛选鉴定出了两种酵母菌,分别是胶红酵母(R.mucilaginosa)和季也蒙毕赤酵母(M.guilliermondii)。② 两种酵母菌最适生长时间为29~30 h,季也蒙毕赤酵母对乙醇、温度、酸的耐受性优于胶红酵母。③ 两种酵母菌均可应用于酿造生产并提高酒质和风味,其优势产物有乙醇、己酸乙酯,还有少量高级醇、酯类、酚类等芳香成分。试验对酵母菌进行了分离,但是参与白酒酿造的微生物还有霉菌、放线菌等多种微生物[29]。因此,对空气中微生物种类的筛选可多样化,还可将试验所得酵母菌与空气中的霉菌、放线菌等结合,探究不同种类菌种的复合发酵效果。

