大动脉炎颈动脉受累超微血流成像显像与声学造影的对比研究
王福霞,米成嵘,李卫勇,王琰娟,汪 彤,王 丽,李 霞,王 文
大动脉炎(TA)是一种累及主动脉及其分支的慢性非特异性炎症性血管疾病[1],活动期与非活动期交替存在,免疫抑制剂可控制活动期病变发展,但是长期使用对身体副作用较大。因而,大动脉炎活动性的准确评估是临床中有待解决的问题,关系到患者治疗方案的选择及预后。近年来有学者发现动脉管壁内新生血管与大动脉炎活动性的程度有相关性[2]。目前超声造影(CEUS)被认为是新生血管影像学检查的金标准[3],但造影剂价格昂贵,且偶有过敏病例报道。本研究应用超微血流成像技术(SMI)观察大动脉炎受累颈动脉管壁增厚处新生血管情况,并与超声造影比较,以了解SMI技术在大动脉炎中不同程度活动期诊断的应用价值。
1 资料与方法
1.1 一般资料:选取2018年4月-2020年4月在我院诊断颈动脉受累的大动脉炎患者27例,共51处病变区。TA诊断标准参考1990年放射学会制定的标准[3],男性4例8处病变区,年龄25~39岁,平均年龄(33.00±6.32)岁;女性23例43处病变区,年龄21~35岁,平均年龄(27.39±4.10)岁,病变区均位于颈总动脉主干。参考美国国立卫生研究院提出的判断大动脉炎活动性的标准[4],将患者分为活动性组22例42处病变,非活动性组5例9处病变,超声造影前,患者家属签署知情同意书。
1.2 检查仪器:采用东芝Aplio500型彩色多普勒超声诊断仪,具备SMI和CEUS成像软件,探头选择L9-11,频率7~15 MHz。
1.3 检查方法:所有患者均在超声检查前进行实验室血沉(ERS)及C反应蛋白(CRP)的测定,由一位副主任医生进行颈动脉超声检查,分为二维超声检查、SMI检查及超声造影检查。
1.3.1 二维超声检查:患者平卧位,头侧向检查对侧,充分暴露颈部,先进行二维常规超声检查。横切由颈总动脉近心端(无名动脉)至远端扫查,选择颈动脉管壁较厚处,纵切面局部放大,进行管壁厚度的测量,测量游标置于内层高回声线的内缘及管壁外侧高回声线的内缘即病变区中低回声带的外缘,二者连线与管壁长轴垂直,每个测量点均测量3次,取3次的平均值作为最终测量值[5]。
1.3.2 SMI检查:启动SMI技术观察受累动脉管壁增厚处,管壁中点状、线状强回声最丰富的切面,并将其定性分级。
1.3.3 CEUS检查:启动CEUS模式,机械指数(Mechanical index,MI)0.14,造影剂采用意大利Bracco公司的SonoVue,经肘正中静脉快速团注SonoVue造影剂2.4 mL,随后推注5 mL 0.9%氯化钠溶液进行冲管,同一部位两次造影之间至少间隔15 min;造影结束后观察15 min,患者无不良反应方可离开。观察并存储动态图像全过程用于分析。
1.4 新生血管分级标准:CEUS显示新生血管的造影剂微泡和SMI显示新生血管的信号均为点状或线状强回声,因此,CEUS与SMI使用相同的分级标准。新生血管分级标准[6]:0级,无强回声;Ⅰ级,有1~4个点状或1~2条短线状强回声;Ⅱ级,4个点状或2条短线状强回声。
2 结果
2.1 活动期组与非活动期组患者受累颈动脉管壁厚度、ESR及CRP比较:活动期组管壁厚度明显大于非活动期组(P<0.05)。活动期组患者ESR、CRP测值高于非活动期组(P<0.05),见表1。

表1 活动期组与非活动期组受累颈动脉管壁厚度、ESR及CRP比较
2.2 活动期组与非活动期组颈动脉管壁增厚处新生血管SMI与CEUS增强情况比较:本研究组共27例,头臂型大动脉炎患者受累颈动脉管壁增厚51处,活动期组42处、非活动期组9处。活动期组与非活动期组颈动脉管壁增厚处新生血管SMI与CEUS增强情况比较,见表2。活动期组SMI与CEUS具有很好的一致性(Kappa=0.954,P<0.05),见表3,非活动期组SMI与CEUS具有较好的一致性(Kappa=0.609,P>0.05),见表4。
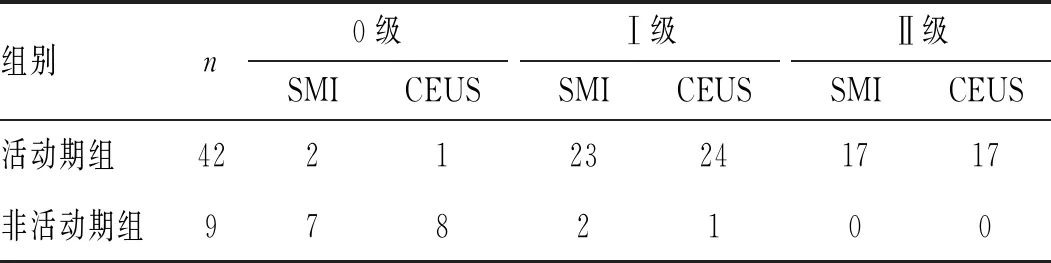
表2 活动期组与非活动期组颈动脉管壁增厚处新生血管SMI与CEUS增强情况比较

表3 活动期组大动脉炎活动期患者颈动脉管壁增厚处新生血管SMI与CEUS的分级情况

表4 非活动期组大动脉炎非活动期患者颈动脉管壁增厚处新生血管SMI与CEUS的分级情况
3 讨论
目前,国内外对TA的诊断主要基于累及病变血管的影像学特征和临床表现,并以血清学中ESR、CRP实验室检查作为辅助诊断指标[7]。TA与肌纤维发育不良、动脉粥样硬化等疾病引起的临床症状和体征均难以鉴别,因此TA临床诊断及治疗需依靠影像学检查结合实验室指标。DSA、CTA、MRA和PET-CT几种呈像方式均有其缺点[8]。近年来,超声造影被认为是新生血管影像学检查的“金标准”[3],但造影剂价格昂贵,且偶有过敏病例报道。SMI对低速血流或低速流量的微小血管有较高的灵敏度,为观察增厚管壁中新生的滋养血管提供可能,能清晰显示管壁增厚内新生血管的结构[9-11]。颈动脉是TA常见的受累部位,超声分辨力高,能够清晰显示颈动脉的管腔内及管壁结构情况,可对TA做出早期判断[6],因此,本研究选择头臂型大动脉炎颈总动脉管壁受累的患者进行研究。
病变处于活动期时,有不同程度的淋巴细胞、巨噬细胞和浆细胞由动脉管壁外膜向中膜及内膜浸润,各类因子互相作用,新生血管内皮细胞启动、激活、迁移,新生血管管腔构成,动脉管壁中新生血管形成。随着炎症反应的消退,非活动期时管壁则以纤维母细胞、胶原纤维增生为主,直到后期出现纤维化、瘢痕化、有功能的滋养血管的密度减少[12-13]。本研究结果显示TA活动期受累颈动脉管壁厚度明显大于非活动期,与王立娟等[6]研究结果不相符,主要因为管壁厚度的测量差异,TA病理变化过程由外膜向中膜及内膜浸润,推测受累颈动脉管壁厚度的准确测量值应是管壁全层厚度,而非内中膜厚度。管壁全层由内至外的回声分为高-低-中-高回声,内侧高回声是管腔内无回声与管壁内膜声阻抗差大形成的高回声线;外侧高回声是管壁外炎性浸润与血管周围组织间声阻抗产生的,所以增厚管壁厚度应是两层高回声之间厚度的测量。研究结果中SMI与CEUS结果不相符的是CEUS显示0级1处无血流信号病变区,SMI误诊为Ⅰ级有短线状血流信号,主要原因是此处病变区病理过程已处于非活动期后期,管壁纤维化、瘢痕化形成线状强回声,SMI误判为线状新生血管强回声。为了避免今后研究中此类情况的误诊,提示今后研究中将二维及SMI实时双幅图像观察,应选择测量键游标至二维图像增厚管壁内强回声所在位置,如果SMI图像中另一测量键与强回声所在部位相同,表明为钙化,反之为新生血管;或者探头保持不动仔细观察,SMI条件下强回声信号是否有闪烁,有闪烁表明是新生血管,反之则为钙化[14]。本研究样本量偏小,需后期扩大样本量,进一步证实此结论。
超声SMI技术是一种安全、快速、便携的无创性评价大动脉炎颈动脉管壁炎症的检查技术,可以作为评估大动脉炎患者的疾病活动性的指标,为临床治疗提供客观的依据。

