田蓟苷抗脑缺血再灌注程序性坏死的作用及机制研究
李海宁,郑瑞芳,都研文,王 文,孙芳玲,刘砥威,邢建国*
田蓟苷抗脑缺血再灌注程序性坏死的作用及机制研究
李海宁1,郑瑞芳2,都研文2,王 文3,孙芳玲3,刘砥威2,邢建国2*
1. 石河子大学药学院,新疆 石河子 832000 2. 新疆维吾尔自治区药物研究所,新疆 乌鲁木齐 830002 3. 首都医科大学宣武医院,北京 100053
研究田蓟苷抗脑缺血再灌注损伤程序性坏死的作用及机制。人神经母细胞瘤细胞SH-SY5Y用Caspase抑制剂Z-VAD-FMK预处理16 h后缺氧培养6 h、复氧培养2 h建立脑缺血再灌注程序性坏死模型,在缺氧前6 h给予田蓟苷进行干预。采用Hoechst33342/PI染色检测坏死细胞数目;采用CCK-8法检测细胞活力;采用ELISA法检测细胞上清中乳酸脱氢酶(lactate dehydrogenase,LDH)活性和白细胞介素-1β(interleukin-1β,IL-1β)、IL-6、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)水平及细胞内活性氧(reactive oxygen species,ROS)水平和线粒体通透性转换孔(mitochondrial permeability transition pore,mPTP)的变化;采用荧光显微镜检测细胞线粒体膜电位变化;采用Western blotting法检测细胞程序性坏死通路相关蛋白如受体相互作用蛋白3(receptor interacting protein kinase 3,RIPK3)、混合系结构域样蛋白(mixed lineage kinase domain-like protein,MLKL)、钙/钙调蛋白依赖性激酶II(calcium/calmodulin-dependent protein kinase Ⅱ,CaMKⅡ)、磷酸甘油酸变位酶5(phosphoglycerate mutase family 5,PGAM5)表达情况。与模型组比较,田蓟苷组细胞存活率显著提高(<0.05);细胞上清中LDH活性和IL-1β、IL-6、TNF-α水平均显著降低(<0.05);细胞内ROS水平显著降低(<0.05);细胞线粒体膜电位显著升高(<0.05),mPTP开放被显著抑制(<0.05);细胞RIPK3、MLKL、CaMKⅡ和PGAM5蛋白表达水平均显著降低(<0.05)。田蓟苷可能通过抑制程序性坏死途径,保护线粒体,从而发挥抑制脑缺血再灌注损伤的作用。
田蓟苷;人神经母细胞瘤细胞;程序性坏死;线粒体;受体相互作用蛋白3
脑缺血再灌注会导致严重的炎症和氧化应激,从而加剧缺血损伤[1]。细胞死亡为脑缺血再灌注损伤发生的主要事件之一。以往研究多集中于细胞凋亡,而细胞程序性坏死是一种不同于细胞凋亡的细胞死亡方式,具有坏死样结构特点,受细胞内一系列信号分子调控[2-4]。抑制程序性坏死通路后,大部分缺血再灌注诱导的细胞死亡受到抑制[5]。因此,脑缺血再灌注损伤后程序性坏死相关通路的激活是治疗脑缺血再灌注损伤的潜在靶点[6]。当程序性坏死发生时,受体相互作用蛋白3(receptor interacting protein kinase 3,RIPK3)作为程序性坏死关键调控蛋白,使混合系结构域样蛋白(mixed lineage kinase domain-like protein,MLKL)被磷酸化和寡聚化,进而导致线粒体损伤和细胞膜破裂[7-8]。钙/钙调蛋白依赖性激酶II(calcium/calmodulin-dependent protein kinase Ⅱ,CaMKII)是RIPK3的底物,CaMKⅡ被RIPK3磷酸化后,线粒体通透性转换孔(mitochondrial permeability transition pore,mPTP)大量开放,线粒体受损,加剧炎症反应[9]。
田蓟苷是新疆民族药香青兰中的主要活性成分[10],课题组前期研究发现,田蓟苷可以促进脑血管新生,对脑缺血再灌注损伤大鼠模型脑组织具有一定保护作用,可以通过调控活性氧(reactive oxygen species,ROS)/CaMKⅡ通路,抑制线粒体损伤,并抑制人神经母细胞瘤细胞SH-SY5Y死亡[11-12]。本研究首先从调控RIPK3通路抑制程序性坏死角度来探讨田蓟苷抗脑缺血再灌注损伤的作用及机制,为其治疗脑缺血再灌注损伤提供依据。
1 材料
1.1 细胞
SH-SY5Y细胞由中国医学科学生物研究所惠赠。
1.2 药品与试剂
田蓟苷(批号20170805,质量分数≥98%)由新疆维吾尔自治区药物研究所自制;胎牛血清(批号10099-141C)、无糖培养基(批号119660225)购自美国Gibco公司;0.25%胰酶(批号SH3004201)、DMEM高糖培养基(批号SH30022.01)购自美国Hyclone公司;厌氧袋(批号C-1)购自日本三菱公司;Caspase抑制剂Z-VAD-FMK(批号s702304)购自美国Selleckchem公司;CCK-8试剂盒(批号AR1160-500)、磷酸酶抑制剂(批号AR1183)购自武汉博士德生物工程有限公司;乳酸脱氢酶(lactate dehydrogenase,LDH)细胞毒性检测试剂盒(批号C0016)、SDS-PAGE凝胶快速配制试剂盒(批号P0012AC)购自上海碧云天生物技术有限公司;BCA蛋白定量试剂盒(批号23227)购自美国Pierce公司;DCFH-DA活性氧荧光探针(批号CA1410)、RIPA裂解液(批号R0010)、蛋白酶抑制剂PMSF(批号P0100)、白细胞介素-1β(interleukin-1β,IL-1β)试剂盒(批号SEKH-0002)、IL-6试剂盒(批号SEKH-0047)和肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)试剂盒(批号SEKH-0013)、线粒体膜电位试剂盒(批号M8650)购自北京索莱宝生化试剂有限公司;mPTP检测试剂盒(批号BB-48122)购自上海贝博生物科技有限公司;蛋白marker(批号26616)购自美国Thermo Fisher Scientific公司;RIPK3抗体(ab62344)、MLKL抗体(批号ab255747)、CaMKⅡ抗体(批号ab22609)、磷酸化CaMKⅡ(p-CaMKⅡ)抗体(批号ab182647)、磷酸甘油酸变位酶5(phosphoglycerate mutase family 5,PGAM5)抗体(批号ab126534)购自英国Abcam公司;磷酸化MLKL(p-MLKL)抗体(批号91689)购自美国CST公司;甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)抗体(批号TA-08)、IgG/辣根酶标记山羊抗小鼠抗体(批号ZB-2305)、IgG/辣根酶标记山羊抗兔抗体(批号ZB-2301)购自北京中杉金桥生物技术有限公司;ECL发光液(批号WBKLS0500)购自美国Millipore公司。
1.3 仪器
HERA cell-150i细胞培养箱(美国Thermo Fisher Scientific公司);SPARK多功能微孔板检测仪(瑞士Tecan公司);FUSION FX6多功能成像系统购自(法国Vilber公司);电泳仪(美国Bio-Rad公司);TGL-16K离心机(湖南湘仪实验室仪器开发有限公司);荧光显微镜(美国invitrogen公司)。
2 方法
2.1 药物配制
田蓟苷和Z-VAD-FMK分别溶于DMSO,配制成质量浓度为10 mg/mL的母液。
2.2 细胞培养
SH-SY5Y细胞用含10%胎牛血清的DMEM高糖培养基于37 ℃、5% CO2培养箱中培养。
2.3 Z-VAD-FMK对SH-SY5Y细胞程序性坏死的影响
取处于对数生长期的SH-SY5Y细胞,以2×105/mL接种于6孔板中,培养12 h。设置对照组、模型组和Z-VAD-FMK组。Z-VAD-FMK组加入药物(Z-VAD-FMK母液以DMEM高糖培养基稀释),对照组和模型组加入不含药物的DMEM高糖培养基,培养16 h。弃去培养基,Z-VAD-FMK组加入药物(Z-VAD-FMK母液以无糖培养基稀释),对照组和模型组加入不含药物的无糖培养基,对照组正常培养8 h;将模型组和Z-VAD-FMK组的96孔板置于缺氧盒中,于培养箱中培养6 h;打开缺氧盒,取出96孔板,加入含10%胎牛血清的DMEM高糖培养基,于培养箱中培养2 h。模型组和Z-VAD-FMK组缺氧培养6 h,复氧培养2 h。按照Hoechst 33342/PI试剂盒说明书检测坏死细胞
2.4 田蓟苷对SH-SY5Y细胞存活率的影响
取处于对数生长期的SH-SY5Y细胞,以6×104/mL接种于96孔板中,培养12 h。设置对照组、模型组和田蓟苷组(2.5、5.0、10.0 μg/mL),除对照组外,各组加入以DMEM高糖培养基稀释的Z-VAD-FMK,培养10 h后,田蓟苷组加入不同质量浓度的药物(田蓟苷母液以DMEM高糖培养基稀释),对照组和模型组加入不含药物的DMEM高糖培养基,培养6 h。弃去培养基,除对照组外,其余各组加入以无糖培养基稀释的Z-VAD-FMK,田蓟苷组另加入不同质量浓度的药物(田蓟苷母液以无糖培养基稀释),对照组和模型组加入不含药物的无糖培养基,对照组正常培养8 h;模型组和给药组缺氧培养6 h,复氧培养2 h。每孔加入10 μL CCK-8溶液,培养2 h,采用多功能微孔板检测仪于450 nm处测定吸光度()值。
2.5 田蓟苷对SH-SY5Y细胞上清中LDH活性的影响
按“2.4”项下方法处理细胞,取上清,400×离心5 min,取120 μL至96孔板中,加入60 μL LDH工作液,混匀,室温避光孵育30 min,采用多功能微孔板检测仪于490 nm处测定值。
2.6 田蓟苷对SH-SY5Y细胞ROS水平的影响
按“2.4”项下方法处理细胞,弃去培养基,加入DCFH-DA,于37 ℃孵育20 min,用无血清培养基洗涤3次,采用多功能微孔板检测仪于488 nm处测定激发波长,525 nm处测定发射波长。荧光强度与ROS水平呈正相关。
2.7 田蓟苷对SH-SY5Y细胞上清液中炎性因子水平的影响
取处于对数生长期的SH-SY5Y细胞,以2×105/mL接种于6孔板中,培养12 h。按“2.4”项下方法处理细胞,取上清液离心,按照试剂盒说明书检测上清液中IL-1β、IL-6和TNF-α水平。
2.8 田蓟苷对SH-SY5Y细胞线粒体膜电位的影响
取处于对数生长期的SH-SY5Y细胞,以2×105/mL接种于6孔板中,培养12 h。按“2.4”项下方法处理细胞,弃去培养基,PBS洗涤1次,加入1 mL培养基和1 mL线粒体膜电位染色工作液,混匀,于37 ℃孵育20 min,弃上清,用线粒体膜电位染色缓冲液洗涤2次,加入2 mL培养基,于荧光显微镜下观察并拍照。线粒体膜电位较高时,产生红色荧光;线粒体膜电位较低时,产生绿色荧光。
2.9 田蓟苷对SH-SY5Y细胞线粒体mPTP的影响
按“2.4”项下方法处理细胞,收集细胞,使用HBSS缓冲液重悬,制成密度为1×106/mL的细胞悬液。取500 μL细胞悬液,加入5 μL染色工作液,混匀后,于37 ℃避光孵育15 min;模型组和给药组加入5 μL荧光淬灭剂,混匀,于37 ℃避光孵育15 min,1000×离心5 min,收集细胞,使用HBSS缓冲液重悬细胞,采用多功能微孔板检测仪于488 nm处测定激发波长,525 nm处测定发射波长。mPTP开放时,荧光淬灭剂进入线粒体,荧光强度变弱。
2.10 田蓟苷对SH-SY5Y细胞免疫印迹法检测蛋白表达
取处于对数生长期的SH-SY5Y细胞,以2×105/mL接种于6孔板中,培养12 h。按“2.4”项下方法处理细胞,收集细胞,加入含PMSF和磷酸酶抑制剂的裂解液提取蛋白,采用BCA蛋白定量试剂盒测定蛋白质量浓度,加入上样缓冲液,100 ℃加热变性。蛋白样品经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,转至PVDF膜,封闭后加入RIPK3、MLKL、CaMKⅡ、p-CaMKⅡ、PGAM5、p-MLKL、GAPDH抗体,孵育过夜,加入IgG/辣根酶标记山羊抗小鼠/兔抗体,孵育,加入ECL显影,采用多功能成像系统采集图像并用Image J软件分析。
2.11 数据处理
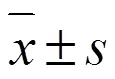
3 结果
3.1 Z-VAD-FMK对SH-SY5Y细胞程序性坏死的影响
如图1所示,PI将处于坏死的细胞染为红色,正常细胞和中早期凋亡细胞则被Hoechst着色为蓝色。与模型组比较,Z-VAD-FMK显著促进SH-SY5Y细胞坏死(<0.05)。
与模型组比较:*P<0.05
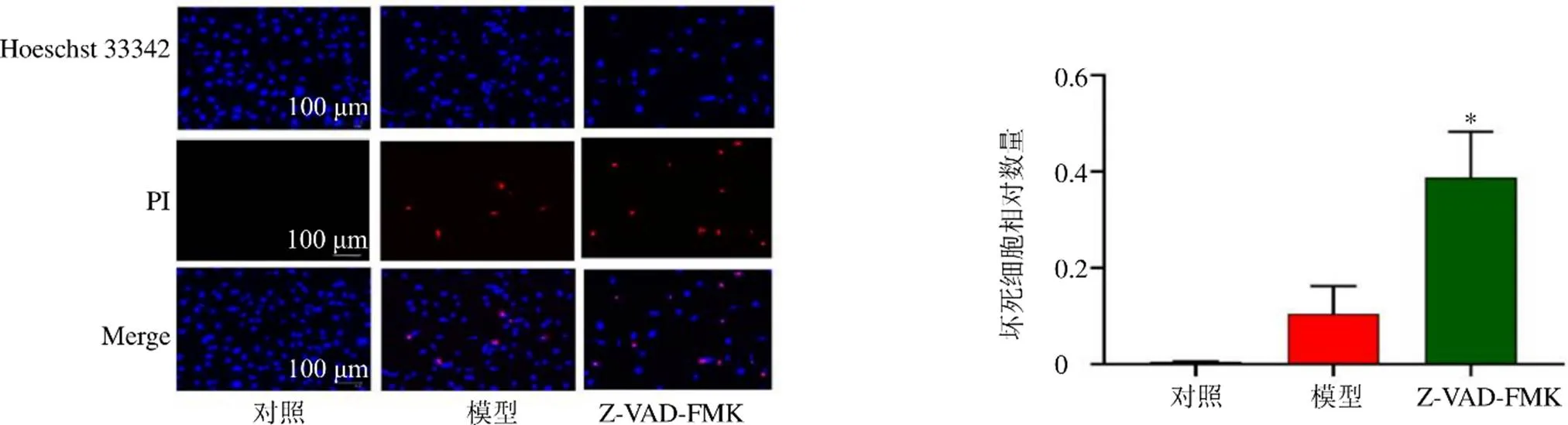
3.2 田蓟苷对SH-SY5Y细胞存活率和上清中LDH活性的影响
如图2所示,与对照组比较,模型组细胞存活率显著降低(<0.05),上清中LDH活性显著升高(<0.05);与模型组比较,田蓟苷组细胞存活率显著升高(<0.05),上清中LDH活性显著降低(<0.05),呈剂量相关性。
3.3 田蓟苷对SH-SY5Y细胞ROS水平的影响
如图3所示,与对照组比较,模型组细胞ROS水平显著升高(<0.05);与模型组比较,田蓟苷组细胞ROS水平显著降低(<0.05),且呈剂量相关性。
3.4 田蓟苷对SH-SY5Y细胞上清液中炎性因子水平的影响
如图4所示,与对照组比较,模型组细胞上清液中IL-1β、IL-6和TNF-α水平显著升高(<0.05);与模型组比较,田蓟苷(2.5 μg/mL)组细胞上清液中IL-1β和IL-6水平显著降低(<0.05),田蓟苷(5、10 μg/mL)组细胞上清液中IL-1β、IL-6和TNF-α水平均显著降低(<0.05)。
与对照组比较:#P<0.05;与模型组比较:*P<0.05,下图同
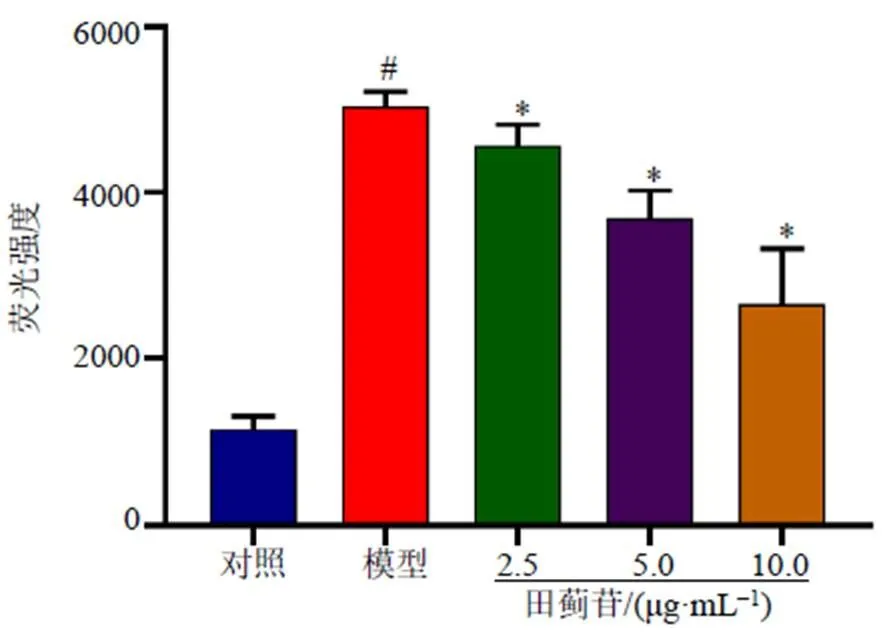
图3 田蓟苷对SH-SY5Y细胞ROS水平的影响 ()
3.5 田蓟苷对SH-SY5Y细胞线粒体膜电位和mPTP的影响
如图5所示,与对照组比较,模型组细胞线粒体膜电位和线粒体荧光强度均显著降低(<0.05),表明mPTP开放;与模型组比较,田蓟苷组细胞线粒体膜电位和线粒体荧光强度显著升高(<0.05)。
3.6 田蓟苷对SH-SY5Y细胞RIPK3、MLKL、CaMKⅡ和PGAM5蛋白表达的影响
如图6所示,与对照组比较,模型组细胞RIPK3、p-MLKL/MLKL、p-CaMKⅡ/CaMKⅡ和PGAM5蛋白表达水平均显著升高(<0.05);与模型组比较,田蓟苷(2.5 μg/mL)组细胞p-MLKL/MLKL、p-CaMKⅡ/ CaMKⅡ和PGAM5蛋白表达水平显著降低(<0.05),田蓟苷(5、10 μg/mL)组细胞RIPK3、p-MLKL/ MLKL、p-CaMKⅡ/CaMKⅡ和PGAM5蛋白表达水平均显著降低(<0.05)。
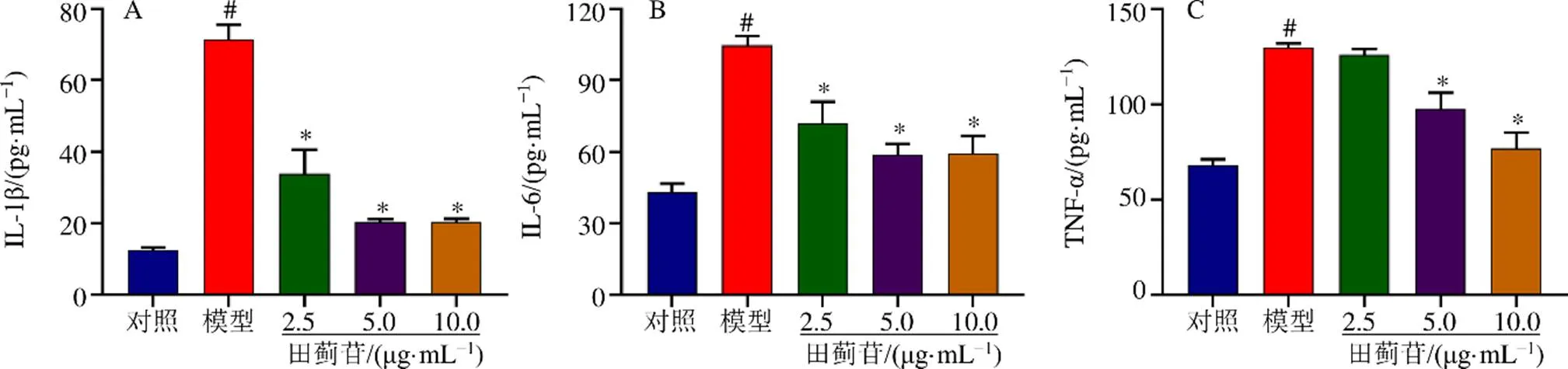
图4 田蓟苷对SH-SY5Y细胞上清液中IL-1β (A)、IL-6 (B)和TNF-α (C)水平的影响()
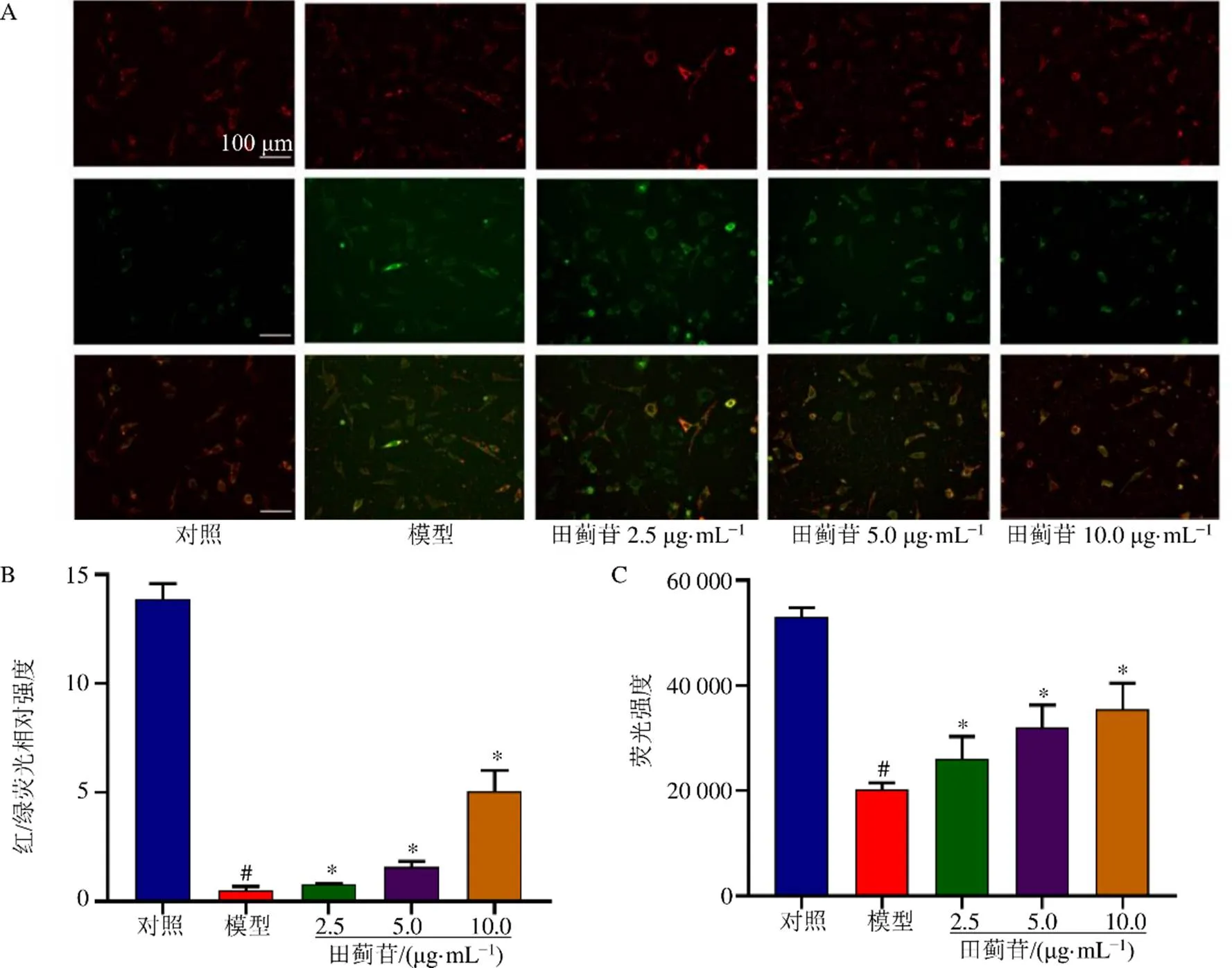
图5 田蓟苷对SH-SY5Y细胞线粒体膜电位 (A、B) 和mPTP (C) 的影响 ()
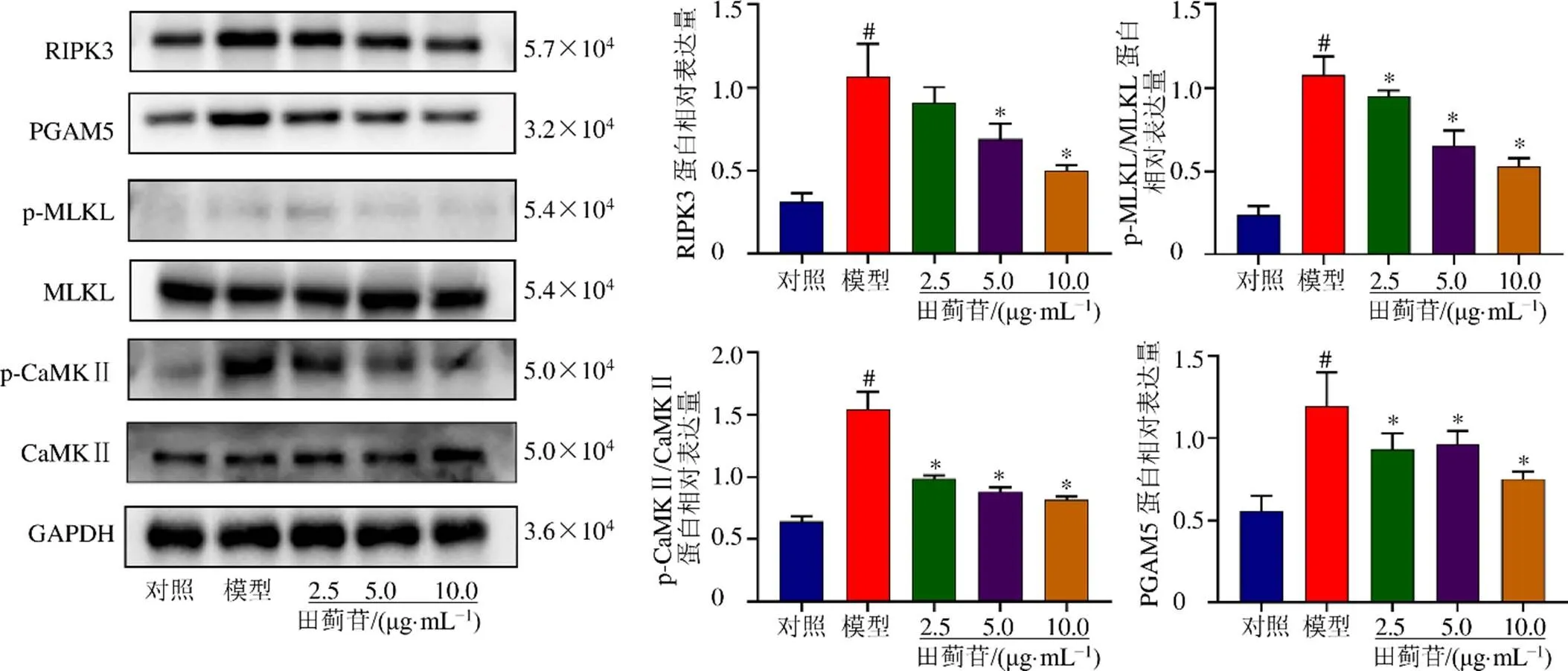
图6 田蓟苷对SH-SY5Y细胞RIPK3、MLKL、CaMKⅡ和PGAM5蛋白表达的影响()
4 讨论
与细胞凋亡不同,程序性坏死过程不涉及关键的细胞凋亡调节因子。程序性坏死过程中,死亡细胞的形态如早期丧失浆膜完整性、缺乏核碎裂、线粒体功能障碍和氧化应激与细胞坏死类似[3]。多种中枢神经系统损伤疾病的发病机制均涉及程序性坏死,通过干预程序性坏死信号通路,对中枢神经系统损伤尤其是脑缺血再灌注损伤具有一定的保护作用[13-15]。
课题组前期研究发现,香青兰总黄酮能够保护阿霉素损伤的心肌细胞[16];其中的单体成分田蓟苷可以有效抑制糖氧剥夺后细胞中CaMKⅡ依赖性线粒体介导的细胞凋亡和丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)/核因子- κB(nuclear factor-κB,NF-κB)炎症通路的激活,对高血压、高血脂、动脉粥样硬化大鼠具有显著改善作用,并对心肌和大脑缺血再灌注损伤有显著保护作用[11-12]。因此,田蓟苷在心脑血管疾病的防治中具有广阔的应用前景。
程序性坏死是在凋亡执行被阻止的情况下,凋亡受体的死亡结构域诱导的坏死性细胞死亡[7-8]。在体外诱导细胞凋亡基础上,使用Caspase抑制剂Z-VAD-FMK进行干预,可以使细胞发生程序性坏死[17]。基于前期研究,本研究采用缺氧6 h、复氧2 h的方法模拟缺血再灌注脑损伤,联合Z-VAD-FMK诱导SH-SY5Y细胞发生程序性坏死,结果显示,模型组细胞坏死细胞显著升高,上清液中LDH活性和细胞内ROS水平显著升高,线粒体膜电位降低、mPTP开放,表明模型建立成功;田蓟苷对SH-SY5Y细胞程序性坏死具有保护作用。
在程序性坏死细胞中,RIPK3可直接磷酸化MLKL的第357位苏氨酸和第358位丝氨酸,p-MLKL可作为程序性坏死的特异性标志物[7]。MLKL能够诱导线粒体丝氨酸/苏氨酸磷酸酶(PGAM5),从而导致线粒体损伤,如线粒体膜电位降低、线粒体通道开放等[8]。Zhang等[9]发现了由RIPK3-CaMKⅡ通路介导的一种程序性细胞坏死机制,RIPK3-CaMKⅡ通路激活后,RIPK3通过激活CaMKⅡ,造成心肌细胞的程序性坏死及继发的恶性心脏重构和心力衰竭。程序性坏死通路激活后,MLKL能够与线粒体损伤相关蛋白PGAM5结合,进而导致线粒体损伤。本研究结果显示,模型组细胞RIPK3、p-MLKL、p-CAMKⅡ和PGAM5蛋白表达水平均显著升高,田蓟苷组细胞RIPK3、p-MLKL、p-CAMKⅡ和PGAM5蛋白表达水平均显著降低,表明田蓟苷可能通过抑制程序性坏死通路相关蛋白表达,从而保护SH-SY5Y细胞。
程序性坏死发生后,大量释放IL-1β、IL-6、TNF-α等炎症因子,加重脑损伤[18-19]。敲除RIPK3的小鼠发生程序性坏死后,炎症反应得到明显改善,表明程序性坏死发生后,细胞内容物的释放是导致炎症反应的主要原因,抑制RIPK3可以保护细胞膜结构[20]。本研究结果显示,田蓟苷组细胞上清中炎性因子IL-1β、IL-6和TNF-α水平均降低,表明田蓟苷能够减轻发生程序性坏死后SH-SY5Y细胞的损伤。
综上所述,田蓟苷能够提高缺氧复氧损伤的SH-SY5Y细胞活力,其机制可能与保护细胞线粒体、调节程序性坏死通路蛋白RIPK3及其下游MLKL、CaMKⅡ的表达有关。
利益冲突 所有作者均声明不存在利益冲突
[1] Eltzschig H K, Eckle T. Ischemia and reperfusion-from mechanism to translation [J]., 2011, 17(11): 1391-1401.
[2] Degterev A, Huang Z, Boyce M,. Chemical inhibitor of nonapoptotic cell death with therapeutic potential for ischemic brain injury [J]., 2005, 1(2): 112-119.
[3] Galluzzi L, Vitale I, Aaronson S A,. Molecular mechanisms of cell death: Recommendations of the nomenclature committee on cell death 2018 [J]., 2018, 25(3): 486-541.
[4] Wu M Y, Yiang G T, Liao W T,. Current mechanistic concepts in ischemia and reperfusion injury [J]., 2018, 46(4): 1650-1667.
[5] Linkermann A, Bräsen J H, Darding M,. Two independent pathways of regulated necrosis mediate ischemia-reperfusion injury [J]., 2013, 110(29): 12024-12029.
[6] Liu C L, Zhang K, Shen H T,. Necroptosis: A novel manner of cell death, associated with stroke [J]., 2018, 41(2): 624-630.
[7] Wang H Y, Sun L M, Su L J,. Mixed lineage kinase domain-like protein MLKL causes necrotic membrane disruption upon phosphorylation by RIP3[J]., 2014, 54(1): 133-146.
[8] Wang Z G, Jiang H, Chen S,. The mitochondrial phosphatase PGAM5 functions at the convergence point of multiple necrotic death pathways [J]., 2012, 148(1/2): 228-243.
[9] Zhang T, Zhang Y, Cui M Y,. CaMKII is a RIP3substrate mediating ischemia-and oxidative stress-induced myocardial necroptosis [J]., 2016, 22(2): 175-182.
[10] Dastmalchi K, Damien Dorman H J, Laakso I,. Chemical composition and antioxidative activity of Moldavian balm (L.) extracts [J]., 2007, 40(9): 1655-1663.
[11] 马丽月, 曾诚, 郑瑞芳, 等. 田蓟苷对脑缺血再灌注损伤模型大鼠脑组织的保护作用研究 [J]. 中国药房, 2018, 29(20): 2805-2810.
[12] Jiang H, Fang J, Xing J,. Tilianin mediates neuroprotection against ischemic injury by attenuating CaMKII-dependent mitochondrion-mediated apoptosis and MAPK/NF-κB signaling [J]., 2019, 216: 233-245.
[13] 孟俊杰, 母得志, 屈艺. 坏死性凋亡在神经系统疾病中作用的研究进展 [J]. 基础医学与临床, 2016, 36(9): 1290-1294.
[14] 杨海玉, 刘勇. 中枢神经系统损伤疾病的坏死性凋亡机制研究进展 [J]. 临床与病理杂志, 2016, 36(3): 327-330.
[15] 赵振杰, 陈明, 俞照妹. 坏死性凋亡调节机制的研究进展 [J]. 吉林医学, 2015, 36(10): 2116-2117.
[16] 都研文, 郑瑞芳, 曾诚, 等. 香青兰总黄酮对阿霉素心肌毒性的保护机制研究 [J]. 中草药, 2019, 50(24): 6045-6051.
[17] Li X H, Yao X Y, Zhu Y Z,. The caspase inhibitor Z-VAD-FMK alleviates endotoxic shock via inducing macrophages necroptosis and promoting MDSCs- mediated inhibition of macrophages activation [J]., 2019, 10: 1824.
[18] 吴晨露, 谢南南, 周伸奥, 等. 程序性细胞坏死的分子机制及其在炎症中的作用 [J]. 中国细胞生物学学报, 2016, 38(1): 7-16.
[19] Chan F K M, Luz N F, Moriwaki K. Programmed necrosis in the cross talk of cell death and inflammation [J]., 2015, 33(1): 79-106.
[20] Silke J, Rickard J A, Gerlic M. The diverse role of RIP kinases in necroptosis and inflammation [J]., 2015, 16(7): 689-697.
Effect and mechanism of tilianin against necroptosis on cerebral ischemia- reperfusion
LI Hai-ning1, ZHENG Rui-fang2, DU Yan-wen2, WANG Wen3, SUN Fang-ling3, LIU Di-wei2, XING Jian-guo2
1. College of Pharmacy , Shihezi University, Shihezi 832000, China 2. Xinjiang Institute of Materia Medica, Urumqi 830002, China 3. Xuanwu Hospital, Capital Medical University, Beijing 100053, China
To study the effect and mechanism of tilianin against programmed necrosis of cerebral ischemia-reperfusion injury.Human neuroblastoma cells SH-SY5Y were pretreated with Caspase inhibitor Z-VAD-FMK for 16 h, then cultured under hypoxia for 6 h and reoxygenated for 2 h to establish a model of programmed cerebral ischemia-reperfusion necrosis. Tilianin was given for intervention 6 h before hypoxia. Hoechst33342/PI staining was used to detect the number of necrotic cells; CCK-8 method was used to detect cell viability; ELISA method was used to detect lactate dehydrogenase (LDH) activity and interleukin-1β (IL-1β), IL-6, tumor necrosis factor-α (TNF-α) levels in supernatant, intracellular reactive oxygen species (ROS) level and mitochondrial permeability transition pore (mPTP) changes in SH-SY5Y cells; Fluorescence microscopy was used to detect changes in cell mitochondrial membrane potential; Western blotting was used to detect expressions of receptor interacting protein kinase 3 (RIPK3), mixed-line domain-like proteins (MLKL), calcium/calmodulin-dependent protein kinase Ⅱ (CaMKⅡ) and phosphoglycerate mutase family 5 (PGAM5).Compared with model group, cell viability of tilianin group was significantly increased (< 0.05); LDH activity and levels of IL-1β, IL-6, TNF-α in supernatant were significantly decreased (< 0.05); ROS level were significantly reduced (< 0.05); Cell mitochondrial membrane potential was significantly increased (< 0.05); Mitochondrial membrane permeability transition pore (mPTP) opening was significantly inhibited (< 0.05); Expressions of RIPK3, MLKL, CaMKⅡ and PGAM5 were significantly decreased (< 0.05).Tilianin may protect mitochondria by inhibiting programmed necrosis pathway, thereby inhibiting cerebral ischemia-reperfusion injury.
tilianin; SH-SY5Y cells; necroptosis; mitochondria; receptor interacting protein kinase 3
R285.5
A
0253 - 2670(2021)07 - 1974 - 07
10.7501/j.issn.0253-2670.2021.07.014
2020-10-26
新疆维吾尔自治区自然科学基金(青年基金)资助项目(2020D01B50);新疆维吾尔自治区公益性科研院所基本科研业务经费资助项目(KY2020086);2019年新疆维吾尔自治区高层次人才引进工程(柔性引进人才)项目
李海宁(1994—),男,硕士研究生,研究方向为药物制备及质量控制。Tel: 15726069394 E-mail: lhnmiku@163.com
邢建国(1968—),男,研究员,从事中药民族药新制剂与新剂型研究。Tel: 13999178585 E-mail: xjguodd@163.com
[责任编辑 李亚楠]

