具有线粒体靶向功能的穿心莲内酯TPP-PEG-PE脂质体的制备及其作用于胃癌模型小鼠的机制研究
安丽丽,孙贺军#,孔永红,王新明,赵成龙
具有线粒体靶向功能的穿心莲内酯TPP-PEG-PE脂质体的制备及其作用于胃癌模型小鼠的机制研究
安丽丽1,孙贺军1#,孔永红1,王新明1,赵成龙2, 3*
1. 驻马店市中心医院 药学部,河南 驻马店 463000 2. 河南省人民医院 消化内科,河南 郑州 454002 3. 河南省中医药研究院,河南 郑州 450004
制备穿心莲内酯(andrographolide,AP)(3-丙羧基)三苯基溴化膦[(3-carboxy propyl) triphenylphosph-onium bromide,TPP]-聚乙二醇(polyethylene glycol,PEG)-聚乙烯(polyethylene,PE)脂质体(AP@TPP-PEG-PE#Lips),研究其体外释放、溶血性、线粒体靶向性、促胃癌细胞凋亡和作用胃癌模型小鼠的机制。采用薄膜水化法制备AP@TPP-PEG-PE#Lips,检测该脂质体的粒径、电势、显微电镜形态、稳定性、溶血性及体外释放情况;流式细胞仪测定胃癌细胞对脂质体的摄取情况,激光共聚焦显微镜研究其在线粒体的靶向性;评价AP@TPP-PEG-PE#Lips对胃癌细胞凋亡和胃癌模型小鼠的影响。AP@TPP-PEG-PE#Lips粒径为(23.8±1.7)nm,Zeta电位为(30.2±1.1)mV,分布较为均匀,规则球形结构;体外试验表明,AP@TPP-PEG-PE#Lips溶血率低、缓释性能和血液相容性好;荧光试验结果显示,TPP-PEG- PE#Lips可以促进药物的细胞摄取;AP@TPP-PEG-PE# Lips作用胃癌细胞和胃癌模型小鼠结果显示,AP@TPP-PEG-PE#Lips可以明显降低胃癌细胞线粒体膜电位,增加细胞内活性氧(reactive oxygen species,ROS)含量,促进半胱氨酸蛋白酶-3(Caspase-3)的释放,增加促凋亡蛋白B淋巴细胞瘤-2(Bcl-2)和减少抗凋亡蛋白Bcl2-associated X(Bax)的表达。AP@TPP-PEG-PE#Lips可以有效的将药物递送到线粒体,增强药物促肿瘤细胞凋亡作用。
线粒体靶向;穿心莲内酯;TPP-PEG-PE;脂质体;细胞摄取;胃癌;体外释放;溶血性;细胞凋亡;薄膜水化法;活性氧;Caspase-3;Bcl-2;Bax
穿心莲(Burm. f.) Nees是爵床科的药用植物,也称为“苦味之王”,具有清热解毒、凉血消肿的功效[1-2]。穿心莲内酯(andrographolide,AP)是从穿心莲中提取的二萜内酯类化合物。近年来,研究发现AP可以抑制多种肿瘤细胞的增殖,具有抗癌活性[3-4]。刘奇章等[5]研究发现,AP对胃癌SGC7901细胞具有很好的抑制作用,该成分通过线粒体途径诱导胃癌细胞凋亡,上调Caspase-3和促凋亡蛋白Bax表达,下调抑凋亡蛋白Bcl-2表达;另外,还可以通过上调细胞内活性氧(reactive oxygen species,ROS)水平,促使线粒体膜电位崩溃,抑制胃癌SGC7901细胞的生长。尽管如此,但AP存在水溶性和脂溶性均差的成药性问题,药物递送效率不高,严重限制了AP在制药领域内的发展[6]。因此,开发一种新型药物载体解决AP的成药性问题具有重要意义。脂质体是目前研究比较热门的新型药物递送系统。它由脂质双分子层组成,内部为闭合囊泡,可包载亲水性和亲脂性药物,具有优良的生物相容性和水溶性,并且很容易通过各种修饰,提高药物的靶向性。目前,已经广泛应用于肿瘤药物的靶向递送[7-8]。(3-丙羧基)三苯基溴化膦[(3-carboxy propyl) triphenylphosph-onium bromide,TPP]阳离子呈正电荷性质,常用来介导肿瘤药物载体靶向递送至线粒体,提高药物的疗效[9-11]。因此,本实验采用TPP阳离子修饰脂质体,拟将AP递送到胃癌细胞线粒体,精确调节线粒体功能,明显增强药物促肿瘤细胞凋亡效果。
1 仪器与材料
1.1 仪器设备
NS-3500激光扫描共聚焦显微镜购于北京美亚先科技有限公司;Zetasizer Nano ZSP纳米粒度电势仪购于英国马尔文公司;FA1004B电子分析天平购于上海精密仪器仪表有限公司;JEM-2100透射电子显微镜(TEM)购于日本电子株式会社;XPN-100台式高速离心机购于贝克曼库尔特公司。
1.2 药品与试剂
AP购自四川洪恩植物科技有限公司,批号20191104,质量分数≥98%;TPP-聚乙二醇(polyethylene glycol,PEG)-聚乙烯(polyethylene,PE)相对分子质量约2500,批号20191205,PEG-PE相对分子质量约2000,批号20191103,质量分数 均≥90%,PDI均<0.3,均购买于西安瑞禧生物科技有限公司;大豆磷脂,批号20191109,购买于上海太伟药业有限公司;胆固醇,批号20191205,购买于成都科龙生化公司;DID红色荧光染料购自西安百萤生物科技有限公司,批号20191109,质量分数≥98%;线粒体绿色荧光染料(MitoTrackerTMGreen)和细胞核Hoechst 33258染料购自南京沃博生物科技有限公司;色谱甲醇和乙腈购自美国Fisher化学试剂公司;Caspase-3活性检测试剂盒购买于济南碧云天生物公司,批号C1115。
1.3 细胞株与动物
胃癌SGC7901细胞、MKN45细胞和胃黏膜上皮GES-1细胞购自中国科学院上海细胞生物学研究所;DMEM培养基(高糖)购自美国Thermo Fisher公司;Gibco 16000-044胎牛血清(特级FBS)购自上海联硕生物科技有限公司。
SPF级BALB/C裸鼠,雄性,4~5周龄,购买于中科院上海细胞生物学研究所。所有动物实验遵循河南驻马店市中心医院和河南省人民医院有关实验动物管理和使用的规定,均符合3R原则。
1.4 数据统计
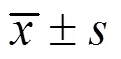
2 方法与结果
2.1 穿心莲内酯TPP-PEG-PE脂质体(AP@TPP- PEG-PE#Lips)的制备及特征性分析
2.1.1 AP@TPP-PEG-PE#Lips和AP@PEG-PE#Lips的制备 精密称取大豆磷脂200 mg,胆固醇20.1 mg,TPP-PEG-PE或PEG-PE 17.2 mg,AP 30 mg,将以上材料和药物共同溶解于适量体积的混合溶剂[氯仿-甲醇(2∶1)]中[12],充分溶解后,置于旋转蒸发仪中减压浓缩成膜。真空冷冻条件下干燥5 h,除去残留有机溶剂。加入适量的pH 7.4磷酸盐缓冲溶液(phosphate buffer saline,PBS),于37 ℃、200 r/min摇床中避光水化1 h;水浴超声5 min,使脂质膜从瓶壁上完全脱落;0.22 μm微孔滤膜3~5次,即得粒径均匀分布的脂质体AP@TPP-PEG-PE# Lips和AP@PEG-PE#Lips,备用。
2.1.2 粒径分布和Zeta电位测定 以移液枪吸取少许AP@TPP-PEG-PE#Lips和AP@PEG-PE#Lips,加入适量蒸馏水稀释,采用Zetasizer Nano ZS纳米粒度电势仪测定粒径、Zeta电位分布,结果如图1所示。AP@TPP-PEG-PE#Lips和AP@PEG-PE#Lips的粒径分别为(23.8±1.7)、(20.3±1.5)nm;分布较为均匀,PDI分别为0.242±0.011、0.237±0.010;Zeta电位分别为(30.2±1.1)、(32.2±0.8)mV。
2.1.3 TEM观察 移液枪吸取少量AP@TPP-PEG- PE#Lips和AP@PEG-PE#Lips溶液,滴加在200目铜网上,低温吹干,TEM下找出各个样品最适合观察的质量浓度,最适质量浓度下样品采用常规的磷钨酸负染[13],最后置TEM下观察脂质体的微观形态。电镜结果如图2所示,AP@TPP-PEG-PE#Lips和AP@PEG-PE#Lips均表现为规则球形结构。
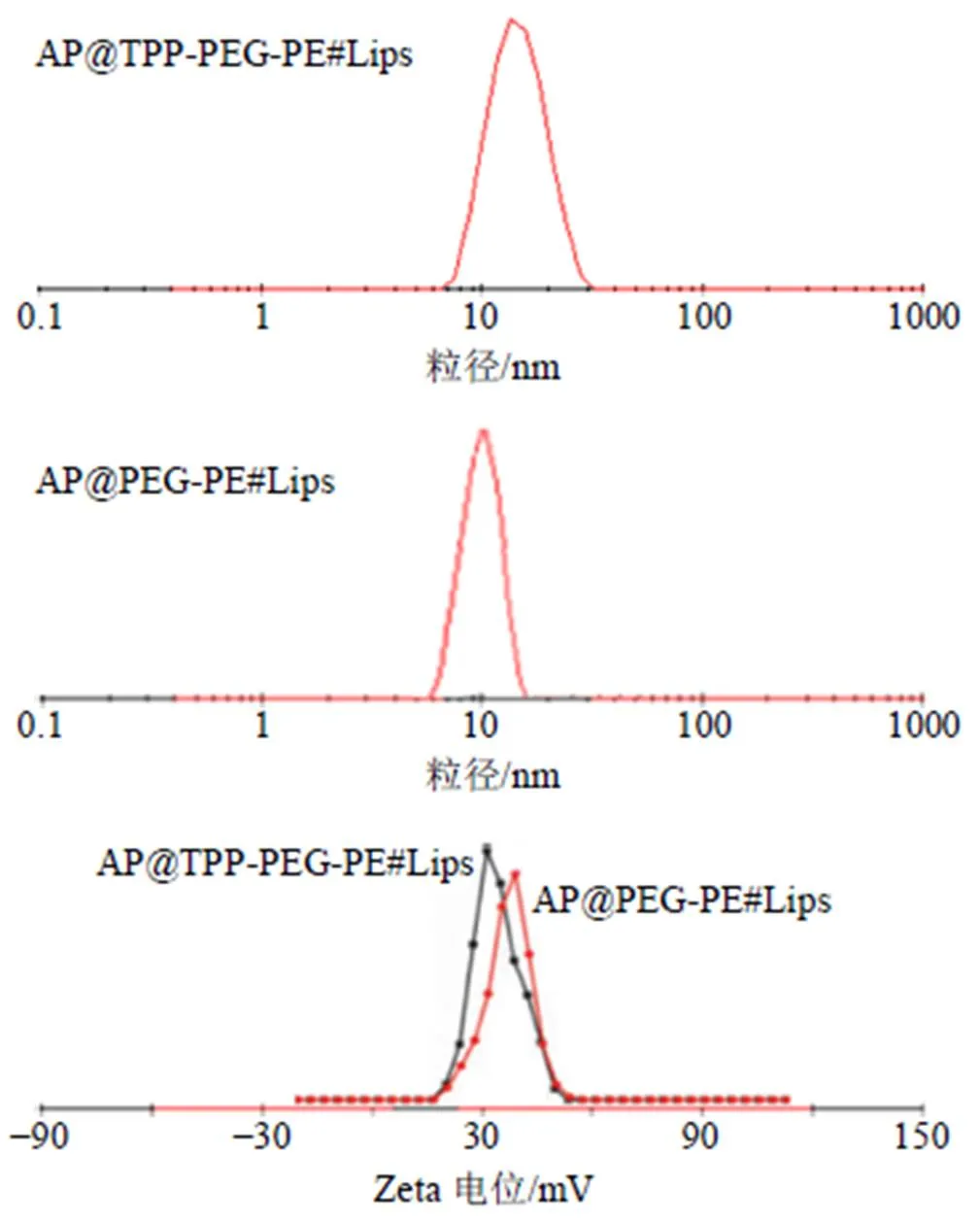
图1 AP@TPP-PEG-PE#Lips和AP@PEG-PE#Lips的粒径分布和Zeta电位
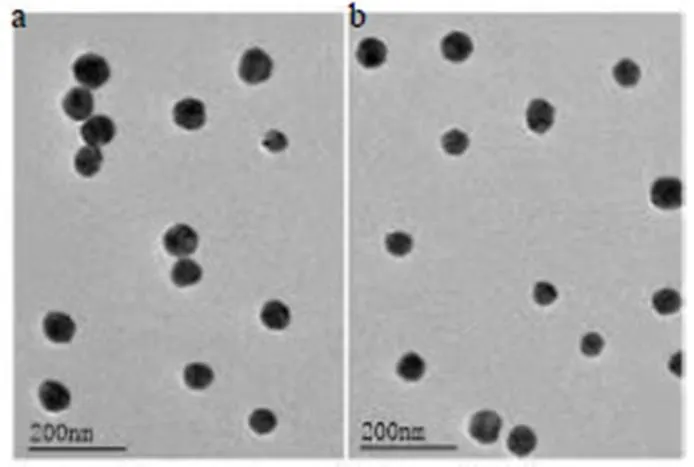
图2 AP@TPP-PEG-PE#Lips (a) 和AP@PEG-PE#Lips (b) 的电镜图
特征性分析结果表明,AP@TPP-PEG-PE#Lips和AP@PEG-PE#Lips基本特性差异不显著。
2.1.4 包封率及载药量测定 吸取AP@TPP-PEG- PE#Lips溶液500 μL,15 000 r/min高速离心5 min,AP@TPP-PEG-PE#Lips截留在0.4 mL超滤离心管内(截留相对分子质量10 000,Millipore公司)。加入数倍甲醇,60 ℃水浴下溶解5 min破坏脂质体结构,促使AP从脂质体中解离出来,采用HPLC法[14],具体方法步骤参考游利江等的[7]报道,测定脂质体包封的AP质量(内);超滤膜外为游离AP,采用同样的方法测定游离AP质量(外),计算脂质体的包封率为(81.4±2.2)%;冷冻干燥离心管内截留的AP@TPP-PEG-PE#Lips溶液,称质量计为,计算AP@TPP-PEG-PE#Lips载药量为(14.3±1.6)%。
包封率=内/(外+内)
载药量=内/
外为离心后游离AP质量,内为脂质体中AP质量,为AP@TPP-PEG-PE#Lips质量
2.2 AP@TPP-PEG-PE#Lips体外实验
2.2.1 红细胞溶血性考察 称取AP、AP@PEG-PE# Lips和AP@TPP-PEG-PE#Lips适量,5 mL生理盐水溶解后,再依次用生理盐水半倍稀释成AP质量浓度为5.00、2.50、1.25、0.62、0.31、0.16、0.08 mg/mL的系列溶液,移取以上配制好的AP和AP@TPP- PEG-PE#Lips系列溶液各200 μL至1.5 mL的洁净Eppendorf(EP)管中,阳性对照EP管中只加200 μL蒸馏水,阴性对照EP管中只加200 μL生理盐水,红细胞溶血实验具体操作步骤参考文献报道方法[15]。采用酶标仪测定吸光度(),紫外吸收波长为540 nm。结果如表1所示,AP@TPP-PEG-PE# Lips和AP@PEG-PE#Lips的溶血率都非常小,基本上保持在5%以下,由此表明,TPP-PEG-PE#Lips具有较好的血液相容性。
溶血率=(样品―阴性对照)/(阳性对照―阴性对照)
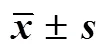
表1 不同AP质量浓度的AP@TPP-PEG-PE#Lips对红细胞溶血率的影响 (,n = 3)
2.2.2 稳定性考察 将AP@TPP-PEG-PE#Lips放置在4 ℃冰箱中保存56 d,每隔7 d检测该脂质体的粒径和Zeta电位,结果见表2,结果表明,AP@ TPP-PEG-PE#Lips的粒径和Zeta电位在冷藏期间基本上变化不大,聚合物分散指数(polymer dispersity index,PDI)也基本保持在0.3以下,相对较小。该结果表明,AP@TPP-PEG-PE#Lips在4 ℃存储期间具有较好的稳定性。
称取AP@TPP-PEG-PE#Lips约1 mg,加入2 mL胎牛血清培养基(10%)在旋涡混合器上振荡2 min使药物完全溶解,加塞封口,于(37±1)℃的恒温水浴锅中共同孵育0、4、8、12、16、18、24 h后,按照上述方法处理样品和测定样品,检测该脂质体的粒径和Zeta电位,结果见表3。结果显示,AP@TPP-PEG-PE#Lips在血清中粒径和电位基本同最初状态保持一致,检测时由于存在血清蛋白的干扰,故试验结果出现了少量的偏差。
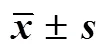
表2 AP@TPP-PEG-PE#Lips在4 ℃下保存时稳定性考察 (,n = 3)
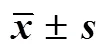
表3 AP@TPP-PEG-PE#Lips在10%胎牛血清中的稳定性考察 (,n = 3)
2.3 AP@TPP-PEG-PE#Lips的体外释放研究[16]
取AP 0.3 mg、AP@PEG-PE#Lips(含AP 0.3 mg)和AP@TPP-PEG-PE#Lips(含AP 0.3 mg)分别置于Spectrumlabs透析袋(截留相对分子质量为20 000)中,预定时间点1、2、6、9、12、15、18、21、24、36、48、72 h采集样本,紫外分光度光度计测定AP质量浓度,检测波长540 nm,计算AP在胶束中的累积释放率。结果如图3所示,游离AP呈快速释放趋势,20 h其累积释放率就高达82%,而AP@ PEG-PE#Lips和AP@TPP-PEG-PE#Lips均呈缓释态势,75 h累积释放率才达到85%。总之,三者总体比较,AP@TPP-PEG-PE#Lips释放药物最慢,具有较好的缓释性能。
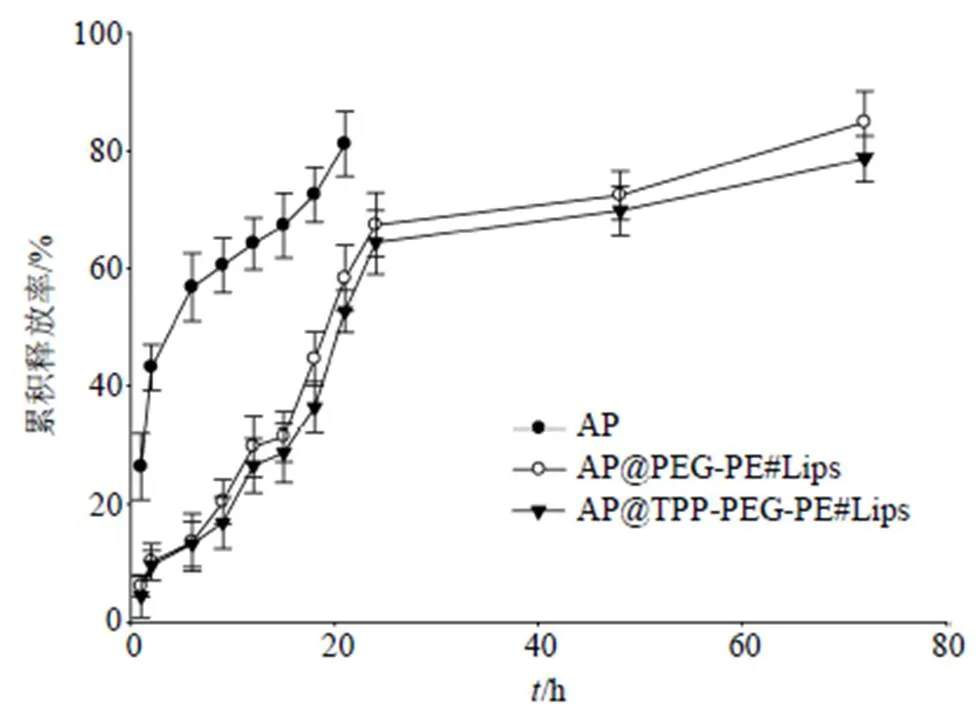
图3 AP@TPP-PEG-PE#Lips的体外释放对比研究
2.4 细胞摄取实验
2.4.1 细胞摄取量考察 将胃癌SGC7901细胞接种于12孔培养板中,培养24 h,再将制备好的DID@ PEG-PE#Lips和DID@TPP-PEG-PE#Lips(制备方法同AP@TPP-PEG-PE#Lips)加入细胞液中,使得细胞培养液中DID质量浓度为10 ng/mL,共同孵育1、2、3、4 h后,收集10 000个胃癌细胞,流式细胞仪检测荧光强度,观察DID@PEG-PE#Lips和DID@TPP-PEG-PE#Lips是否有细胞毒性。首先,寻找最适质量浓度。然后,在最适质量浓度下检测样品荧光强度,计算细胞摄入率(uptake rate)[17]。结果如表4和图4所示,游离荧光染料DID对细胞摄取率没有影响;DID@PEG-PE#Lips、DID@TPP- PEG-PE#Lips随着时间的延长,细胞摄取率也相应增多,具有很好的时间相关性。孵育3 h时,两者的细胞摄取量基本达到平衡状态,且DID@TPP- PEG-PE#Lips细胞摄取率明显高于DID@PEG-PE# Lips(<0.01)。该结果表明,TPP阳离子能促进药物的细胞摄取。
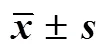
表4 不同质量浓度AP@TPP-PEG-PE#Lips对细胞摄取率的影响 (, n = 3)
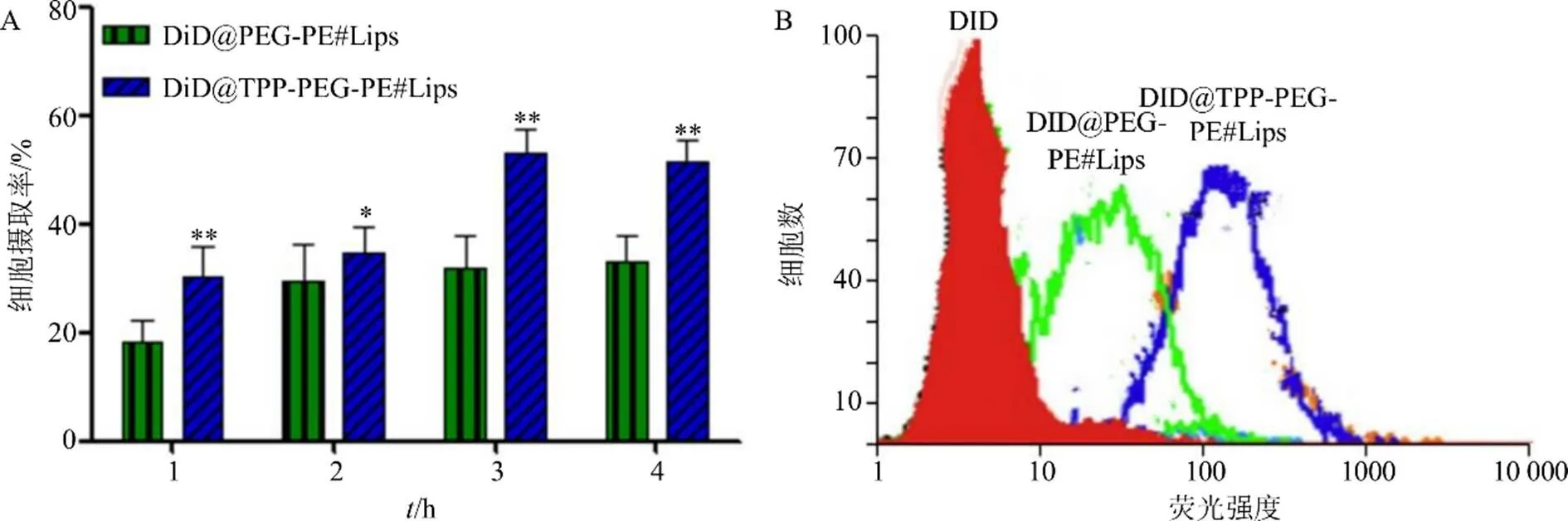
A-不同时间点细胞摄取率 B-3 h细胞摄取的流式细胞图 与DiD@PEG-PE#Lips比较:*P<0.05 **P<0.01
细胞摄取率=实验组药物摄取量/对照组摄取量
2.4.2 细胞摄取方式考察 将胃癌SGC7901细胞接种于12孔培养板中,培养24 h,弃去培养液后,然再分别加入1 mL不同质量浓度的抑制剂:150 mg/mL蔗糖(网格蛋白抑制剂)、5 μg/mL环糊精(小窝蛋白介导抑制剂)、50 mmol/L 2--去氧葡萄糖(2--deoxyglucose,能量抑制剂)、50 μg/mL秋水仙碱(colchicine,微管形成抑制剂,巨胞饮抑制),以不做抑制剂处理的细胞作为对照。流式细胞仪进行检测各组荧光强度分析[18]。结果如图5所示,2--去氧葡萄糖和秋水仙碱处理组与对照组比较,DID@TPP-PEG-PE#Lips的细胞摄取率明显减少,由此表明,该脂质体的细胞摄取方式属于能量依赖过程,以细胞巨胞饮为主。
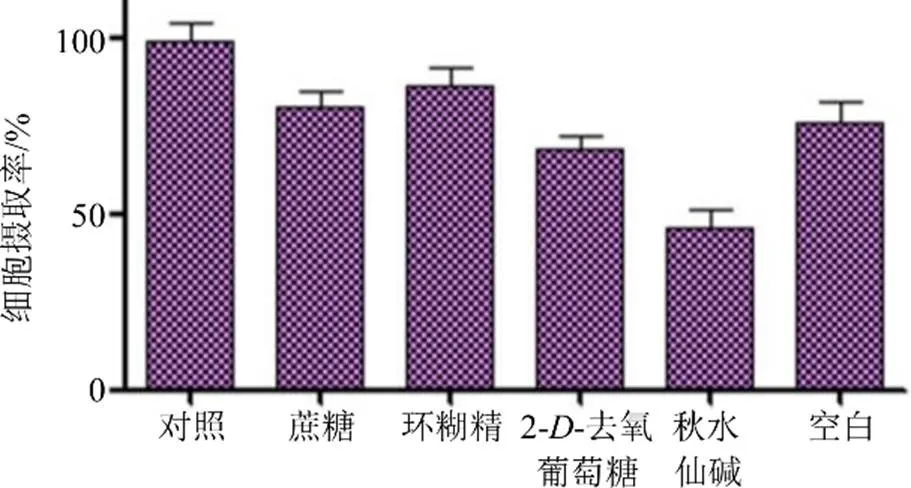
图5 胃癌SGC7901细胞对DID@TPP-PEG-PE#Lips的细胞摄取方式
2.5 线粒体靶向研究
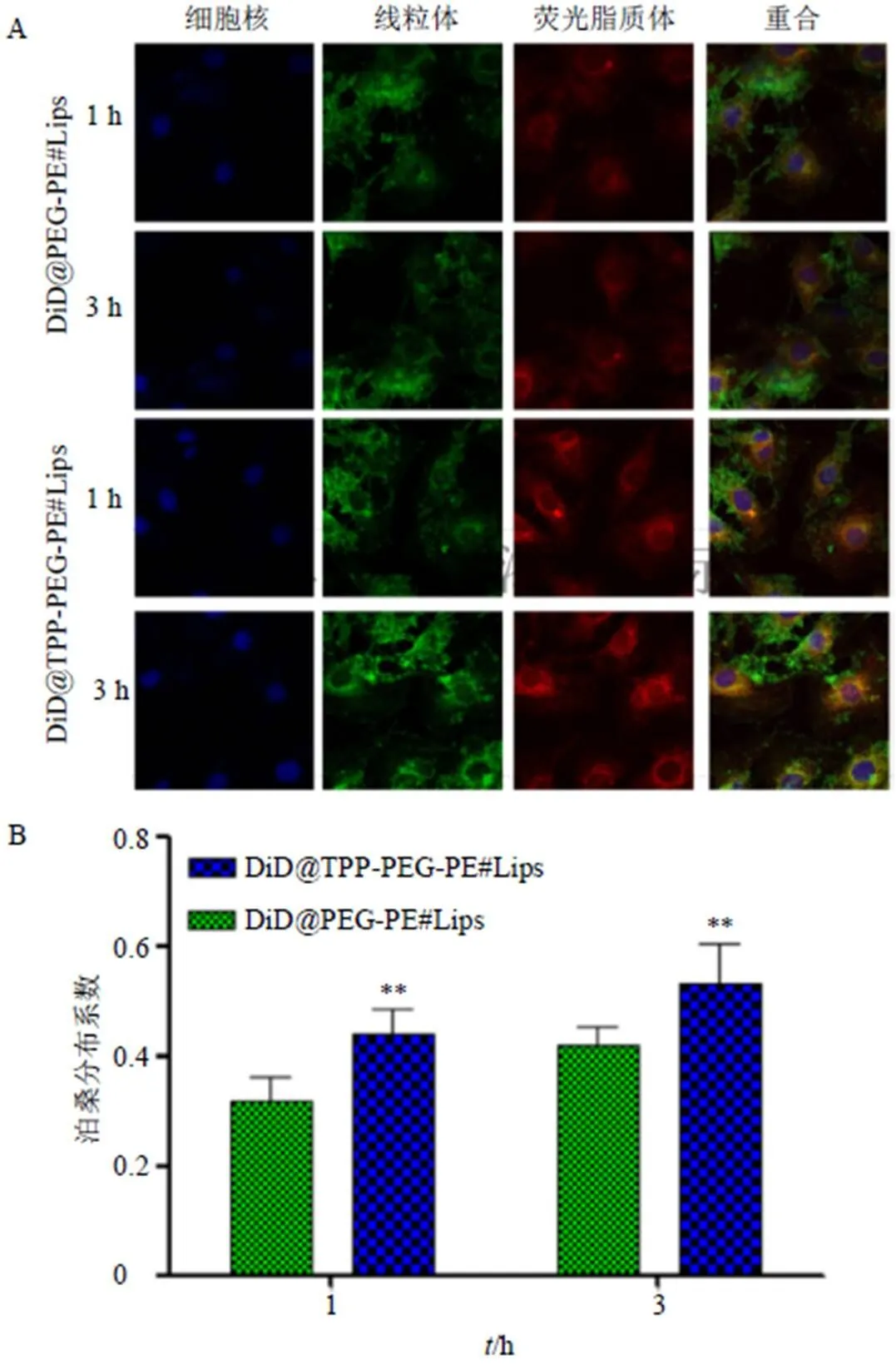
胃癌SGC7901细胞的前期处理过程同上,采用DID@TPP-PEG-PE#Lips和DID@PEG-PE#Lips与胃癌细胞共同孵育1、3 h后,将细胞取出,以50 nmol/L浓度MitoTracker™Green染线粒体(绿色)5 min,1 mg/mL Hoechst 33342染细胞核(蓝色)5 min,采用激光共聚焦显微镜观察脂质体进入细胞后的胞内分布。结果见图6-A所示,绿色荧光的线粒体与红色荧光的脂质体重合后显示为黄色,DID@TPP-PEG-PE#Lips的黄色深度明显高于DID@PEG-PE#Lips,且具有较好的时间相关性,在3 h时黄色最为明显。定量结果见图6-B,结果显示,DID@TPP-PEG-PE#Lips的泊桑分布值明显高于DID@PEG-PE#Lips,2组比较均具有极显著性差异(<0.01),由此可见,TPP阳离子能诱导脂质体靶向聚集在线粒体周围,具有很好的线粒体靶向性。
2.6 促肿瘤细胞凋亡作用
2.6.1 细胞培养 胃癌SGC7901细胞接种于24孔培养皿中,在37 ℃、5% CO2培养箱中进行培养。
2.6.2 铺板密度测定 铺板前使用0.05%胰蛋白酶(含0.03% EDTA)消化,制成1 mL细胞悬液,取10 μL细胞悬液放于细胞计数板,在倒置显微镜下进行细胞计数,计算铺板密度(铺板密度=细胞数目/10 μL)。
2.6.3 细胞存活率测定 待胃癌SGC7901细胞长至约80%时,加入含有不同质量浓度药物的1640培养基。药物组设定有:AP、AP@PEG-PE#Lips组、AP@TPP-PEG-PE#Lips组,将其给药质量浓度设定为0.5、1、2、4、8、16、32 μg/mL,紫外分光光度计570 nm波长下检测各组的值,对照只加PBS,按公式计算细胞存活率(细胞存活率=加药/对照),然后再计算各组的半数抑制浓度(half maximal inhibitory concentration,IC50)[19]。结果如图7所示,给药后肿瘤细胞的生长得到了明显抑制,尤其是AP@TPP-PEG-PE#Lips,该药对胃癌SGC7901细胞有时间、质量浓度依赖性生长抑制效果,随着作用时间和药物质量浓度的增加,AP@ TPP-PEG-PE# Lips对胃癌细胞的生长抑制率明显升高,在高质量浓度下、48 h时的抗肿瘤效果最为显著,IC50明显低于AP@PEG-PE#Lips和AP原料药,该实验结果表明,AP@TPP-PEG-PE#Lips能明显增强药物抑制肿瘤细胞生长效果(表5)。
与DiD@PEG-PE#Lips比较:*P<0.05 **P<0.01
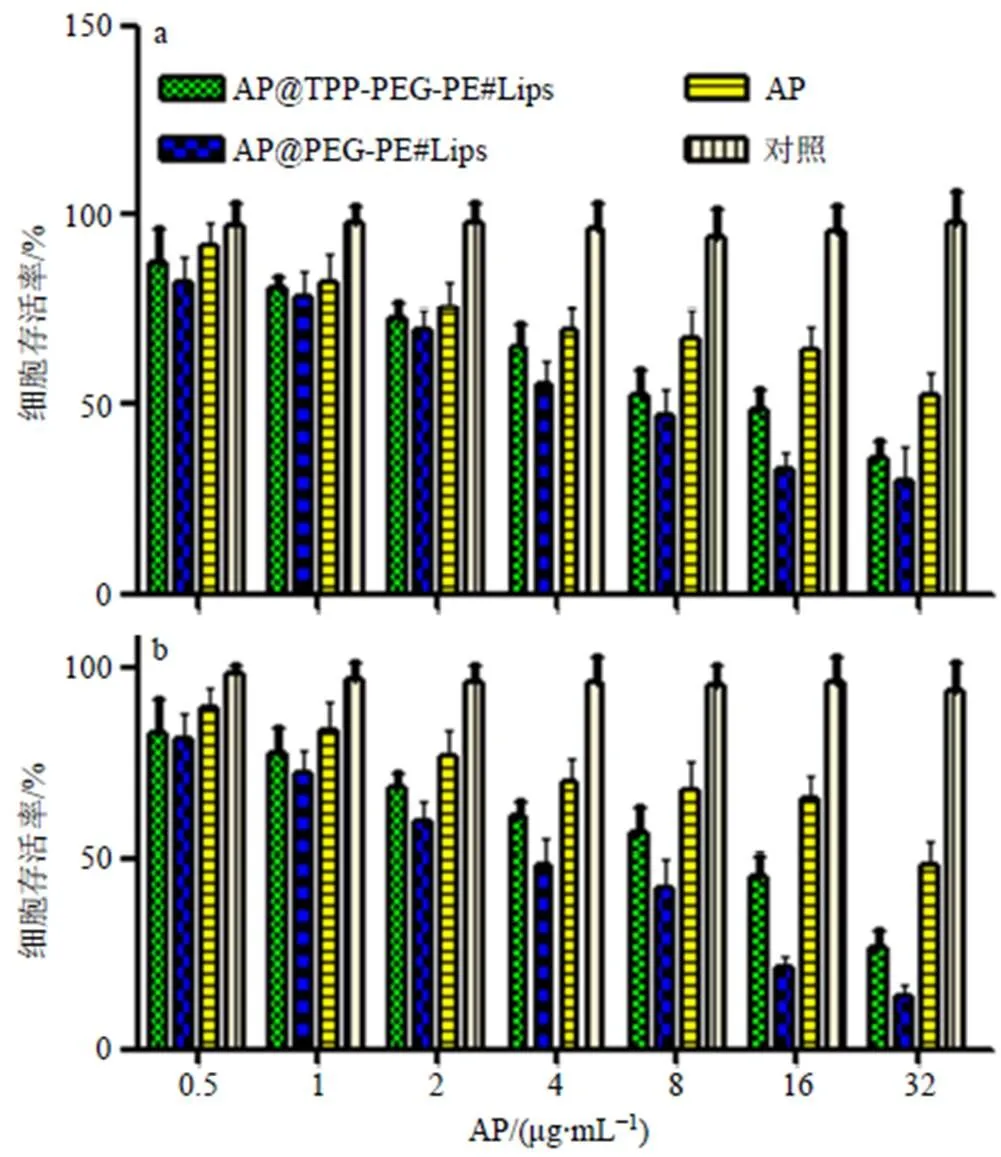
图7 AP、AP@PEG-PE#Lips和AP@TPP-PEG- PE#Lips与胃癌细胞孵育24 h (a)、48 h (b) 后细胞存活率
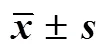
表5 AP、AP@PEG-PE和AP@TPP-PEG-PE脂质体细胞存活率的IC50 (, n = 3)
2.6.4 胃黏膜上皮GES-1细胞的细胞毒性 胃黏膜上皮GES-1细胞的处理过程同胃癌SGC7901细胞,然后给予以下药物:AP@TPP-PEG-PE#Lips、AP@ PEG-PE#Lips,给药质量浓度分别设定为2、4、8、16 μg/mL,空白对照组为未加药,共同孵育48 h后,添加MTT和二甲基亚砜,参照以上的方法计算各组的细胞存活率,与空白对照组进行比较,其中AP由于具有水不溶性的特点,先将其溶解到DMSO中,配制成母液,再将其配制成16 μg/mL,其中DMSO终浓度为0.2%。结果如表6所示,不同质量浓度下,AP@TPP-PEG-PE#Lips和AP@ PEG-PE# Lips的细胞存活率差异不大,其中最高质量浓度16 μg/mL时AP@TPP-PEG-PE#Lips的细胞存活率仍然高达(93.6±1.7)%,AP@PEG-PE#Lips为 (95.4±2.2)%,由此表明,AP@TPP-PEG-PE#Lips对正常胃黏膜上皮GES-1细胞毒性比较小,具有较好的生物相容性。
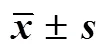
表6 AP、AP@PEG-PE#Lips和AP@TPP-PEG-PE#Lips对胃黏膜上皮GES-1细胞毒性的影响(, n = 3)
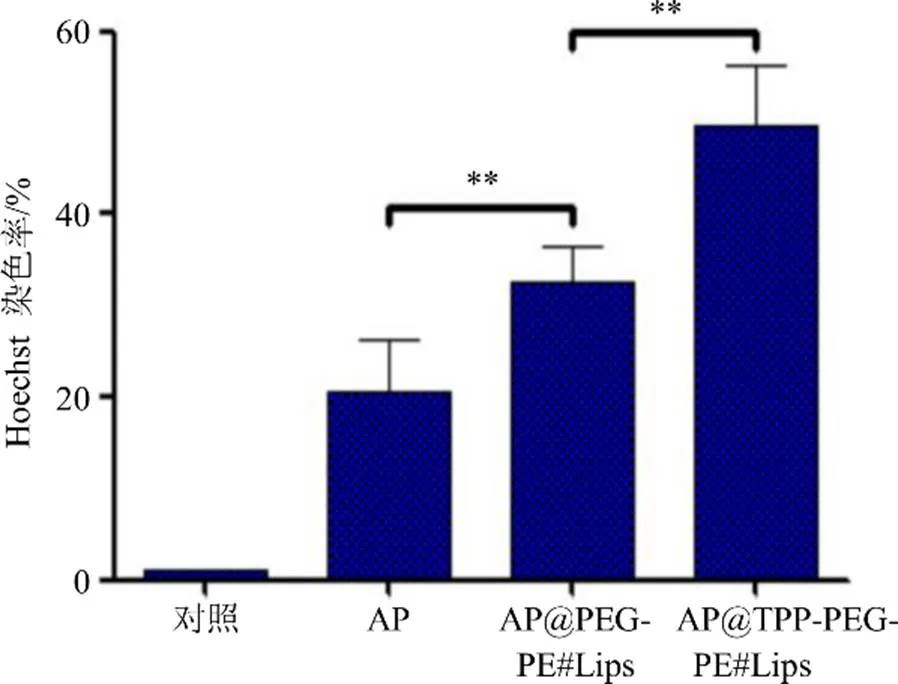
2.6.5 Hoechst 33258染色 取适量对数生长期的胃癌SGC7901细胞,培养于24孔培养皿中,待细胞生长至约80%时,加入药物组进行处理,具体分组同“2.6.4”项,Hoechst染色方法参考官娟等报道[20],采用5% Hoechst 33258对细胞进行染色,通过统计软件计算Hoechst染色率,即活细胞的比率。实验结果见图8,与对照组相比,所有给药组的胃癌细胞均出现了形态变化现象,尤其是AP@TPP- PEG-PE#Lips处理组,该组的细胞核出现了颜色变暗、有些出现了碎块状致密浓染,Hoechst染色率最高,该结果提示,AP@TPP-PEG-PE#Lips组具有很好的抑制肿瘤细胞生长效果。
**P<0.01
2.6.6 活性氧水平 取适量对数生长期的胃癌SGC7901细胞,细胞处理和给药同“2.6.5”项,药物与肿瘤细胞孵育48 h后,收集细胞,加入10 μmol/L 2′,7′-二氯荧光黄双乙酸盐(DCFH-DA)荧光探针作用30 min,然后以PBS洗涤2~4次,除去细胞表面残留的DCFH-DA,DCFH-DA正常情况下无荧光,进入细胞内后分解为DCFH,当细胞内的活性氧升高时,DCFH与活性氧反应生成带荧光的二氨基荧光素(DCF),可以采用流式细胞技术检测DCF荧光的强度,从而可以检测细胞内活性氧水平。
结果见表7所示,AP@TPP-PEG-PE#Lips组的DCF荧光强度最高,明显高于其余3组,具有显著性差异(<0.01),由此表明,AP@TPP-PEG-PE# Lips组可以明显增加肿瘤细胞内活性氧水平,激活线粒体途径诱导Caspase家族依赖的细胞凋亡,故具有很好的抑制肿瘤细胞生长效果。
2.6.7 Caspase-3活性 胃癌SGC7901细胞处理和给药同“2.6.5”项,收集细胞,弃上清培养液,再采用PBS漂洗干净,具体步骤参考Caspase-3活性检测试剂盒。采用酶联免疫检测仪,设置波长为405 nm,测定该波长下的值。结果见表7所示,与对照组比较,给药组的Caspase-3活性升高,其中,AP@TPP- PEG-PE#Lips组的Caspase-3活性最高,验证了TPP-PEG-PE#Lips将较多的AP递送到线粒体部位,激活Caspase家族依赖细胞凋亡,故细胞液中释放的Caspase-3显著增加。
2.6.8 线粒体膜电位 胃癌SGC7901的孵育及各组给药处理同“2.6.5”项方法,给药完成后收集肿瘤细胞,采用常用的JC-1(10 μg/mL)荧光探针检测线粒体膜电位[21],以流式细胞仪检测荧光进行分析[22]。结果见表7,以对照组红/绿荧光强度比值为基准,给药组的该组比值与对照组进行比较,AP@ TPP-PEG-PE#Lips组的荧光比值最小,故促肿瘤细胞凋亡效果最优。
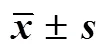
表7 AP、AP@TPP-PEG-PE#Lips和AP@PEG-PE#Lips促肿瘤细胞凋亡的比较(, n = 3)
与对照组比较:*<0.05**<0.01;与AP组比较:#<0.05##<0.01;与AP@PEG-PE#Lips组比较:▲▲<0.01
*< 0.05**< 0.01control group;#< 0.05##< 0.01AP group;▲▲< 0.01AP@PEG-PE#Lips group
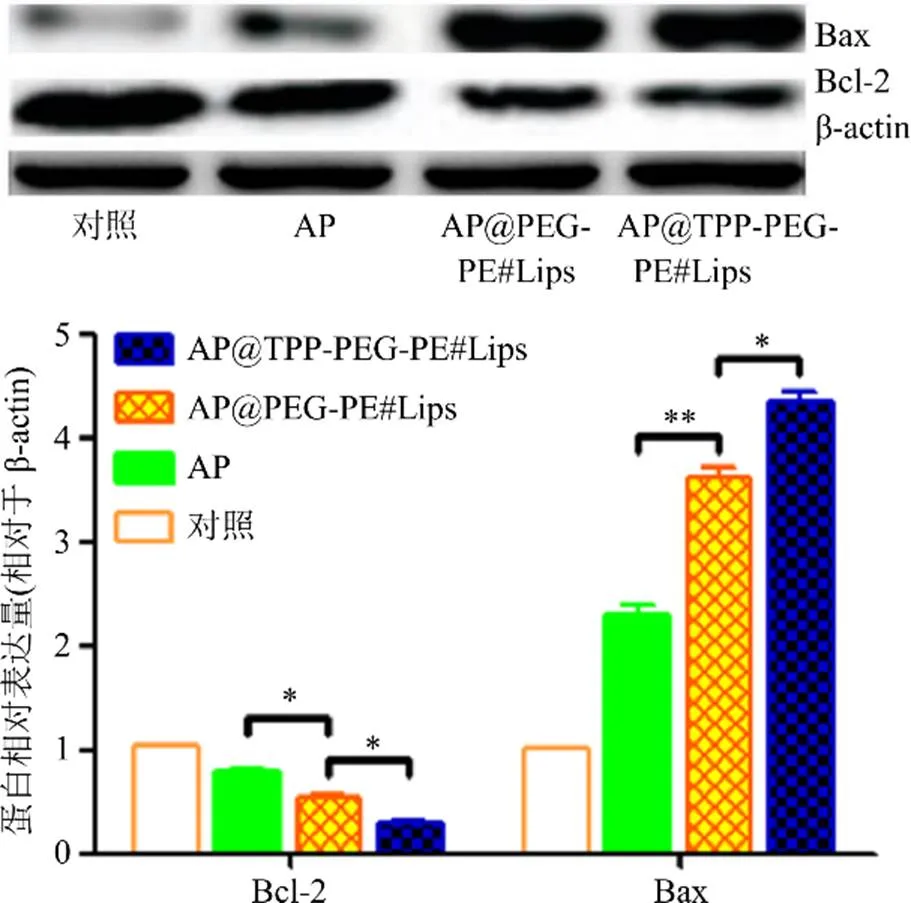
2.6.9 Bax、Bcl-2蛋白表达 胃癌SGC7901的孵育及各组给药处理同“2.6.5”项,对照组为含10%胎牛血清培养基取代药物。采用Western blotting方法检测[23]。以β-actin作内参,用Image J图像分析软件计算光密度。结果如图9所示,与对照组比较,给药组均可明显降低抗凋亡蛋白Bcl-2表达,提高促凋亡蛋白Bax表达;其中,AP@TPP-PEG-PE#Lips组调节凋亡相关蛋白的表达效果最明显,与另外2个给药组比较均存在显著性差异,考虑到Bax和Bcl-2是线粒体凋亡途径的主要相关蛋白,据此推测,TPP-PEG-PE#Lips有助于将大量药物靶向聚集再线粒体部位,启动细胞凋亡通路,从而,导致了相应凋亡蛋白出现了明显的改变。
2.7 AP@TPP-PEG-PE#Lips作用胃癌模型小鼠的效果
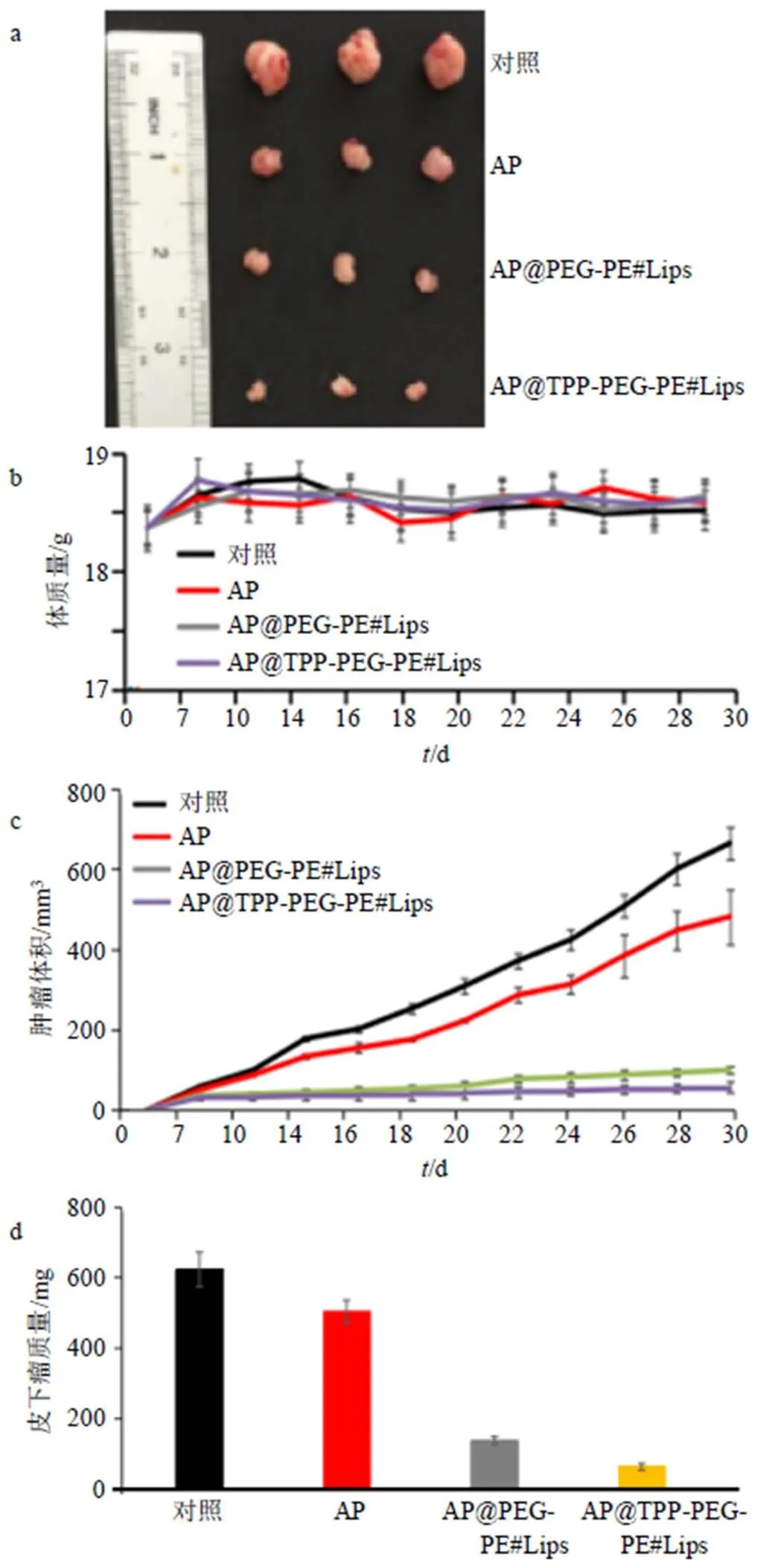
在确认AP@TPP-PEG-PE#Lips体外对胃癌细胞具有促细胞凋亡后,进一步验证AP@TPP-PEG- PE#Lips在胃癌皮下瘤BALB/C小鼠体内生物分布情况。选取60只4~5周龄的Balb/c裸鼠,将其置于SPF级动物房饲养,sc约0.1 mL 2×106/mL MKN45细胞悬浮液于裸鼠左侧腹股沟处,待皮下瘤长至100 mm3左右。按照随机分组原则,将胃癌荷瘤小鼠随机分成4组,对照(生理盐水)组、AP组(16 mg/kg)、AP@PEG-PE#Lips组(16 mg/kg)和AP@TPP-PEG-PE#Lips组(16 mg/kg),每组15只,分别在第0、4、8天向荷瘤小鼠尾部给予药物。给药后每天称量小鼠体质量,测量小鼠皮下瘤瘤径,皮下瘤体积计算公式:体积=1/2×长度×宽度2;相对肿瘤体积=第天肿瘤体积(V)-第0天肿瘤体积(0)。给药30 d后,脊椎脱臼法处死小鼠,称量皮下瘤质量。结果如图10-a、c、d所示,对照组和AP组小鼠,皮下肿瘤增长较快;AP@TPP-PEG- PE#Lips组和阳性对照组能很好地抑制肿瘤生长;AP@ PEG-PE#Lips组缓慢抑制肿瘤生长。如图10-b所示,4组小鼠体质量差异不显著。结果表明AP@TPP-PEG-PE#Lips和AP@PEG-PE# Lips对胃癌肿瘤有显著效果,且无明显毒性。
*P<0.05 **P<0.01
2.8 AP@TPP-PEG-PE#Lips在胃癌皮下瘤模型小鼠中的体内安全性评估
上述抑瘤实验完成后,收集各组小鼠的脾脏、心脏、肾脏、肝脏和肺脏等主要器官以及皮下瘤,将其完全浸入至4%甲醛固定24 h,制作石蜡切片,进行HE染色[23]。结果如图11所示,给药后对照组、AP组(16 mg/kg)、AP@PEG-PE#Lips组(16 mg/kg)和AP@TPP-PEG-PE#Lips组(16 mg/kg)对胃癌皮下瘤小鼠主要器官均无显著损伤。这些结果进一步说明AP@TPP-PEG-PE#Lips在哺乳动物体内应用时安全且毒性小。
2.9 AP@TPP-PEG-PE#Lips在胃癌皮下瘤模型小鼠中的作用机制研究
2.9.1 活性氧水平 收集各组小鼠的皮下瘤,胰酶消化成悬浮细胞后,按照“2.6.6”项中具体操作方式,检测细胞内活性氧水平。结果如表8所示,AP@ TPP-PEG-PE#Lips组的DCF荧光强度明显高于其他组,具有显著性差异(<0.01)。由此表明,AP@ TPP-PEG-PE#Lips组在体内也可以明显增加肿瘤细胞内活性氧水平,抑制肿瘤生长。
a-皮下瘤的大体图片 b-小鼠体质量曲线 c-皮下瘤体积生长曲线 d-皮下瘤质量
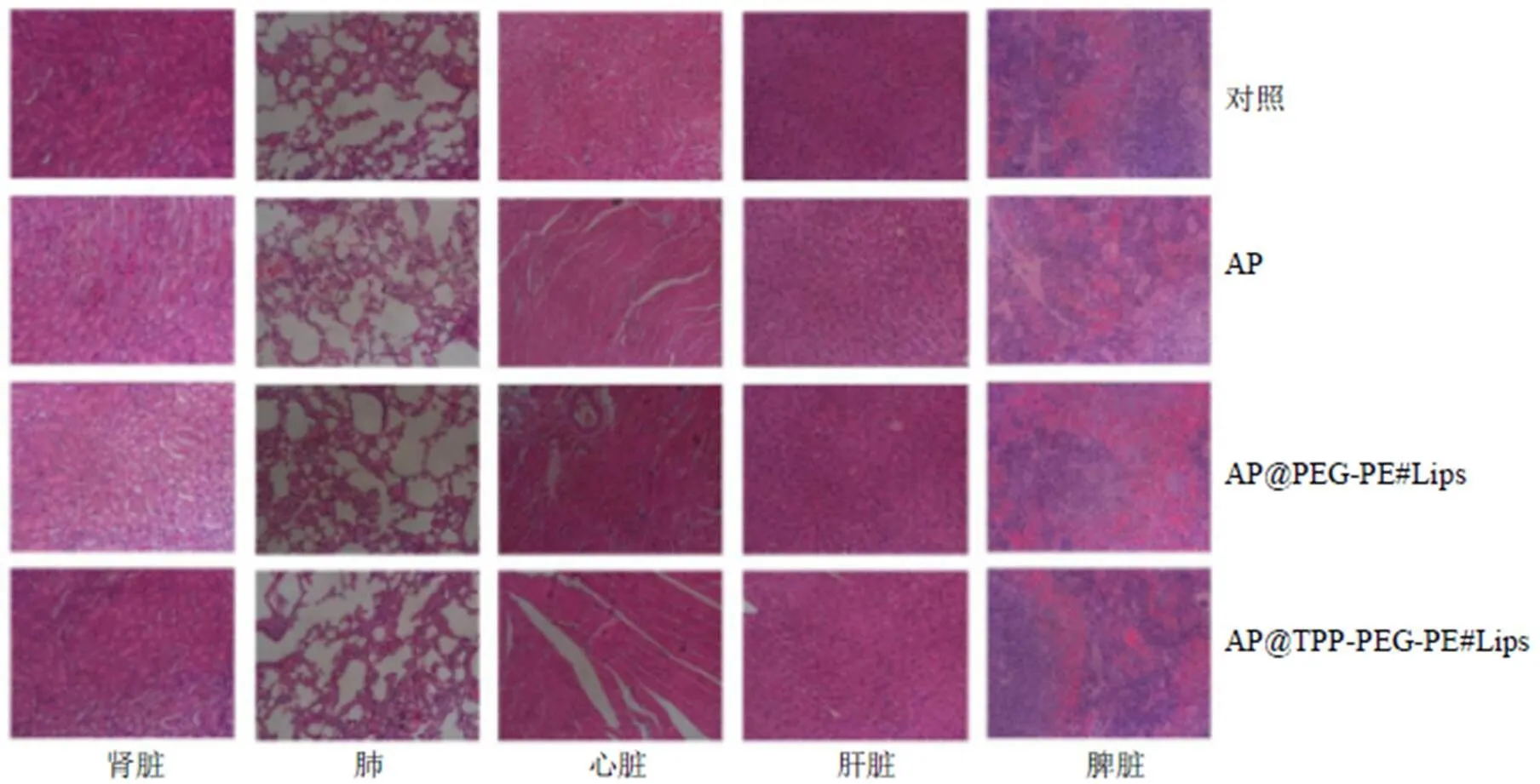
图11 AP@TPP-PEG-PE#Lips在胃癌皮下瘤模型中的体内细胞毒性评估
表8 AP、AP@TPP-PEG-PE#Lips和AP@PEG-PE#Lips促胃癌皮下瘤细胞凋亡的比较(, n = 3)
与对照组比较:*<0.05**<0.01;与AP组比较:#<0.05##<0.01;与AP@PEG-PE#Lips组比较:▲<0.05▲▲<0.01
*< 0.05**< 0.01control group;#< 0.05##< 0.01AP group;▲< 0.05▲▲< 0.01AP@PEG-PE#Lips group
2.9.2 Caspase-3活性 收集各组小鼠的皮下瘤,胰酶消化成悬浮细胞后,按照“2.6.7”项中具体操作方式,检测细胞内Caspase-3活性。结果见表8所示,AP@TPP-PEG-PE#Lips组的的Caspase-3活性明显高于其他组,具有显著性差异(<0.05、0.01)。这个结果进一步说明,TPP-PEG-PE#Lips将较多的AP递送到线粒体部位,激活Caspase家族依赖细胞凋亡,故细胞液中释放的Caspase-3显著增加。
2.9.3 线粒体膜电位 收集各组小鼠的皮下瘤,胰酶消化成悬浮细胞后,按照“2.6.8”项中具体操作方式,检测线粒体膜电位。结果见表8,以对照组红/绿荧光强度比值为基准,与对照组进行比较,AP@TPP-PEG-PE#Lips组的荧光比值最小,故促肿瘤细胞凋亡效果最优。
3 讨论
胃癌作为临床上高发的一种恶性肿瘤,对其治疗手段目前主要以手术、化疗和放疗为主。化疗和放疗治疗效果差;手术对患者身体损伤较大,且术后并发症多发,这些都是胃癌治疗急需解决的难 题[24-26]。AP根源于中医“扶正祛邪”科学理念,对恶性肿瘤细胞具有很好的杀伤作用。研究发现,AP通过启动线粒体凋亡通路,显著抑制胃癌细胞的生长[27-29]。因此,可以构建一种新型靶向给药系统,将AP精确递送到肿瘤部位中细胞线粒体内。这对于提高该药物的抗肿瘤效果具有重要意义,同时也为如何治疗胃癌等顽固性肿瘤提供了新的研究思路。
增强药物的疗效,改善药物的成药性一直是制剂学研究的热点。本研究以AP为研究对象,针对该药存在的水难溶性问题,采用脂质体药物载体进行包裹,提高AP的溶解性和抗肿瘤活性。针对该药能上调胞内活性氧水平促使线粒体膜电位崩溃,释放大量的Caspase-3进入细胞液中,迅速启动线粒体凋亡通路,促发肿瘤细胞凋亡。故本研究采用具有线粒体靶向功能的TPP阳离子,介导脂质体药物载体进入线粒体,制备了AP@TPP-PEG-PE# Lips。AP@TPP-PEG-PE#Lips粒径为(23.8±1.7)nm,Zeta电位为(30.2±1.1)mV,在电镜下表现为明显核壳球状结构,稳定性良好,溶血率微乎其微,体外释放具有很好的缓释性能,有助于提高药物在体内的存留时间。
细胞摄取试验结果表明,TPP-PEG-PE#Lips可以明显促进药物的细胞摄取,且具有较好的时间依耐性,一方面由于脂质体的磷脂与细胞膜的磷脂双分子层能很好的融合,有助于细胞膜的摄取脂质体;另外一方面是由于TPP-PEG-PE#Lips的正电荷性,可以与带副电荷的细胞膜相互吸引,借助于正负电荷的吸引,促进脂质体的跨膜转运;在细胞摄取方式研究方面,秋水仙碱能够通过抑制微管形成从而抑制巨胞饮途径,2--去氧葡萄糖是细胞无法利用的碳源,50 mmol/L时可阻断糖酵解,与对照组比较,DID@TPP-PEG-PE#Lips的细胞摄取率明显减少,由此表明,该脂质体的细胞摄取方式属于能量依赖过程,以细胞巨胞饮为主;药物进入细胞后,由于TPP阳离子的正电荷,被带负电荷线粒体膜的吸引,故DID@TPP-PEG-PE#Lips可借助于正负电荷吸引效应,聚集在肿瘤细胞线粒体周围,从而实现了药物的线粒体传输。
目前已经文献证实细胞膜带30~60 mV负电荷,线粒体内膜带150~180 mV负电荷,两者负电荷的叠加作用,可促使TPP阳离子聚集于线粒体的能力提高100~500倍,同时还能克服高黏度细胞液的阻碍,很大程度上提高肿瘤药物进入线粒体的效率,从而增强了药物抗肿瘤效果[10-11]。为了验证此推测,本研究进行了AP@TPP-PEG-PE#Lips促肿瘤细胞凋亡的药效试验,与AP和AP@PEG- PE#Lips比较,细胞毒试验显示AP@TPP-PEG-PE# Lips能够明显抑制胃癌细胞的生长,且对正常的毒性较小,具有良好的生物相容性,正好验证了中医药“扶正祛邪,祛邪不伤正”的优越性;Hoechst 33258染色试验很直观的揭示了AP@TPP-PEG-PE# Lips诱导肿瘤细胞凋亡的效果良好,明显高于其余2个给药组;线粒体凋亡机制试验结果显示,AP@TPP-PEG- PE#Lips可以显著升高细胞内ROS水平和Caspase-3活性,降低线粒体膜电位,明显降低抗凋亡蛋白BCl-2表达,提高促凋亡蛋白Bax表达。同时,还进行了胃癌皮下瘤实验,结果发现AP@ TPP-PEG- PE#Lips能显著抑制胃癌肿瘤体积,而不影响小鼠体质量;进一步分析其机制,发现与体外实验结果类似,可以升高细胞内活性氧水平和Caspase-3活性,降低线粒体膜电位等。
综上所述,AP@TPP-PEG-PE#Lips的粒径较小,稳定性良好,具有良好的生物相容性和线粒体靶向性,能显著增强药物促肿瘤细胞凋亡和抑制肿瘤生长作用。
利益冲突 所有作者均声明不存在利益冲突
[1] 杨雪松, 高慧媛, 张又夕, 等. 穿心莲内酯药理作用的研究进展 [J]. 热带医学杂志, 2019, 19(4): 518-522.
[2] 骆瑜, 邱慧, 汪保林, 等. 穿心莲内酯衍生物的合成研究进展 [J]. 中国中药杂志, 2017, 42(20): 3847-3859.
[3] 黄华坤, 袁晓慧, 张平, 等. 穿心莲内酯对骨肉瘤143B细胞的抑制作用及其机制 [J]. 中国病理生理杂志, 2020, 36(4): 628-636.
[4] 许洪彬, 綦向军, 方彩珊, 等. 基于网络药理学及分子对接探讨穿心莲内酯抗肿瘤机制 [J]. 中国医院药学杂志, 2020, 40(12): 1312-1319.
[5] 刘奇章. 穿瓜莲内酷对胃癌SGC-7901细胞G2/M期的周期抑制与诱导线粒体途径调亡的研究 [D]. 杭州: 浙江大学, 2015.
[6] 李士平. 水溶性与脂溶性穿心莲内酯的药理分析及临床观察 [J]. 中原医刊, 2006, 33(19): 85.
[7] 游利江, 梁飓, 曹德英, 等. 低pH插入肽修饰的载siRNA脂质体的制备与体外评价 [J]. 中国药学杂志, 2020, 55(4): 312-316.
[8] 于平华, 梁菊, 赵欢乐, 等. 多肽修饰的pH敏感脂质体研究进展 [J]. 中国药学杂志, 2018, 53(11): 849-853.
[9] 于鑫, 郭兆明, 郭兆明, 等. 靶向线粒体的载体给药系统研究进展 [J]. 内蒙古大学学报: 自然科学版, 2017, 48(2): 219-224.
[10] Murphy M P. Targeting lipophilic cations to mitochondria [J]., 2008, 1777(7/8): 1028-1031.
[11] Biswas S, Dodwadkar N S, Piroyan A,. Surface conjugation of triphenylphosphonium to target poly(amidoamine) dendrimers to mitochondria [J]., 2012, 33(18): 4773-4782.
[12] 景恒翠, 王国生, 于阳. 肺靶向穿心莲内酯脂质体的制备及体外释放特征 [J]. 亚太传统医药, 2010, 6(8): 41-42.
[13] 仲为国, 王富强, 王自彬. 三种常用染液对胞外囊泡的负染效果评价 [J]. 中国细胞生物学学报, 2017, 39(11): 1441-1443.
[14] 祝文琪, 徐卫康, 侯晓林. HPLC-超滤离心法测定连翘酯苷复方脂质体包封率 [J]. 中国现代应用药学, 2013, 30(9): 1001-1004.
[15] 刘兴国, 白雯静, 田妮娜. 等. 不同红细胞溶血实验替代兔眼刺激性实验比较研究 [J]. 科技视界, 2019, 32(109): 232-234.
[16] 徐思宁, 刘红波, 唐志书, 等. 秦艽总苷脂质体的制备及其体外释放与经皮渗透研究 [J]. 中药材, 2018, 41(6): 1418-1422.
[17] 张强, 彭红, 张利娟. 等. 核酸适配体-顺铂纳米脂质体药物的制备及对人急性淋巴细胞白血病T淋巴细胞的靶向治疗作用的研究 [J]. 中国医院药学杂志, 2017, 37(5): 413-417.
[18] 官娟, 陆伟跃, 占昌友. 血浆蛋白对脂质体体内性能的调控 [J]. 药学学报, 2019, 54(12): 2240-2250.
[19] 刘畅, 张海华, 柴洋洋,等. 红树莓提取物降低油酸诱导HepG2细胞脂肪的积累 [J]. 现代食品科技, 2019, 35(2): 24-31.
[20] 李磊, 姚亚超. 青蒿烯对人宫颈癌Hela细胞凋亡的影响及作用机制 [J]. 实用医学杂志, 2016, 32(9): 1384-1387.
[21] 任康, 李俊杰, 王亮, 等. 荧光探针JC-1与PI联合染色法在猪精子线粒体膜电位检测中的应用 [J]. 繁殖生理, 2010, 46(9): 18-22.
[22] 李明熹, 屈艺, 母得志. 线粒体自噬对新生大鼠缺氧缺血脑损伤的影响 [J]. 中国当代儿科杂志, 2017, 19(2): 242-249.
[23] 庞雅湘, 聂启昊, 刘晓宁, 等. 3种细胞裂解液提取总蛋白在Western blot中的效果分析 [J]. 河北医科大学学报, 2019, 40(3): 263-267.
[24] 王蜀梅. 扶正祛邪方在晚期胃癌治疗中的应用 [J]. 中国民间疗法, 2016, 24(9): 42-43.
[25] 邢增智, 李帅, 陈园园, 等. 中药复方协同化疗治疗进展期胃癌的研究进展 [J]. 四川中医, 2019, 37(2): 218-222.
[26] 曲云慧, 余福兵. 早期胃癌诊断与治疗进展 [J]. 中华临床医师杂志, 2017, 11(2): 292-296.
[27] Verdera H C, Gitz-Francois J J, Schiffelers R M,. Cellular uptake of extracellular vesicles is mediated by clathrin-independent endocytos is and macropinocytosis [J]., 2017, 266(28): 100-108.
[28] 曹衡玉, 欧阳征仁, 尹海辉, 等. 穿心莲内酯激活Nrf2抑制乙醇诱导肝细胞氧化应激损伤 [J]. 基因组学与应用生物学, 2016, 35(11): 2897-2902.
[29] 钟富有, 李良东, 黄志华, 等. 穿心莲内酯对大鼠心肌肥厚及抗氧化作用的影响 [J]. 时珍国医国药, 2010, 21(1): 226-227.
Preparation of andrographolide TPP-PEG-PE liposomes with mitochondrial targeting function and its mechanism in gastric cancer model mice
AN Li-li1, SUN He-jun1, KONG Yong-hong1, WANG Xin-ming1, ZHAO Cheng-long2, 3
1. Department of Pharmacy, Zhumadian Central Hospital, Zhumadian 463000, China 2. Department of Gastroenterology, Henan Provincial People’s Hospital, Zhengzhou 454002, China 3. Henan Academy of Chinese Medicine, Zhengzhou 450004, China
To prepare andrographolide (AP) triphenyl phosphate (TPP)-polyethylene glycol (PEG)-polyethylene (PE) liposomes (AP@TPP-PEG-PE#Lips), and study itsrelease, hemolysis, mitochondrial targeting, the mechanism of promoting gastric cancer cell apoptosis and acting on gastric cancer model mice.The membrane hydration method was used to prepare AP@TPP-PEG-PE#Lips; The particle size, electric potential, micro-electron microscopic morphology, stability, hemolysis andrelease of the liposomes were detected; Flow cytometry was used to measure the uptake of gastric cancer cells to liposomes, and laser confocal microscopy to study its mitochondrial targeting; AP@TPP-PEG-PE#Lips in gastric cancer cells and effects of apoptosis and gastric cancer model mice were evaluated.The particle size of AP@TPP-PEG-PE#Lips is (23.8 ± 1.7) nm, the Zeta potential is (30.2 ± 1.1) mV, the distribution is relatively uniform, and the regular spherical structure;tests showed that AP@TPP-PEG- PE#Lips had low hemolysis rate, sustained release performance and good blood compatibility; Fluorescence test results showed that TPP-PEG-PE#Lips can promote the cellular uptake of drugs; AP@TPP-PEG-PE#Lips act on gastric cancer cells and gastric cancer model mice, the results showed that AP@TPP-PEG-PE#Lips can significantly reduce the mitochondrial membrane potential of gastric cancer cells, increase intracellular reactive oxygen species (ROS) content, and promote cysteine The release of Caspase-3 increased the pro-apoptotic protein B lymphocyte tumor-2 (Bcl-2) and decreased the expression of anti-apoptotic BCL2-Associated X (Bax) protein (< 0.05).AP@TPP-PEG-PE#Lips can effectively deliver the drug to the mitochondria and enhance the drug’s effect of promoting tumor cell apoptosis.
mitochondrial targeting; andrographolide; TPP-PEG-PE; liposome; cell uptake; gastric cancer;release; hemolytic; apoptosis; membrane hydration method; reactive oxygen species; Caspase-3; Bcl-2; Bax
R283.6
A
0253 - 2670(2021)07 - 1945 - 12
10.7501/j.issn.0253-2670.2021.07.011
2020-09-22
河南省卫生健康委基金项目(201702161)
安丽丽,主管药师,研究方向肿瘤药物的靶向设计。E-mail: 1148118202@qq.com
赵成龙,博士,研究方向为纳米药物。E-mail: zhaocl@hotmail.com
#共同第一作者:孙贺军,主管药师,研究方向肿瘤药物的靶向设计。E-mail: 1148118202@qq.com
[责任编辑 郑礼胜]

