基于半定量分析方法的药对配伍对制首乌成分含量及DPPH自由基清除能力影响研究
张慧杰,任晓亮,孙 浩,王雅琦,王 磊,梁 颖*,张 宇*,刘 燕
基于半定量分析方法的药对配伍对制首乌成分含量及DPPH自由基清除能力影响研究
张慧杰1,任晓亮2,孙 浩1,王雅琦1,王 磊1,梁 颖1*,张 宇1*,刘 燕1
1. 天津市中医药研究院附属医院,天津 300120 2. 天津中医药大学,天津 301617
采用半定量分析方法对制首乌与9个补虚药配伍后成分含量及DPPH自由基清除能力变化进行研究。以UPLC-DAD建立制首乌多成分半定量分析方法,对制首乌与9味常用补虚药(当归、熟地黄、白芍、党参、黄芪、甘草、麦冬、枸杞子、墨旱莲)配伍后成分含量变化进行分析。采用DPPH法分别测定单味药以及配伍药对的自由基清除能力,绘制量-效曲线并计算半数清除浓度(EC50)。采用多元统计分析方法建立制首乌中多成分含量与DPPH自由基清除能力间的量-效回归模型,筛选量-效关系中影响显著的化学标志物,并通过质谱进行定性分析。线性范围、准确度、精密度、重复性及稳定性5项方法学验证结果表明,半定量分析方法可用于制首乌中12个成分在配伍前后的含量对比分析。含量对比分析结果表明,制首乌与不同药物配伍后,12个成分的含量均发生了不同程度的变化,且与墨旱莲配伍后制首乌中有33%的成分含量显著降低(<0.05)、42%的成分含量显著升高外(<0.05),与另8味药配伍后制首乌中至少50%的成分含量显著降低(<0.05)。DPPH自由基清除能力实验结果显示,制首乌DPPH自由基清除能力高于其他9味中药,配伍后9个制首乌药对的DPPH自由基清除能力低于制首乌,但高于相应的配伍药物。量-效回归正交偏最小二乘法(orthogonal projections to latent structures,OPLS)模型中2X、2Y及2值分别为0.841、0.981及0.962,筛选出4个量-效关系化学标志物,分别为反式-2,3,5,4′-四羟基二苯乙烯-2--β--吡喃葡萄糖苷(-THSG)、大黄素甲醚、顺式-2,3,5,4′-四羟基二苯乙烯-2--β--吡喃葡萄糖苷(-THSG)、大黄素-8--β--吡喃葡萄糖苷(EG)。建立的多成分半定量分析方法可用于何首乌在药对配伍过程中多成分含量变化的对比分析,-THSG、大黄素甲醚、-THSG、EG是影响制首乌在上述药对中发挥DPPH自由基清除作用的化学标志物,可为制首乌药对配伍机制的深入研究提供参考。
制首乌;药对;补虚药;半定量分析;DPPH法;自由基清除作用;当归;熟地黄;白芍;党参;黄芪;甘草;麦冬;枸杞子;墨旱莲;多元统计分析;化学标志物;反式-2,3,5,4′-四羟基二苯乙烯-2--β--吡喃葡萄糖苷;大黄素甲醚;顺式-2,3,5,4′-四羟基二苯乙烯-2--β--吡喃葡萄糖苷;大黄素-8--β--吡喃葡萄糖苷
何首乌为蓼科何首乌属植物何首乌Thunb.的干燥块根,始载于北宋《开宝本草》[1],生品具有解毒消痈、润肠通便的功效,制品(制首乌)是其经清蒸、黑豆汁蒸或煮后的炮制品,具有补肝肾、益精血、乌髭发等功效[2]。现代研究表明,其具有较强的抗氧化活性以及益智、延缓衰老、调血脂等药理作用[3-5]。目前对何首乌配伍的研究报道较少,有学者通过对不同配比的制首乌-牛膝配伍过程多成分含量变化及指纹图谱进行分析,表明制首乌与牛膝配伍的最佳比例为2∶1和1∶1[6],且与牛膝以1∶1比例配伍后对维甲酸致小鼠骨质疏松治疗作用显著[7];与决明子、荷叶、山楂配伍后,制首乌中主要成分二苯乙烯苷含量均显著降低[8]。此外,除1篇临床研究报道[9]中指出莱菔子与何首乌配伍引起口干、头晕、神志恍惚等不良反应外,尚未检索到其他关于何首乌的配伍不良反应研究报道。
制首乌常与熟地黄、当归、丹参、赤芍等补虚药、活血药配伍使用[10-12],课题组前期建立了32个制首乌配伍药对指纹图谱,指认出归属于制首乌的12个共有峰并对峰面积变化进行多元统计分析,结果显示制首乌与补虚类药物配伍过程中其成分含量变化具有相似性。本实验在前期工作基础上,采用超高效液相色谱串联二极管阵列检测器(UPLC- DAD)建立制首乌多成分半定量分析方法[13],并对制首乌与9味补虚药(当归、熟地黄、白芍、党参、黄芪、甘草、麦冬、枸杞子、墨旱莲)配伍后成分含量进行对比分析,以1,1-二苯基-2-苦肼基(DPPH)自由基清除法测定各单味药及药对的自由基清除能力[14-15],通过量-效回归模型筛选出标志物,以期为制首乌补虚药对配伍机制的深入研究提供依据。
1 材料
1.1 药品及试剂
制首乌,产地四川,批号150802,购于四川新荷花中药饮片有限公司,经天津市中医药研究院附属医院孙浩副主任中药师鉴定为蓼科何首乌属植物何首乌Thunb.的干燥块根的炮制品,当归(产地甘肃)、熟地黄(产地河南)、白芍(产地安徽)、党参(产地甘肃)、黄芪(产地内蒙古)、甘草(产地内蒙古)、麦冬(产地四川)、枸杞子(产地宁夏)、墨旱莲(产地河北),购于毫州市京皖中药饮片厂,并经天津市中医药研究院附属医院孙浩副主任中药师鉴定,分别为伞形科当归属植物当归(Oliv.) Diels的干燥根、玄参科地黄属植物地黄Libosch的干燥块根的炮制品、毛茛科芍药属植物芍药Pall.的干燥根、桔梗科植物党参(Franch.)的干燥根、豆科黄芪属植物蒙古黄芪(Fisch) Bge. var.(Bge.) Hsiao、豆科甘草属植物甘草Fisch.的干燥根及根茎、百合科沿阶草属植物麦冬(L. f.) Ker-Gawl.的干燥块根、茄科枸杞属植物宁夏枸杞L.的干燥成熟果实、菊科鳢肠属植物鳢肠L.的干燥地上部分。
反式-2,3,5,4′-四羟基二苯乙烯-2-β--吡喃葡萄糖苷(-THSG)对照品,中国食品药品检定研究院,批号110844-200606,质量分数≥98%;大黄素-8-β--吡喃葡萄糖苷(EG)对照品,四川维克奇生物科技有限公司,批号150925,质量分数≥98%。
甲醇,色谱纯,美国Sigma公司;甲酸,色谱纯,美国Meridian Medical Technologies公司;蒸馏水,北京屈臣氏蒸馏水有限公司;1,1-二苯基-2-苦肼基(DPPH),分析纯,美国Sigma公司,批号BJ1200455213A。
1.2 仪器
Acquity UPLCTMsystem超高效相色谱仪、Xevo G2-XSQ-TOF质谱仪,美国Waters公司;TU-1901紫外-可见分光光度计,北京普析通用仪器有限公司;1000 mL KDM调温电热套,山东省鄄城永兴仪器厂;TG16-WS台式高速离心机,湖南省湘仪离心机仪器有限公司;FDU-1200真空冷冻干燥机,日本东京理化器械株式会社;BT125D十万分之一天平,德国Sartorius公司;JA31002电子天平,上海精天电子仪器有限公司;KH3200B超声波清洗器,江苏省昆山禾创超声仪器有限公司。
2 方法与结果
2.1 饮片吸水量测定
中药煎煮过程中其吸水量是影响得液量、成分溶出的重要因素[16],为保证成分溶出体积环境的一致性,本研究首先对各单味饮片的吸水量进行考察,随后根据单味饮片吸水结果计算药对配伍提取的加水量,通过测定实际得液量与期望得液量间的相对误差来确定药对配伍提取的加水量。
2.1.1 单味饮片吸水系数的测定 分别称取包括制首乌在内的上述10味饮片各10.0 g,以20倍料液比加入溶剂,即200 mL的水,浸泡1 h后回流提取,以回流下第1滴水开始计时,随后保持提取液的微沸状态,提取时间为1 h,提取液以3层纱布趁热滤过,滤液冷却后量取体积,根据公式计算吸水系数,各饮片的吸水系数测定结果如表1所示。
吸水系数=(实际加液量-实际得液量)/饮片质量
2.1.2 药对配伍时饮片加水量的验证 依据单味饮片吸水情况的考察结果,分别称取药对中2味饮片各10.0 g,以制首乌质量计以20倍料液比加入溶剂,即200 mL水,根据表1结果在上述体积外再加入对应质量的饮片的吸水体积(取整数),按“2.1.1”项下方法操作提取后,测定药对配伍时提取液的体积,并根据公式计算加水量相对误差,其中期望得液量为200 mL,计算结果如表2所示。
结果显示,实测药对得液量均高于期望得液量,相对误差在2.5%~6.5%,低于10%,本研究认为单味饮片提取与药对配伍时提取过程中的溶剂体积环境基本一致,即忽略溶剂体积对成分溶出造成的影响。
相对误差=(实际得液量-期望得液量)/期望得液量
2.2 样品制备
2.2.1 单味饮片样品制备 取单味饮片100 g,称定,以料液比为1∶20加入水,并加入根据表1中相应饮片吸水系数计算的吸水体积,浸泡1 h后,回流提取1 h,3层纱布滤过,滤液备用。平行3次。
2.2.2 药对配伍样品制备 分别取各配伍中药饮片100 g与制首乌100 g,称定,根据表2所示实际加液量的10倍量加水,浸泡1 h后,回流提取1 h,后续操作同单味药样品制备方法。
2.2.3 提取物冻干粉的制备 分别将上述单味药、药对配伍提取液于60 ℃减压浓缩并冷冻干燥后制得单味药及药对配伍的冻干提取物,以供后期分析测定用。
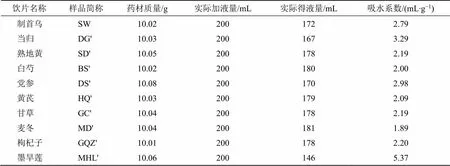
表1 单味饮片吸水系数测定结果
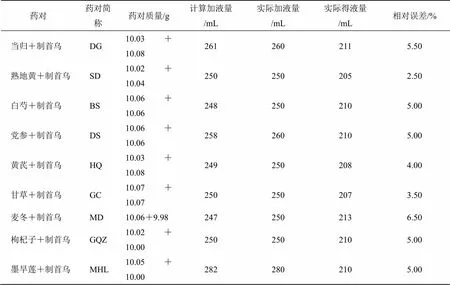
表2 药对配伍时饮片吸水情况考察结果
2.3 半定量分析方法的建立
2.3.1 基本理论 单味药标定的半定量分析法是以连续稀释的单味药提取液的生药质量浓度作为标准曲线的横坐标,以目标化合物的峰面积响应值作为纵坐标绘制标准曲线,从而对样品中相应化合物进行定量分析,计算公式如下[14]。
m=(-)/(1)
m为单味药的生药质量浓度,本实验中指制首乌的生药质量浓度,为目标化合物的色谱峰面积,、分别为以单味药质量浓度所标定标准曲线的斜率与截距
2.3.2 供试品溶液的制备 精密称取提取物冻干粉50.0 mg,加入5 mL蒸馏水,超声30 min复溶后,取1 mL溶液置于5 mL量瓶,并以50%甲醇定容,涡旋混匀后以3500 r/min离心20 min,上清液0.22 μm微孔滤膜滤过,续滤液进样分析。
2.3.3 色谱条件 Acquity UPLC BEH shield RP18色谱柱(100 mm×2.1 mm,1.7 μm,美国Waters公司);流动相为乙腈-0.1%甲酸水溶液,进样量5 μL;体积流量0.4 mL/min;柱温45 ℃;检测波长254 nm。采用梯度洗脱程序1(0~2 min,5%乙腈;2~4 min,5%~15%乙腈;4~8 min,15%~19%乙腈;8~10 min,19%~20%乙腈;10~15 min,20%~38%乙腈)对当归、熟地黄、白芍、党参、黄芪、麦冬、枸杞子及墨旱莲分别与制首乌配伍的药对样品进行分析,指认出上述药对配伍共煎样品中归属于制首乌的12个色谱峰,色谱图如图1-A所示。因甘草成分复杂,梯度洗脱程序1难以满足甘草-制首乌药对样品的分析,故采用梯度洗脱程序2(0~1 min,5%乙腈;1~4 min,5%~12%乙腈;4~10 min,12%~18%乙腈;10~15 min,18%~25%乙腈;15~25 min,25%~35%乙腈;25~40 min,35%~60%乙腈)对甘草-制首乌药对进行分析,指认出甘草-制首乌药对配伍共煎样品中归属于制首乌的12个色谱峰,结合PDA检测器所获取的每个色谱峰的紫外光谱,其光谱图分别与梯度洗脱程序1所获得的12个色谱峰光谱图一致,梯度洗脱程序2的色谱图如图1-B所示。通过制首乌单煎、药对配伍共煎、每味配伍药物单煎色谱图的对比,结果表明通过梯度洗脱程序1和2,制首乌中12个色谱峰均可实现与其他色谱峰的基线分离。
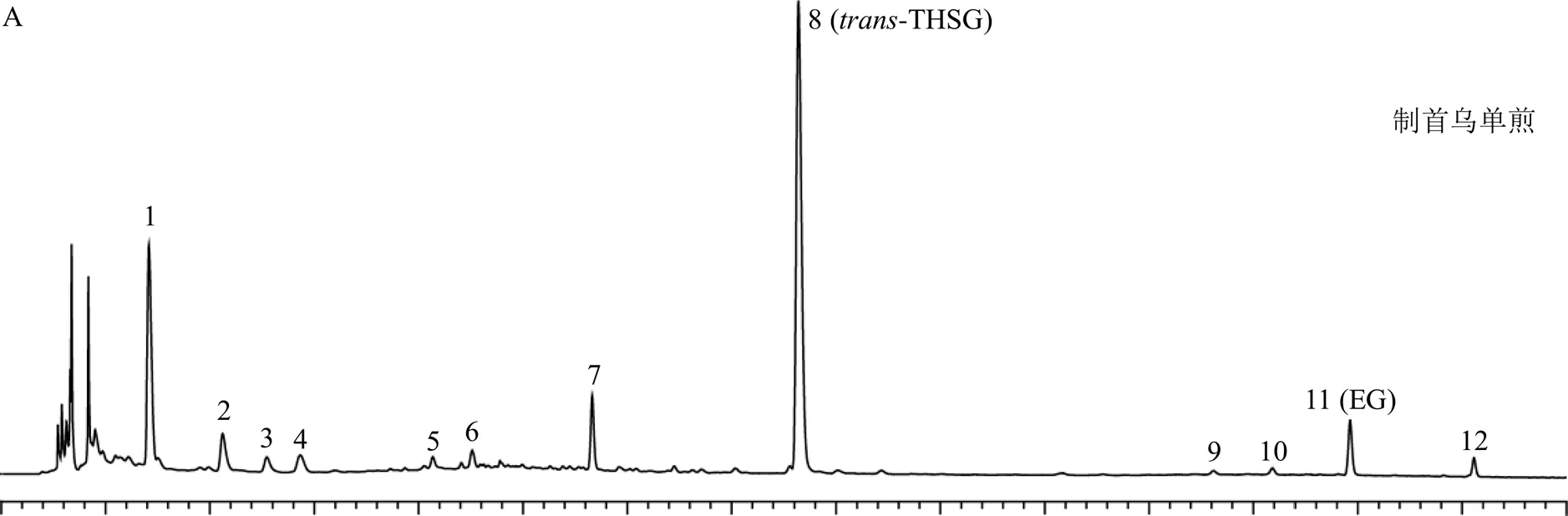
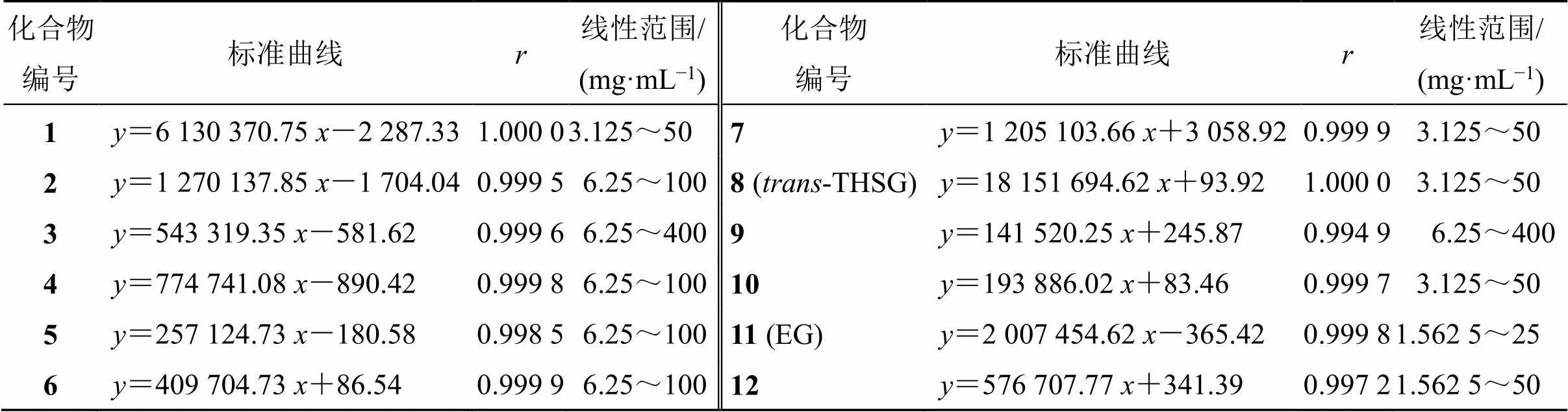
表3 线性及范围测定结果
2.3.4 方法学验证
(1)线性关系考察:精密称取首乌提取物冻干粉样品适量,加入5 mL蒸馏水,超声溶解30 min后3500 r/min离心20 min,取上清液0.22 μm微孔滤膜滤过,将续滤液连续稀释为不同质量浓度的样品溶液,以质量浓度为横坐标(),各色谱峰峰面积响应为纵坐标(),绘制各成分的半定量标准曲线,结果如表3所示,各成分标准曲线的相关系数()均大于0.997 2,表明线性关系良好,可用于各成分的定量分析。
(2)准确度考察:经质谱及对照品对照,化合物8与11分别为-THSG与EG,以半定量分析法与传统绝对定量法分别计算-THSG与EG 2种化合物的加样回收率。配制质量浓度范围分别为10~500 µg/mL、0.22~6.94 µg/mL的系列- THSG与EG对照品溶液,并建立绝对定量的标准曲线,-THSG标准曲线方程为=3 892 045.07+30 376.39,=0.999 6;EG标准曲线方程为=15 546.57+1 098.12,=0.999 9。称量约0.05 g首乌提取物冻干粉,加入与冻干粉样品中等量的-THSG与EG,加入5 mL蒸馏水,其他操作同“2.3.2”项下供试品溶液制备方法,平行配制3份。分别采用绝对定量与半定量法,按回收率=(实测值-测定值)/加入值计算回收率,结果如表4所示。-THSG和EG半定量法的加样回收率分别为95.09%、93.68%,均低于绝对定量法,RSD分别为3.2%、4.8%,均高于绝对定量法,表明半定量法准确度低于绝对定量法。由于本研究拟通过半定量法对配伍前后成分含量的变化进行比较分析,而非进行绝对定量的测定,故认为加样回收率在90.00%~110.00%为可接受的范围[13]。
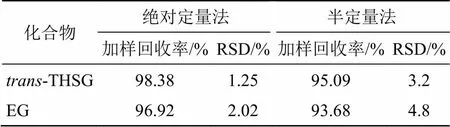
表4 准确度测定结果(n = 3)
(3)精密度考察:取同一供试品溶液,在同1 d内,连续进样6次,记录各组分峰面积,并计算RSD值。结果表明,RSD值均小于4%,9、10号色谱峰由于本身的响应值较低,RSD值大于3%,其他色谱峰均小于3%,结果表明精密度符合本实验的定量测定要求。
(4)重复性考察:按“2.3.2”项下方法制备6份供试品溶液,进样分析,记录各组分峰面积,并计算RSD值。结果表明,RSD均小于7%,符合本实验的定量测定要求。
(5)稳定性考察 取同一供试品溶液,分别于制备后的0、4、8、12、16、20、24 h进样分析,记录各组分峰面积,并计算RSD值。结果表明RSD值均小于3%,表明测定过程中各成分较为稳定。
2.3.5 药对配伍对制首乌中各成分含量的影响作用研究 本实验采用半定量分析法对制首乌分别与9味补虚药配伍后其所含的12个成分的含量变化进行比较分析。药对配伍提取液中制首乌所含成分含量C-j(为药对名称,为峰编号)计算公式如下。
C-j=m0d/(0V) (2)
m为依据公式(1)所计算出的供试品溶液中化合物的含量,0为供试品溶液制备中加入溶剂的体积,0为供试品溶液中所称取的冻干粉质量,d为提取液浓缩冻干后的冻干粉总质量,V为提取液体积
采用公式(2)分别计算药对配伍提取物中制首乌所含各化合物的含量,结果如表5所示。
采用SPSS 19.0软件对12个成分在药对配伍提取样品中与在制首乌单独提取样品中的含量进行检验,结果如表6所示,大部分成分含量发生显著变化(<0.05)。分别与当归、熟地黄、白芍3味补血药配伍后,制首乌中的1、8、9、11、12号成分含量均显著降低(<0.05),7号成分含量显著升高(<0.05);分别与党参、黄芪、甘草3味补气药配伍后,制首乌中的8、9、11、12号成分含量均显著降低(<0.05),5号成分含量显著升高 (<0.05);分别与麦冬、枸杞子2味补阴药配伍后,制首乌中的6、8~12号成分含量均显著降低(<0.05),与麦冬配伍后无含量显著升高的成分,在分别与枸杞子、墨旱莲2味补阴药配伍后,5号成分的含量均显著升高(<0.05)。
表5 半定量测定结果(, n = 3)
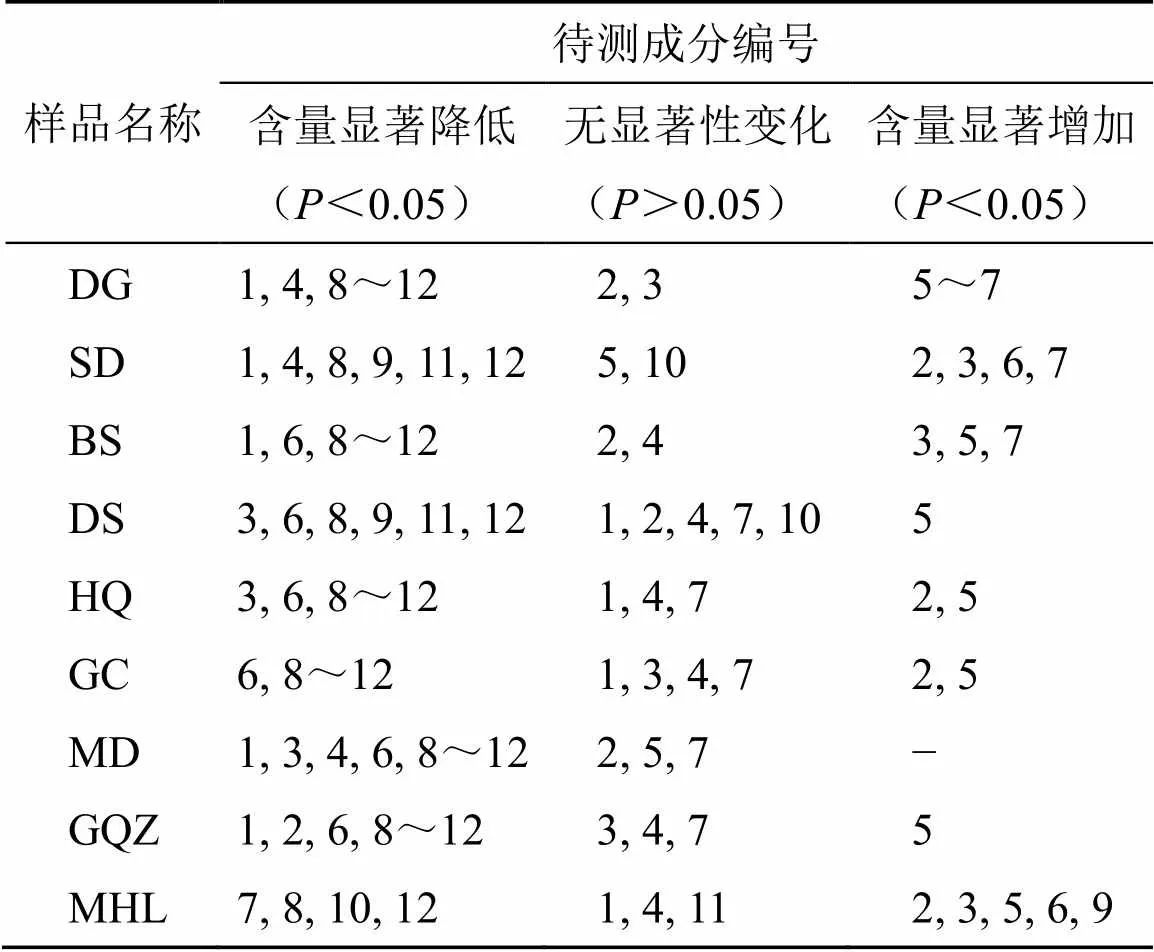
表6 配伍后制首乌成分含量变化分析结果
为更直观地表示制首乌与9味药物配伍后成分含量变化的整体情况,分别以含量显著降低(<0.05)、无显著性变化(>0.05)以及含量显著增加(<0.05)的成分数量与所测成分的总个数的百分比绘制条形图,以表示12个成分在其与9个药对配伍提取过程中含量变化情况,如图2-A所示;以log2(fold change)为横坐标,以检验显著性检验值的负对数(−lg)为纵坐标绘制首乌中各成分含量变化火山图(volcano plot),如图2-B所示,图中以=0.05为界限,在该界限上方的点即代表该成分在药对提取过程中发生了显著性变化,以log2(fold change)=0为界限,以各成分的坐标分别落在该界限的左侧、右侧代表配伍后相应成分含量的降低、升高。根据图2显示,制首乌与当归、熟地黄等8味药物配伍后成分含量的变化均以降低为主,与墨旱莲配伍后成分含量的变化以升高为主,其中以11号成分在制首乌-黄芪药对中含量降低最为显著,以9号成分在制首乌-墨旱莲药对中含量升高最为显著。
2.4 DPPH自由基清除能力测定
研究显示,制首乌具有较强的抗氧化活性[3-5]。为进一步研究药对配伍后的药理作用变化情况,本部分研究采用DPPH自由基清除法对药对配伍后的抗氧化能力变化进行测定。
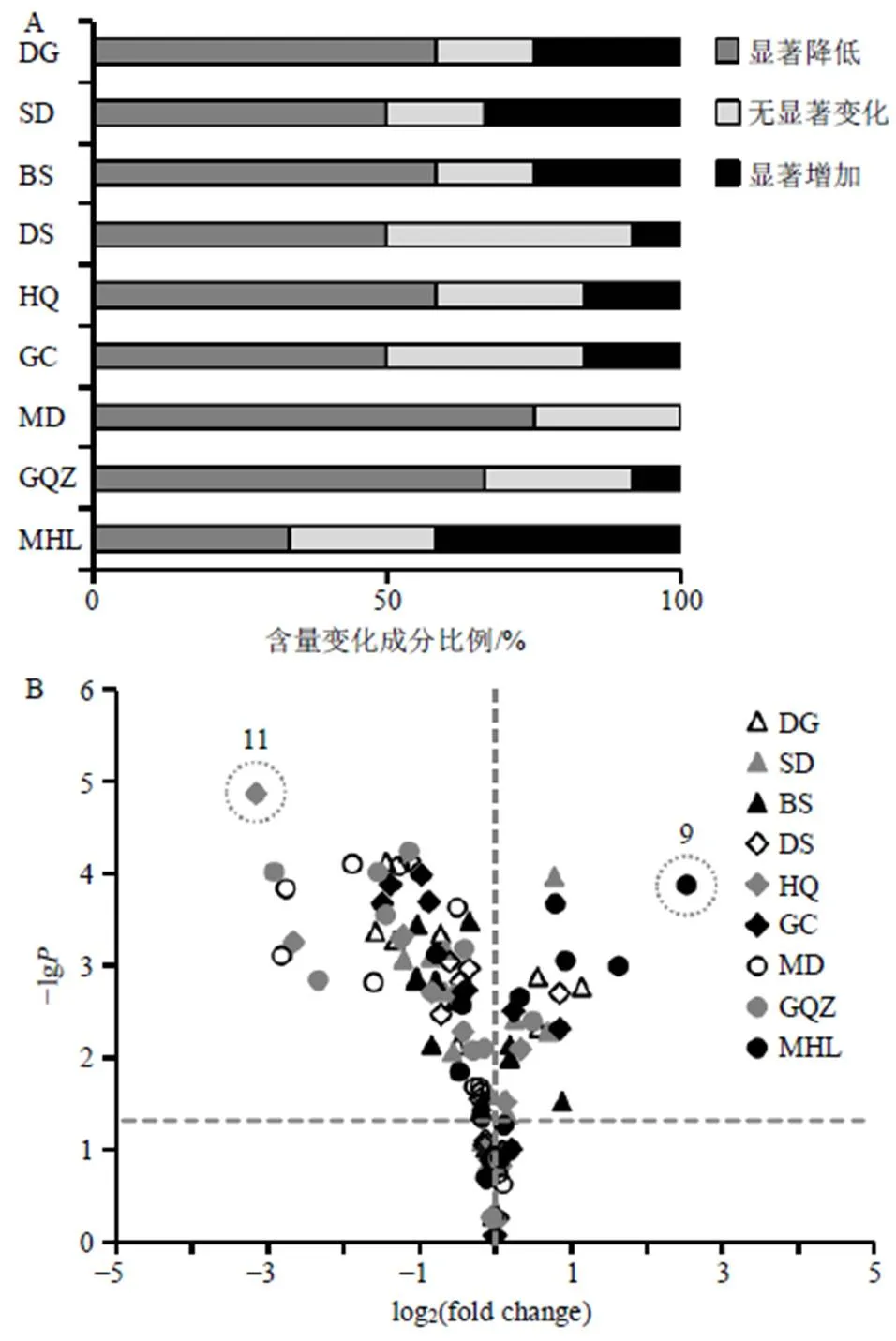
图2 配伍后制首乌成分含量变化分析图(一览图, A;火山图, B)
2.4.1 供试品溶液的配制 根据不同样品DPPH自由基清除能力的不同,精确称取适量提取物冻干粉,以蒸馏水超声溶解30 min后取出,温度降至室温后,定容到50 mL量瓶,3500 r/min离心20 min,取上清液备用。
2.4.2 DPPH自由基清除能力的测定 配制0.04 mg/mL的DPPH溶液,以2 mL DPPH溶液及2 mL不同质量浓度样品溶液、2 mL样品溶液及2 mL乙醇、2 mL DPPH溶液及2 mL乙醇配制不同混合溶液,分别于517 nm下测定其吸光度(A、A及0),平行3次。按照公式[清除率=1-(A-A)/0]计算不同提取物的DPPH清除率。以清除率为纵坐标,以提取物质量浓度的对数值(lg)为横坐标,以Graphpad Prism 6软件绘制样品清除自由基的量-效曲线(图3),并计算各样品清除自由基的能力,采用半数有效浓度(EC50)值表示,即清除率为50%时所需样品的质量浓度,结果如表7所示。结果显示,制首乌的EC50均小于其他9味中药,提示制首乌DPPH自由基清除能力高于其他9味中药。
如表7所示,制首乌分别与9味中药配伍为药对后的EC50均高于制首乌,且均低于相应的配伍药物单独提取样品,这一结果可以通过图3更直观地看出,即配伍后9个制首乌药对的量-效曲线较制首乌曲线右移,较相应的配伍药物的量-效曲线左移,表明制首乌药对的自由基清除能力低于制首乌,但高于相应的配伍药物。
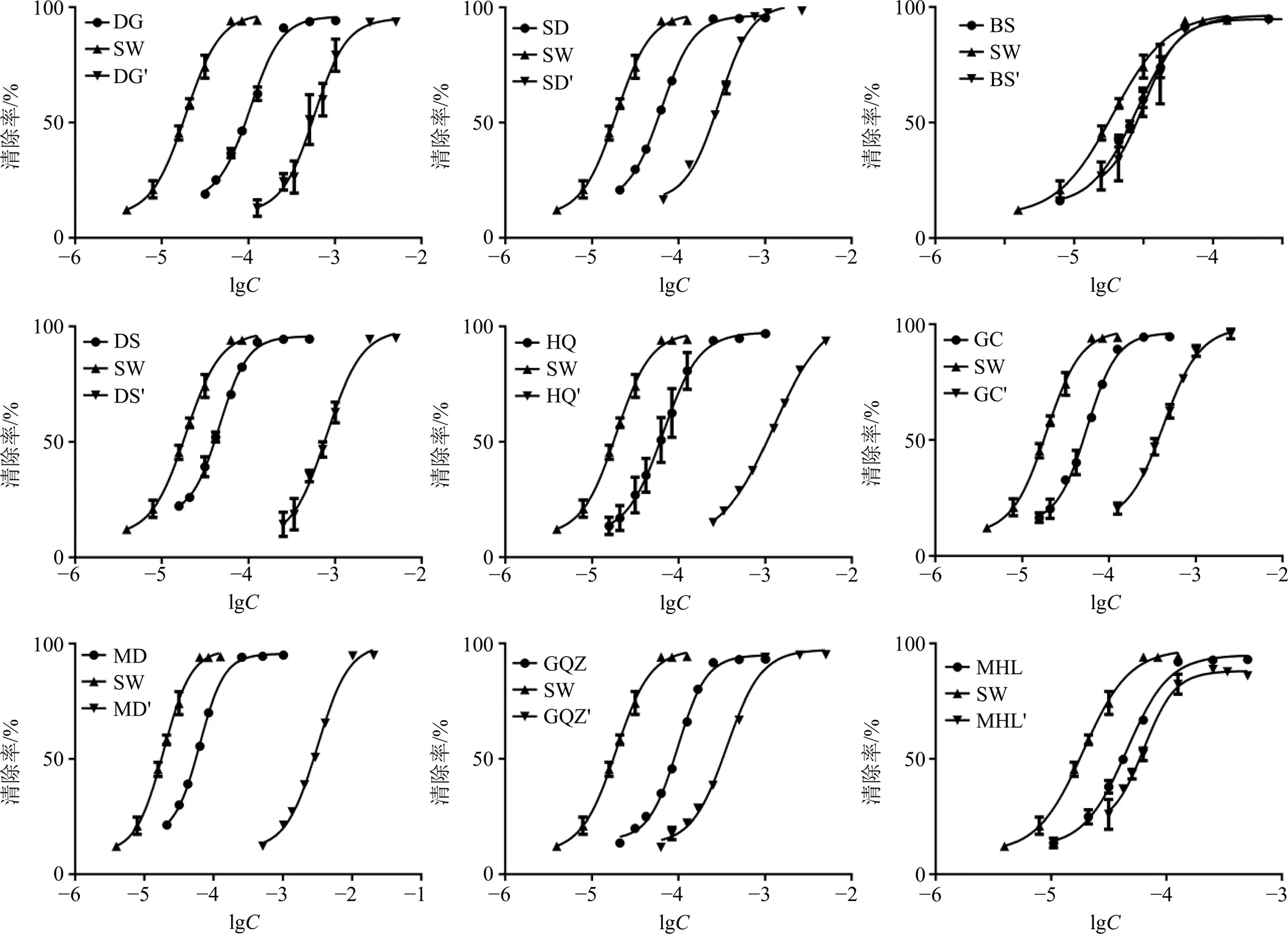
图3 DPPH自由基清除量-效拟合曲线
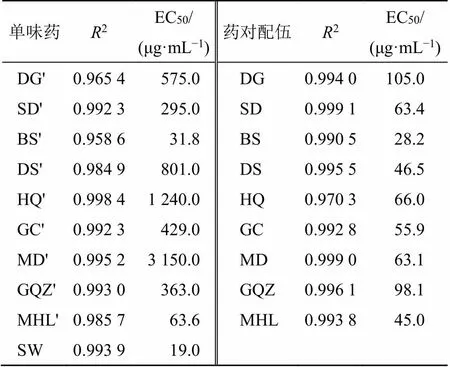
表7 DPPH自由基清除结果
2.5 量-效关系拟合
2.5.1 正交偏最小二乘法(orthogonal projections to latent structures,OPLS)模型的建立 为进一步研究制首乌中各成分含量对抗氧化活性的影响,本研究以表7中制首乌及9个制首乌药对的EC50值为值,以制首乌中12个成分的半定量分析结果为变量(1~12),采用SIMCA-P 14.1软件建立OPLS回归模型。模型中共提取5个主成分,2X与2Y的值分别为0.841、0.981,即可反映84.1%的变量的信息及98.1%的变量的信息,且2=0.962,表明该模型具有极好的预测能力。
采用置换检验(permutation test)对模型进行验证,结果如图4-A所示,2在轴截距为0.189,小于0.4,2在轴截距为−0.626,小于0.5,表明模型未出现过拟合。根据变量重要性投影值(variable importance in the projection,VIP),如图4-B所示,变量的VIP值反映了对模型拟合的贡献水平,以VIP值>1的变量为影响提取物抗氧化活性标志物,即色谱峰编号为8、12、7、11的化合物。
2.5.2 标志物的定性分析 采用LC-MS对标志物进行鉴定,采用“2.3.3”项下的色谱梯度洗脱程序1进行分离,质谱条件如下:离子源温度100 ℃,脱溶剂温度400 ℃,脱溶剂气体体积流量600 L/h,毛细管电压3 kV,锥孔电压40 V,采用正、负离子模式,扫描范围/100~1000。以甲酸钠溶液作为内标校正。结果见表8。
对于7号化合物与8号化合物来说,通过分析正离子/407 [M+H]+和负离子/405 [M-H]−,确定其相对分子质量均为406,进一步结合正、负离子模式下碎片峰均为分子离子丢失1分子葡萄糖基(/162)产生离子碎片峰/245 [M+H-glu]+、243 [M-H-glu]−,判断7号化合物与8号化合物极可能为同分异构体。根据液相色谱对照品的保留时间,确认8号化合物为-THSG,其裂解途径如图5-A所示。结合文献,-THSG经光照后其可发顺反异构变化转变为顺式结构[17]。因顺式结构无商品化的对照品,为进一步确证7号化合物的结构,将-THSG甲醇溶液置于光照环境下2 h后,8号化合物(-THSG)对应的色谱峰峰面积降低,同时7号化合物对应的色谱峰峰面积明显升高,因此,确定7号化合物为-THSG,其裂解途径如图5-a所示。
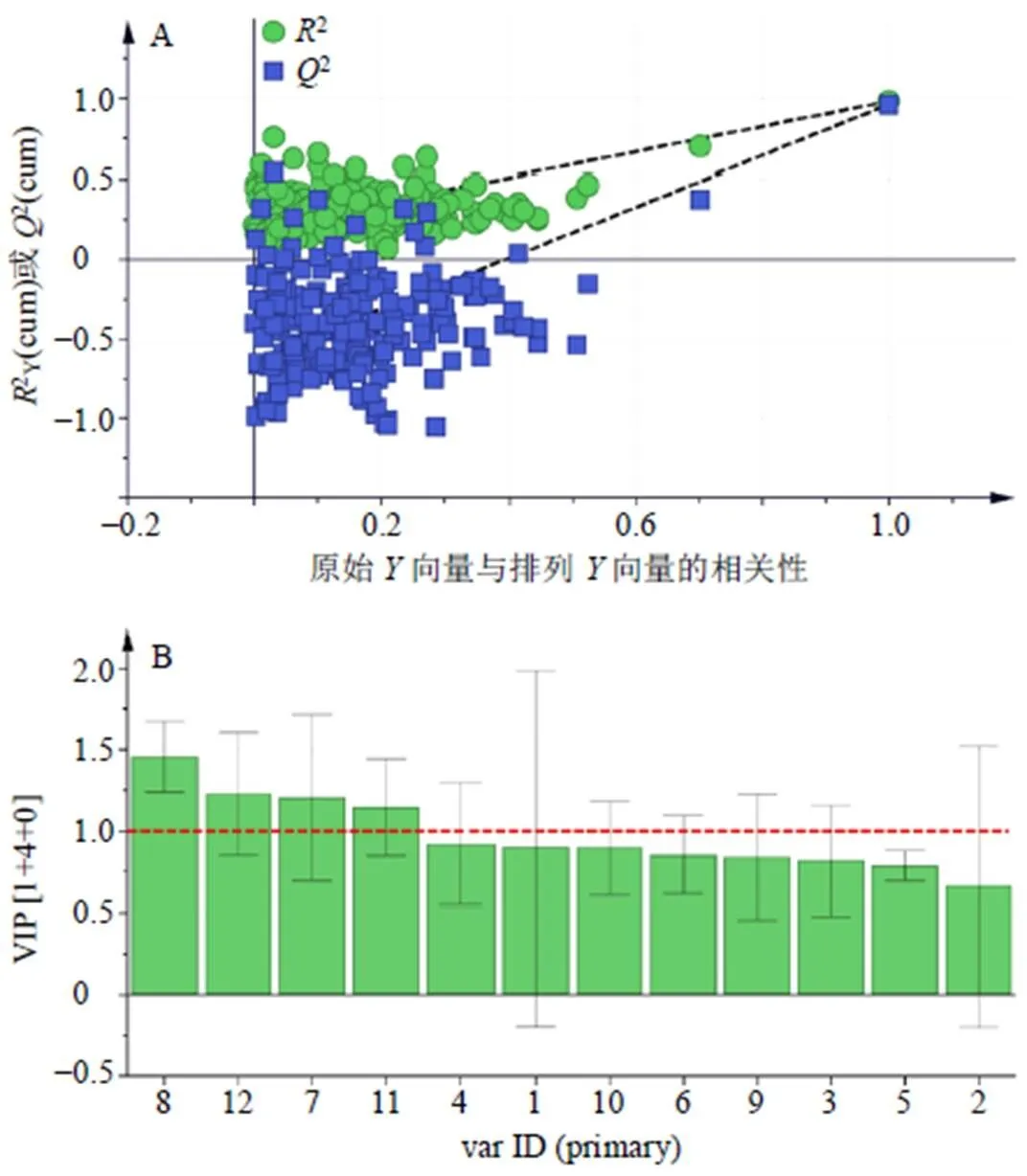
图4 OPLS模型置换检验图(A)和分析变量VIP图(B)
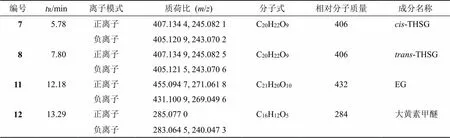
表8 标志物鉴定结果
11号化合物的正离子/455 [M+Na]+、负离子/431 [M-H]−判断其相对分子质量为432,正离子模式下加钠离子丢失1分子葡萄糖基及钠离子,形成碎片离子峰/271 [M+H-glu]+,负离子模式下分子离子峰丢失1分子葡萄糖基,形成碎片离子峰/269[M-H-glu]−,结合液相色谱中EG对照品的保留时间,确定11号化合物为EG,其裂解途径如图5-b所示。
12号化合物的正离子/285 [M+H]+、负离子/283 [M-H]−判断其相对分子质量为284,负离子模式下失去碎片/43,何首乌中主要含有二苯乙烯苷及蒽醌类物质[18],且蒽醌母核在离子碰撞中易失去母核基团中的CO并留存共轭体系是其主要的裂解方式,判断碎片离子峰/240为分子离子/283 [M-H]−丢失1分子CO以及1分子CH3所形成,其失去的CH3应该是其侧链取代基,结合文献报道确定12号化合物为大黄素甲醚[18-19],其裂解途径如图5-c所示。
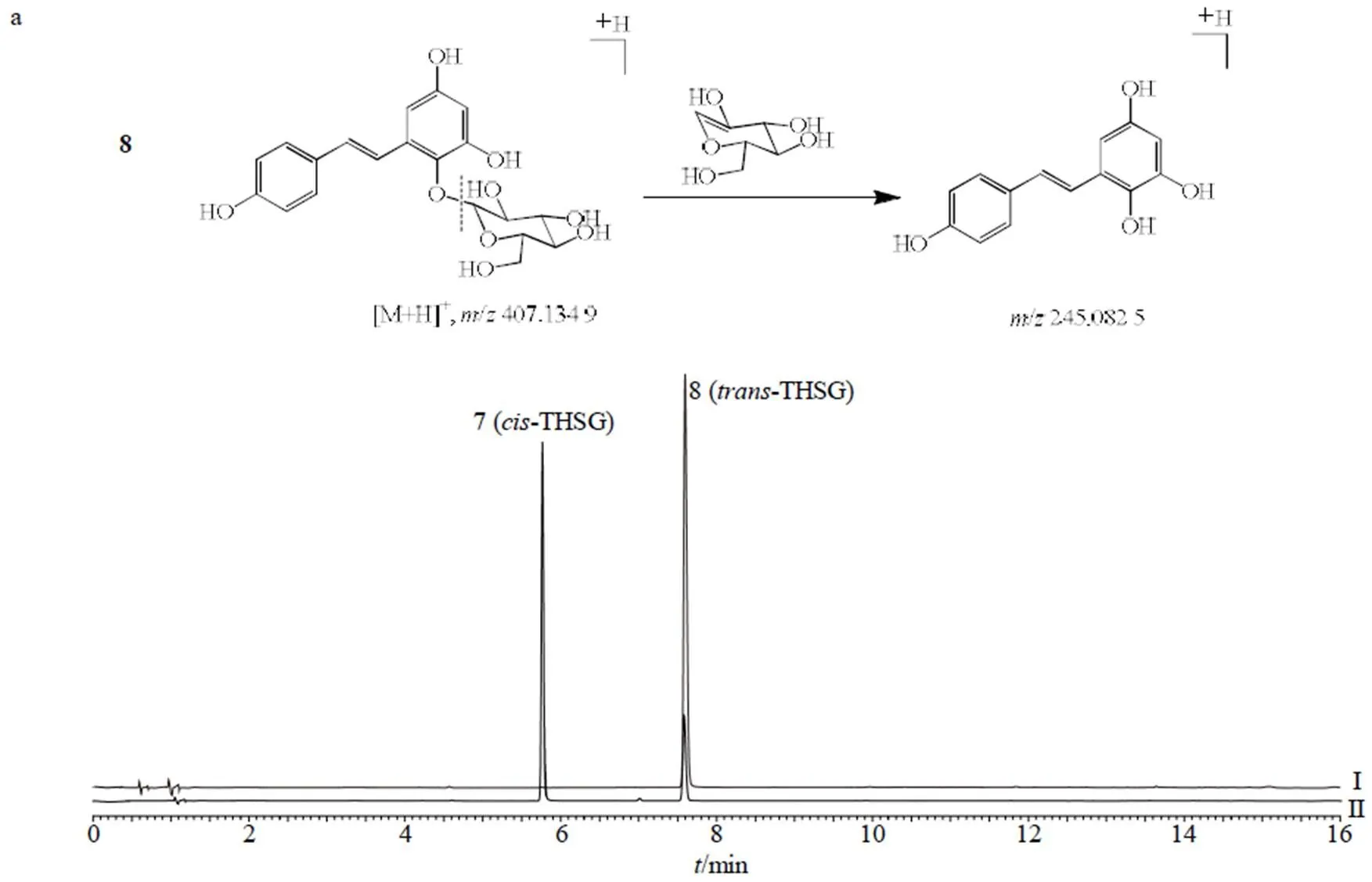
a-7、8号化合物裂解途径 b-11号化合物裂解途径 c-12号化合物裂解途径 I-trans-THSG对照品甲醇溶液色谱图 II-trans-THSG对照品甲醇溶液光照2 h后色谱图
a-fragmentation pathway of No. 7 compound and No. 8 compound b-fragmentation pathway of No. 11 compound c-fragmentation pathway of No. 12 compound I-chromatography of methanol solution of trans-THSG reference substance II-chromatogram of methanol solution of trans-THSG reference substance after 2 h illumination
图5 标志物结构解析
Fig. 5 Structural analysis of markers
3 讨论
中药药对是中医临床遣药组方常用的配伍形式[20-21],其配伍过程中成分含量变化是中药配伍机理研究的重要组成部分。由于中药中成分复杂多样、且对照品不易获取,因此难以对诸多成分进行含量测定是中药成分定量分析的瓶颈。参照文献所提出的单味药标定的半定量分析法[13],本实验对制首乌分别与9味补虚药配伍后12个化学成分的含量变化进行对比分析,结果显示配伍后制首乌中的大部分成分含量显著降低,仅有少数化合物含量显著增加。其中部分化合物的含量变化具有一定的规律,其规律可能对于深入研究制首乌与补虚药的配伍机理有提示作用,如8、10、12号色谱峰对应的化合物在制首乌与上述9味药物配伍后含量均显著降低。结合DPPH自由基清除作用的量-效回归分析中显示,8、12号色谱峰对应的化合物亦是影响配伍后药对抗氧化能力的标志物,其分别为- THSG、大黄素甲醚。本实验是以制首乌配伍过程中其所含成分的含量变化为核心展开的研究,研究结果显示制首乌中各化合物的含量变化与药对自由基清除能力间存在回归关系,但是,药对配伍共煎过程中,与制首乌配伍的药物中所含的成分含量亦可能发生改变,其成分的改变情况及其与抗氧化能力的关系可基于本实验半定量分析的思维方法进一步进行比较,将有助于快速筛选出配伍量-效关系的标志物,从而进行配伍机理的深入研究。
各化学成分在药物合煎与单煎间的含量差异除受到配伍的影响外,还受到提取溶剂体积影响,如药物配伍合煎可采用2种方法计算溶剂体积,一种是以各单味药的质量之和计算料液比的等倍数法,一种是保持单煎与合煎的溶剂体积一致的等体积法[22]。本研究采用的是等体积法,是因为考虑到中药在临床实际应用时的煎煮过程中不会因为其配伍药物而相应的将加水量翻倍增加,而是根据配伍药物的吸水量及最终期望的得液量而调整加水量[23]。为降低溶液体积对部分成分溶出的影响,采用了高于常用10倍(或8倍)液料比的20倍体积,并在该体积外额外加入相应药物吸水量,以保证制首乌在单煎、配伍共煎过程中溶剂体积的一致性。但等倍数法与等体积法对各成分含量的影响差异还有待进一步通过实验进行对比。
成分含量的变化是药物配伍与“单行”间药理活性差异的物质基础。本实验基于建立的半定量分析方法对制首乌与不同补虚药配伍共煎过程中成分含量及抗氧化能力变化进行分析,并通过建立量-效回归模型筛选出4个化学标志物,分别为顺式二苯乙烯苷、大黄素甲醚、反式二苯乙烯苷以及EG。以期通过本研究为制首乌与补虚药配伍机制的深入研究提供参考。
利益冲突 所有作者均声明不存在利益冲突
[1] 赵玉姣, 彭华胜. 历代本草何首乌图考及其“辨状论质”观 [J]. 中国中药杂志, 2020, 45(8): 1960-1967.
[2] 中国药典 [S]. 一部. 2015: 175-177.
[3] 梅雪, 余刘勤, 陈小云, 等. 何首乌化学成分和药理作用的研究进展 [J]. 药物评价研究, 2016, 39(1): 122-131.
[4] Lin P, He Y R, Lu J M,.lipid regulation mechanism of polygoni multifloriin high-fat diet fed rats [J]., 2014, 2014: 642058.
[5] Yu J, Xie J, Mao X J,. Comparison of laxative and antioxidant activities of raw, processed and fermented[J]., 2012, 10(1): 63-67.
[6] 孙艳涛, 王冰, 张明波, 等. 不同配比何首乌、牛膝药对指纹共有模式和基于主成分分析的等级评价研究 [J]. 中国医院药学杂志, 2020, 40(5): 510-514.
[7] 孙艳涛, 王冰, 康廷国. 何首乌-牛膝药对提取物抗维甲酸诱导的小鼠骨质疏松药效物质基础研究 [J]. 时珍国医国药, 2020, 31(4): 842-844.
[8] 栗焕焕, 任晓亮, 王萌, 等. 复方血脂宁配伍对主要活性成分溶出变化规律的影响 [J]. 中草药, 2017, 48(23): 4885-4890.
[9] 蔡新荣. 莱菔子与何首乌、熟地配伍致不良反应1例 [J]. 中国中西医结合杂志, 1996, 16(10): 633.
[10] Tunje Reginachizi, 叶阳烈, Sonauddin Ahmed, 等. 首乌熟地饮对MPTP致帕金森病小鼠模型多巴胺能神经元的影响 [J]. 中国中药杂志, 2016, 41(18): 3439-3442.
[11] 杜雪萌. 治疗脱发方剂的配伍规律研究 [D]. 南京: 南京中医药大学, 2016: 25-31.
[12] 张慧杰, 孙浩, 安雅婷, 等. 《中国药典》成方制剂中何首乌药对配伍规律分析 [J]. 中南药学, 2019, 17(4): 622-625.
[13] Li Z, Xiao S, Ai N,. Derivative multiple reaction monitoring and single herb calibration approach for multiple components quantification of traditional Chinese medicine analogous formulae [J]., 2015, 1376: 126-142.
[14] 周莹, 刘广锋, 冯娟, 等. 何首乌3种组分的提取及其清除DPPH自由基作用的研究 [J]. 广东药学院学报, 2014, 30(3): 301-304.
[15] 黄艳菲, 蔡旭, 冉波, 等. 基于谱效关系的藏药材全缘叶绿绒蒿全草(非花入药部位)抗氧化质量标志物初步研究 [J]. 中草药, 2020, 51(17): 4521-4530.
[16] 穆兰澄, 仝小林, 刘峰,等. 中药饮片煎煮过程中吸水量的实验研究 [J]. 中国实验方剂学杂志, 2010, 16(4): 7-8.
[17] Lin L, Ni B, Lin H,. Traditional usages, botany, phytochemistry, pharmacology and toxicology ofThunb.: A review [J]., 2015, 159: 158-183.
[18] Meng Y, Li C, Li R,.-stilbene glucoside ininduces immunological idiosyncratic hepatotoxicity in LPS-treated rats by suppressing PPAR-γ[J]., 2017, 38(10): 1340-1352.
[19] 董红娇, 陈晓虎, 曾锐. UPLC-Q-Exactive四级杆-静电场轨道阱高分辨质谱联用快速分析民族药小大黄的化学成分 [J]. 中草药, 2016, 47(14): 2428-2435.
[20] 唐于平, 尚尔鑫, 陈艳琰, 等. 药对配伍效应与功效物质现代研究方法与策略 [J]. 药学学报, 2019, 54(9): 1564-1573.
[21] 周远, 苏式兵. 中药复方配伍的研究方法及其进展 [J]. 中国实验方剂学杂志, 2019, 25(23): 202-208.
[22] 乔三洋, 王学勇, 李耿, 等. 基于化学全息研究四物汤煎煮溶出规律 [J]. 中草药, 2020, 51(19): 4960-4971.
[23] 张璐, 桂新景, 孟菲, 等. 中药饮片吸水率变化规律及中药复方汤剂相对密度预测模型研究 [J]. 中国中药杂志, 2020, 45(15): 3681-3688.
Study on change of ingredients content and DPPH free radical scavenging activity of drug pairs withbased on semi-quantitative analysis
ZHANG Hui-jie1, REN Xiao-liang2, SUN Hao1, WANG Ya-qi1, WANG Lei1, LIANG Ying1, ZHANG Yu1, LIU Yan1
1. Tianjin Academy of Traditional Chinese Medicine Affiliated Hospital, Tianjin 300120, China 2. Tianjin University of Traditional Chinese Medicine, Tianjin 301617, China
To study the changes of ingredients content and DPPH free radical scavenging activity of(PMRP) combined with nine tonic herbs by semi-quantitative analysis.The semi-quantitative analysis method of multiple components was established by UPLC-DAD, and the method was used to analyze the changes of components of PMRP while it was compatible with nine tonic herbs [Danggui (), Shudihuang (), Baishao (), Dangshen (), Huangqi (), Gancao (et), Maidong (), Gouqizi (), and Mohanlian ()]. DPPH method was used to determine the free radical scavenging activity of single drug and herb pair. The dose-effect curves were drawn and the half scavenging concentration (EC50) of each sample was calculated. Then, a quantity-effect regression model was established by multivariate statistical analysis. The chemical markers of quantity-effect relationship were screened in the model and qualitatively analyzed by mass spectrometry.The results of five validation methods, namely linearity and range, accuracy, precision, repeatability and stability, showed that the proposed semi-quantitative analysis method was suitable for the quantitative analysis of 12 components in PMRP. The results of content analysis showed that the content of 12 components changed in varying degrees. The content of 33% of 12 components in PMRP was decreased significantly (< 0.05) and the content of 42% of 12 components was increased significantly (< 0.05) after being combined with. In combination with eight other medicines, at least 50% of 12 components were significantly lower (< 0.05) than in PMRP. The results of antioxidant test showed that the DPPH free radical scavenging ability of PMRP was higher than that of other nine medicines, DPPH free radical scavenging ability of 9 herb pairs was lower than that of PMRP, but higher than that of nine corresponding tonic herbs. A quantity-effect OPLS regression model was established, the value of2X,2Yand2of the model was 0.841, 0.981 and 0.962, respectively. Four chemical markers of quantity-effect relationship were selected and were qualitatively analyzed, namely-2,3,5,4′-tetrahydroxy styrene-2--β-- glucoside, physcion (-THSG),-2,3,5,4′-tetrahydroxy styrene-2--β--glucoside (-THSG), emodin-8--β--glucoside (EG).The-quantitative analysis method established in this paper can be used to study the changes of ingredients content of PMP while it was compatible with nine tonic herbs. And-THSG, physcion,-THSG, EG were the chemical markers of quantity and DPPH free radical scavenging activity of PMP in 9 herb pairs.
; herb pairs; tonic herbs; semi-quantitative analysis; DPPH method; free radical scavenging activity;;;;;;et;;;; multivariate statistical analysis; chemical marker;-2,3,5,4′-tetrahydroxy styrene-2--β--glucoside; physcion;-2,3,5,4′-tetrahydroxy styrene-2--β--glucoside; emodin-8--β--glucoside
R286.02
A
0253 - 2670(2021)07 - 1924 - 13
10.7501/j.issn.0253-2670.2021.07.009
2020-11-09
国家重点研发计划项目(2017YFC1703400);天津市科技计划项目(17ZXMFSY00030);天津市卫生健康委员会、天津市中医药管理局中医中西医结合科研课题青年项目(2019025);天津市中医药管理局中医中西医结合科研课题面上项目(13024);天津市卫生健康委员会中医药重点领域科研项目(2019002)
张慧杰,博士,主管药师,从事中药分析相关研究。Tel: (022)27339599 E-mail: jyhuijie@163.com
梁 颖,硕士,主任药师,硕士生导师,从事中药学、临床药学相关研究。Tel: (022)27339599 E-mail: tjszyyyxb_ly@163.com
张 宇,医学博士,主任医师,博士生导师,从事中医外科学及网络药理学相关研究。Tel: (022)27345050 E-mail: niuniuzy7375@aliyun.com
[责任编辑 郑礼胜]

