基于流式分析技术的奶粉中金黄色葡萄球菌活菌快速定量检测方法研究
王 斌, 隋志伟, 刘思渊, 王 晶, 傅博强, 王 义
(1.吉林农业大学生命科学学院,吉林 长春 130118;2.中国计量科学研究院前沿计量科学中心,北京 100029)
1 引 言
金黄色葡萄球菌(Staphylococcusaureus)是一种重要的食源性致病菌,是导致皮肤感染、肺炎、败血症、心内膜炎和其他感染的重要原因,也会引起食物中毒[1]。在所有食品安全事件中,金黄色葡萄球菌是引起食源性疾病的主要原因之一[2]。根据美国国家疾控制中心的报告,每年在美国金黄色葡萄球菌感染50万病例,占整个细菌性食物中毒的33%,加拿大为45%,其他欧洲国家如匈牙利、芬兰等占50%以上[3]。而我国每年由金黄色葡萄球菌引起的感染事件也非常多[4]。金黄色葡萄球菌是奶牛乳腺炎的主要病原体之一,会引起奶及奶制品的污染[5,6]。奶粉作为婴幼儿的日常食品,其安全性直接影响婴幼儿的健康[7],因此,金黄色葡萄球菌快速高效检测方法的研究对于保障乳及其制品的安全至关重要。
目前,奶粉中金黄色葡萄球菌的检测主要依赖于平板计数法(GB 4789.10),但却费时费力[8],同时也无法检测处于活的非可培养(viable but non-culturable,VBNC)状态的细菌,易造成漏检[9]。近年来,许多新兴方法被开发出来,用于实现奶粉中金黄色葡萄球菌的快速检测,例如PetrifilmTM测试片法[10]和聚合酶链反应(PCR)法[11]等,但是,这些方法检测时间仍然较长,特别是PCR法由于检测目标是细菌核酸而无法区分死活菌,从而导致检测结果出现假阳性[12]。流式分析法有着快速、高效且能区分死活菌的优点,现已被广泛应用于致病菌检测领域[13,14],因此,流式分析法有望解决乳及乳制品中致病菌检测的技术瓶颈[15,16]。
由于流式分析法具有快速灵敏等优点,国内外许多学者开始尝试研究将其用于金黄色葡萄球菌的检测。董晓林等采用特异性适配体实现对纯培养的金黄色葡萄球菌特异性检测,检测时长为40 min,然而该方法检测限较高,为108CFU[17]。Meng等采用万古霉素结合的磁珠富集金黄色葡萄球菌,虽然通过流式分析法能够在120 min内检测到33 CFU的金黄色葡萄球菌,但是该方法无法排除死菌的干扰[18]。Rüger等和Li等分别通过流式分析法来评价金黄色葡萄球菌的存活率和超声波处理对金黄色葡萄球菌的损伤作用[19,20]。然而,他们研究建立的方法均不能特异性检测金黄色葡萄球菌。因此,目前尚无将流式分析法应用于奶粉中金黄色葡萄球菌快速定量检测的报道。
本研究拟以金黄色葡萄球菌为研究对象,结合流式分析法和免疫荧光标记法,建立了一种奶粉中金黄色葡萄球菌活菌的快速定量检测方法,旨在进一步缩短检测周期、提高定量检测的准确性,以期实现乳制品中金黄色葡萄球菌活菌的快速、高效、精确定量检测,为食源性致病菌的快速检测和预警提供重要的技术保障。
2 材料与方法
2.1 试剂与仪器
2.1.1 材料与试剂
本研究所用的菌株均为标准菌株,购于中国工业微生物菌种保藏管理中心和美国菌种保藏中心,试验所用菌株名称及编号见表1。
本研究以金黄色葡萄球菌(Staphylococcusaureus)标准菌株(ATCC 6538P)作为研究的目标菌株,包括金黄色葡萄球菌的表1中其他48株菌株作为本研究对照菌株。
主要试剂:脑心浸出液肉汤(BHI)、磷酸盐缓冲溶液(PBS)、Baird-Parker琼脂、亚碲酸钾卵黄增菌液均购于北京陆桥技术有限责任公司;异丙醇购于北京化工厂;偶联有异硫氰酸荧光素(FITC)的金黄色葡萄球菌多克隆抗体(FITC-ab)购于美国KPL公司;牛奶中微生物快速纯化试剂盒购于北京亦泰生物技术有限公司;荧光染料碘化丙啶(PI)购于美国Thermo Fisher Scientific公司;美素佳儿奶粉购于菲仕兰食品贸易有限公司。
2.1.2 仪器与设备
A50-Micro型流式分析仪,英国Apogee公司;恒温培养箱,上海精宏实验设备有限公司;HZQ-X100型恒温振荡培养箱,江苏太仓市实验设备厂;BSC-1600ⅡB2型生物安全柜,苏州安泰空气技术有限公司;1-14型离心机,美国Spectronics公司。
2.2 方法
2.2.1 细菌菌悬液的制备
将第2.1.1节中所述的49株常见标准菌株分别接种于7 mL BHI培养基中,于37 ℃震荡培养12 h。吸取1 mL菌悬液,12 000g离心5 min后弃上清,以1 mL无菌磷酸盐缓冲溶液(PBS,pH 7.2)重悬,得到活菌菌悬液,备用。
经预实验验证,异丙醇处理会导致细菌死亡[21],因此本研究吸取1 mL金黄色葡萄球菌(ATCC 6538P)活菌菌悬液,加入异丙醇(终浓度70%),室温处理30 min,12 000g离心5 min后弃上清,沉淀以1 mL PBS重悬,得到死菌菌悬液,备用。
2.2.2 金黄色葡萄球菌的荧光标记及检测条件设置
以绿色荧光染料FITC[22]偶联的抗体FITC-ab特异性标记金黄色葡萄球菌,再辅以红色荧光材料PI[23]对死亡的细菌进行标记。FITC的激发波长为495 nm、发射波长为519 nm,PI的激发波长为535 nm、发射波长为615 nm。
参照刘思渊等[24,25]的试验方法,对反应条件进行优化,设置如下:1 mL样本的反应体系中PI的终浓度为1 μg/mL,FITC-ab的终浓度为1 μg/mL,孵育温度为37 ℃,孵育时间为15 min。
表1 试验所用菌株Tab.1 List of all bacterial strains used in this study
流式分析仪具有3种检测荧光通道:FL1=525λ,FL2=575λ,FL3=680λ。检测时间为30 s,分析速度为10.5 μL/min,以FL1荧光通道检测FITC-ab标记的金黄色葡萄球菌,呈现绿色;以FL3荧光通道检测PI标记的死菌,呈现红色。通过计数相应荧光信号,直接获得金黄色葡萄球菌的浓度。
2.2.3 流式分析法检测活菌的可行性
为了探讨流式分析法检测金黄色葡萄球菌活菌的可行性,将第2.2.1节中制备的金黄色葡萄球菌活菌与死菌分别与FITC-ab和PI两种荧光探针的不同组合进行标记,制备出6组样品,分别为:A,未标记荧光的金黄色葡萄球菌活菌;B,金黄色葡萄球菌活菌+FITC-ab;C,金黄色葡萄球菌活菌+PI;D,金黄色葡萄球菌死菌+PI;E,金黄色葡萄球菌活菌+PI+FITC-ab;F,金黄色葡萄球菌死菌+PI+FITC-ab。6组样品经37 ℃孵育15 min后,采用流式分析法进行检测。
2.2.4 流式分析法特异性验证[26]
将第2.2.1节中培养的49株标准菌株的菌悬液分别稀释成浓度约为107CFU/mL的菌液,与FITC-ab(终浓度为1 μg/mL)在37 ℃下孵育15 min,用流式分析法验证该抗体的特异性。
2.2.5 流式分析法区分死活菌的验证
参照第2.2.1节的方法获得金黄色葡萄球菌活菌和死菌菌悬液。碘化丙啶为红色荧光染料,具有膜选择性通透性,不能穿过活菌的细胞膜,只能穿过破损的细胞膜而对细胞核染色。将不同体积比(0/10,1/9,5/5,9/1,10/0)的金黄色葡萄球菌死菌和活菌菌悬液混匀,与FITC-ab和PI进行孵育后采用流式分析法检测。
2.2.6 流式分析法的线性与灵敏度[27]
金黄色葡萄球菌经无菌PBS溶液10倍系列稀释后,获得终浓度为2.32×101~2.32×108CFU/mL浓度的活菌菌悬液,再分别采用国家标准中金黄色葡萄球菌平板计数法[28]和本研究建立的流式分析法进行定量检测,验证流式分析法的线性与灵敏度。
2.2.7 人工污染奶粉样品的检测
将购买的奶粉采用国家标准中金黄色葡萄球菌平板计数法检测不含金黄色葡萄球菌后[27] ,取25 g奶粉溶于225 mL灭菌后的PBS中,充分混匀,制备奶粉稀释液。将用无菌PBS缓冲液10倍系列稀释的金黄色葡萄球菌菌悬液离心后,弃上清保留沉淀,加入1 mL奶粉稀释液,制备成终浓度为3.00×103~3.00×108CFU/mL的人工污染奶粉样品。采用牛奶中微生物快速纯化试剂盒去除奶粉稀释样本中的蛋白颗粒和脂肪,纯化出金黄色葡萄球菌,样品处理步骤如下:吸取500 μL的人工污染奶粉样品置于2 mL的离心管中,加入1 mL纯化试剂盒处理液,反复颠倒离心管至少100次,使之混匀,12 000g离心5 min,弃上层脂肪和中层清液,保留离心管底部的沉淀。吸取500 μL的PBS溶液重悬沉淀,全部转移到新的离心管中,12 000g离心5 min,弃上清,取500 μL的PBS溶液重悬沉淀,得到纯化的样品溶液,加入FITC-ab和PI进行孵育,最终采用流式分析仪进行检测。
3 结 果
3.1 金黄色葡萄球菌活菌的荧光标记
采用FITC-ab来标记金黄色葡萄球菌,再通过PI区分死菌和活菌。如图1所示,横坐标为FL1绿色荧光通道;纵坐标为FL3红色荧光通道。通过圈“十”字门的方法[29]把双参数散点图划分为4个象限:PI(+)表示细菌被标记上红色荧光,PI(-)表示细菌未被标记上红色荧光,FITC(+)表示细菌被标记上绿色荧光,FITC(-)表示细菌未被标记上绿色荧光。图中,A为未标记荧光的金黄色葡萄球菌活菌;B为金黄色葡萄球菌活菌+ FITC-ab;C为金黄色葡萄球菌活菌+PI;D为金黄色葡萄球菌死菌+PI;E为金黄色葡萄球菌活菌+PI+FITC-ab;F为金黄色葡萄球菌死菌+PI+FITC-ab。金黄色葡萄球菌活菌(图1B)和死菌(图1F)与FITC-ab反应后,均被标记上绿色荧光;而金黄色葡萄球菌死菌(图1D)与PI反应后,被标记上红色荧光,活菌(图1C)则不会被标记上红色荧光;当金黄色葡萄球菌死菌(图1F)或活菌(图1E)分别同时与PI和FITC-ab反应后,活菌只会被标记上绿色荧光,死菌则同时被标记上红色和绿色两种荧光。结果表明,流式分析法可以检测到金黄色葡萄球菌活菌。
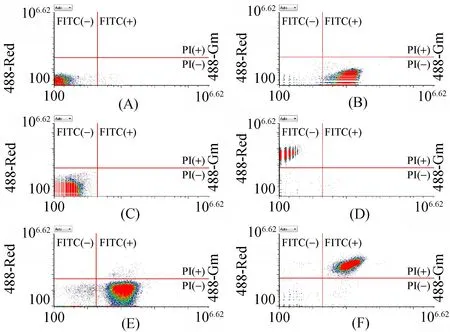
图1 金黄色葡萄球菌的荧光标记Fig.1 Fluorescent labeling of Staphylococcus aureus
3.2 流式分析法的特异性
从生产加工到运输的过程中,乳及乳制品易被多种微生物污染,如大肠杆菌,金黄色葡萄球菌,沙门氏菌,单增李斯特氏菌等[30],因此本研究选取了乳制品中常见的49株菌株。将49株菌株分别与金黄色葡萄球菌的多克隆抗体FITC-ab进行孵育后,采用流式分析法进行检测。图2中横线代表圈门,圈门内事件表示FL1通道检测出荧光,即金黄色葡萄球菌阳性。结果显示见图2,10株金黄色葡萄球菌经FL1荧光通道均能在横线圈门内检测出荧光,而其余39株对照菌株未在横线圈门内检测到荧光。说明FITC-ab只与金黄色葡萄球菌发生反应,不与非金黄色葡萄球菌发生反应。因此,建立的流式分析法可以特异地检测金黄色葡萄球菌。
3.3 金黄色葡萄球菌区分死活菌的验证
将制备的金黄色葡萄球菌死菌菌悬液和活菌菌悬液分别按照0:10,1:9,5:5,9:1和10:0不同体积比例混合均匀,再采用流式分析法进行检测。结果显示见表2,流式分析法测得的金黄色葡萄球菌死菌和活菌的比例与添加比例接近,见图3,说明流式分析法可以定量测量金黄色葡萄球菌死菌和活菌。
3.4 流式分析法的线性与灵敏度
金黄色葡萄球菌经无菌PBS缓冲溶液进行10倍系列稀释后,分别采用流式分析法与平板计数法进行检测。结果显示(表3和图4),当金黄色葡萄球菌的浓度在103~108CFU/mL时,流式分析法检测出的结果与平板计数法的结果基本一致且线性良好(R2=0.999 9)。然而,当金黄色葡萄球菌的浓度小于103CFU/mL时,流式分析法与平板计数法的结果偏差较大。因此,流式分析法定量检测PBS中金黄色葡萄球菌的浓度范围为1.90×103~2.36×108CFU/mL,灵敏度为1.90×103CFU/mL。
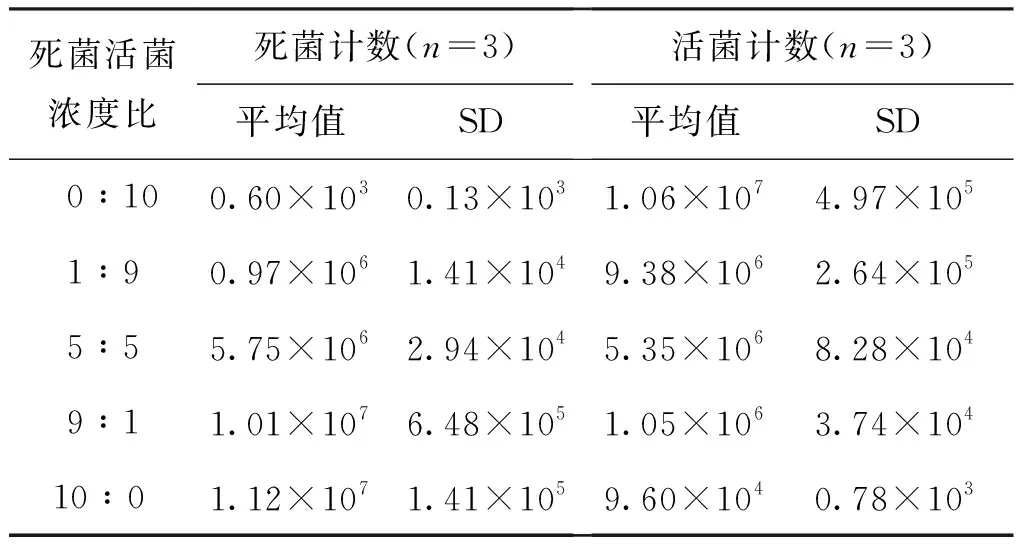
表2 流式分析法检测金黄色葡萄球菌死活菌的结果
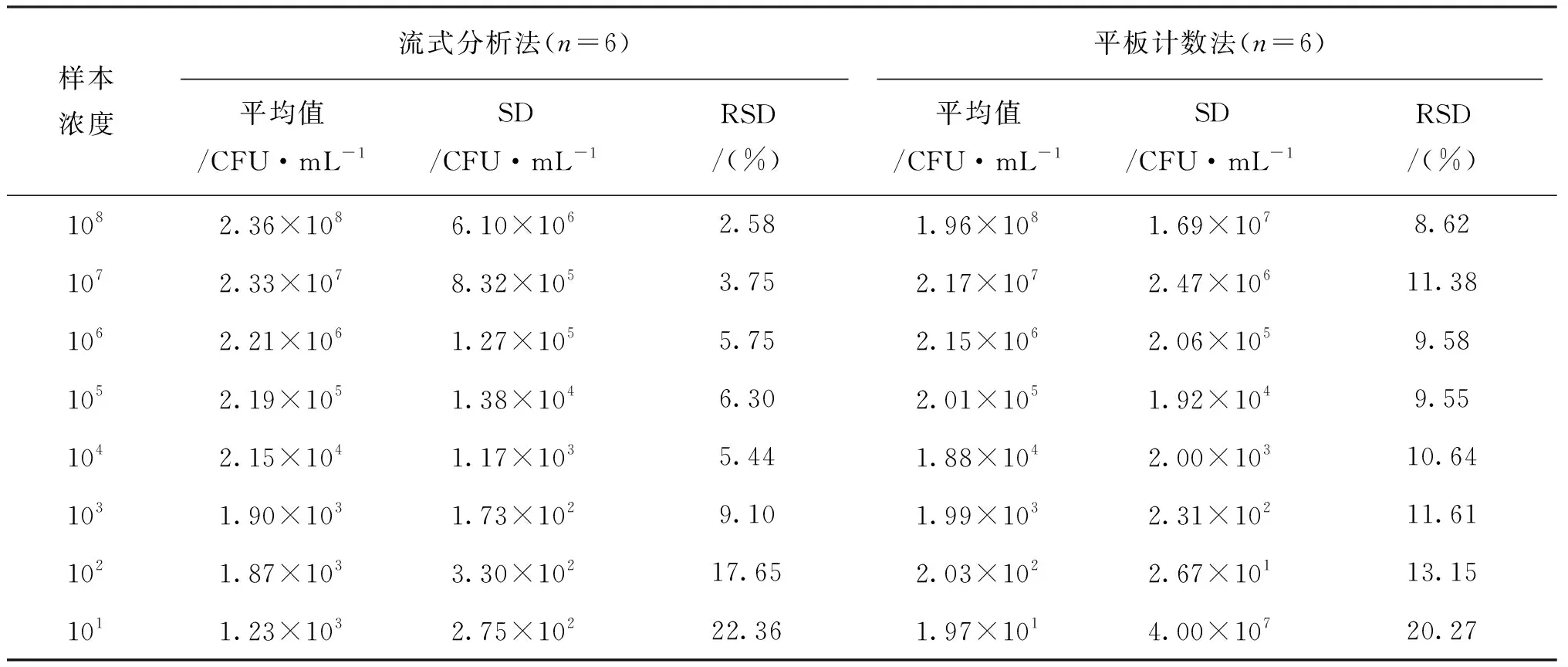
表3 流式分析法与平板计数法检测金黄色葡萄球菌的结果 Tab.3 Results of FCM-based method and plate counting method in detection for Staphylococcus aureus
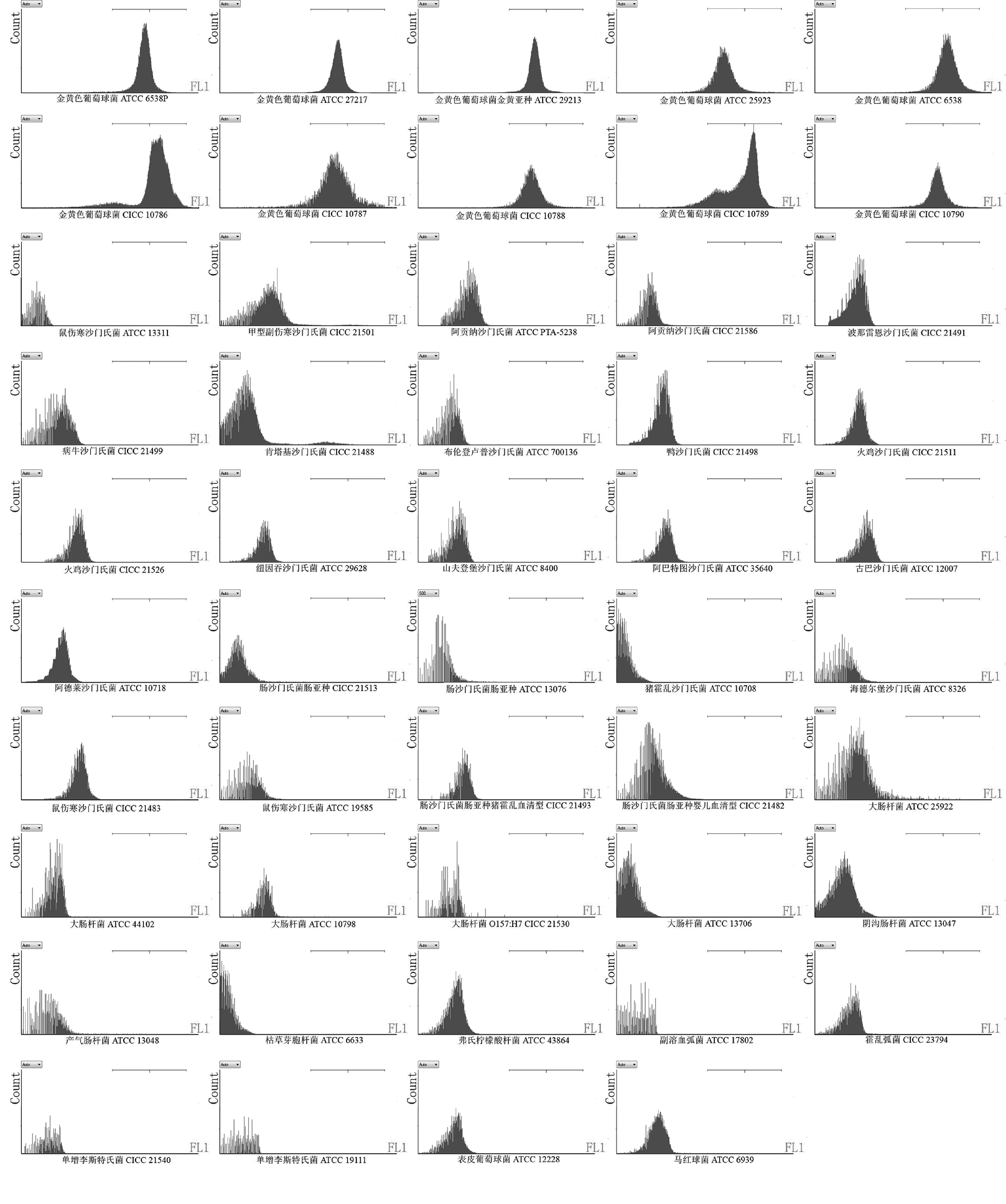
图2 流式分析法的特异性Fig.2 Specicity of FCM-based method for Staphylococcus aureus
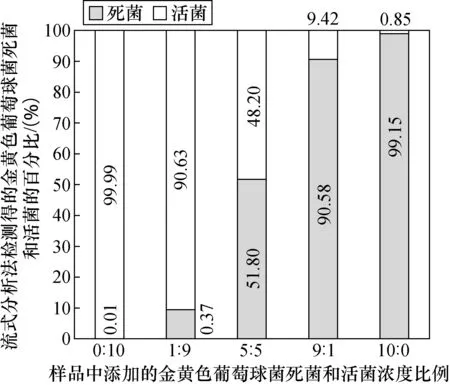
图3 流式分析法检测金黄色葡萄球菌死菌和活菌的百分比Fig.3 Percentage of viable and dead Staphylococcus aureus cells detected by FCM-based method
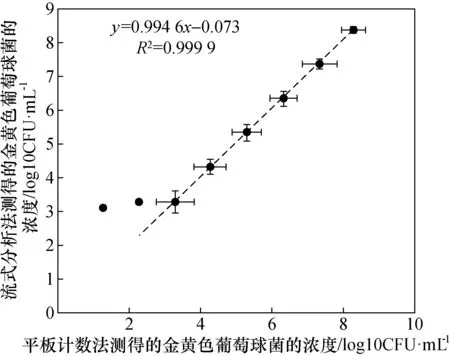
图4 流式分析法与平板计数法定量检测金黄色葡萄球菌活菌的线性关系Fig.4 The linear relationship between the results of quantitative detection for viable Staphylococcus aureus by FCM-based method and plate counting method
3.5 人工污染奶粉样品的检测
将用无菌PBS缓冲液10倍系列稀释的金黄色葡萄球菌菌悬液,离心弃上清,加入奶粉稀释液制备成人工污染金黄色葡萄球菌的奶粉样品。使用牛奶中微生物快速纯化试剂盒处理后,通过流式细胞仪进行检测,结果显示(表4),当金黄色葡萄球菌的浓度在103~108CFU/mL时,流式分析法检测奶粉中金黄色葡萄球菌得到的结果与添加浓度基本一致。因此,流式分析法定量检测奶粉样品中金黄色葡萄球菌的浓度范围为2.72×103~2.80×108CFU/mL,灵敏度为2.72×103CFU/mL。
4 讨 论
我国食品安全国家标准 GB 10765-2010《食品安全国家标准婴儿配方食品》明确规定克罗诺杆菌(原阪崎肠杆菌)、沙门氏菌和金黄色葡萄球菌是婴儿配方食品中必检的3种食源性致病微生物,并且公布了其相应的微生物限量指标。因此,奶粉中金黄色葡萄球菌的快速准确检测具有重要的公共卫生学意义。本研究采用流式分析技术,经FITC-ab和PI双色荧光标记后,建立了一种奶粉中金黄色葡萄球菌活菌的快速定量检测方法。
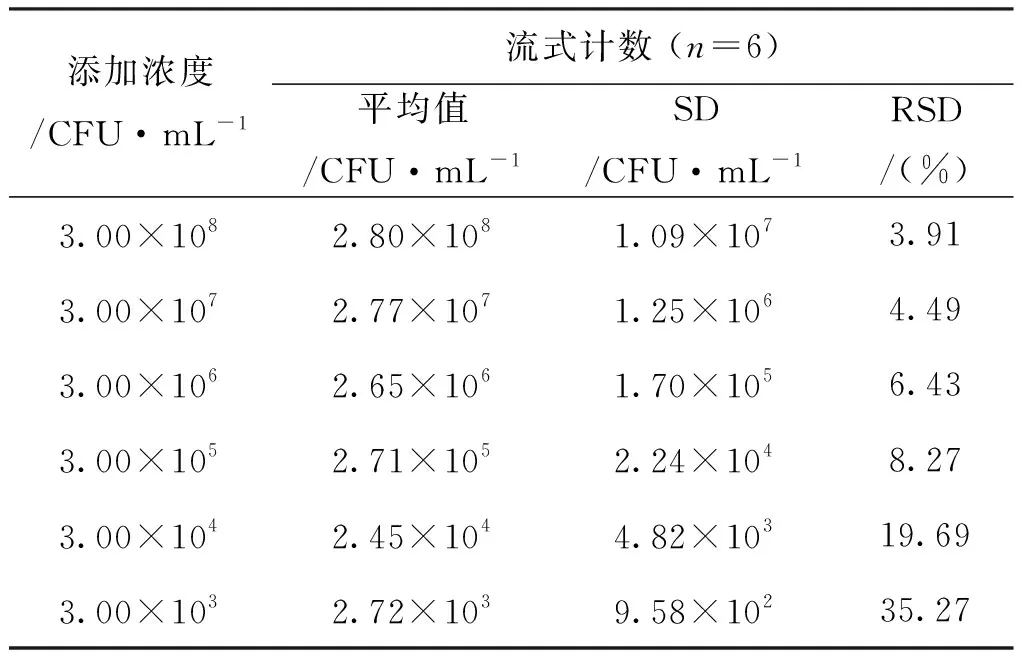
表4 流式分析法检测人工污染金黄色葡萄球菌的奶粉样品的结果 Tab.4 Testing results of Staphylococcus aureus in artificially infected milk powder samples by FCM-based method
抗体的特异性是决定流式分析法成功与否的关键,因此,本研究选择偶联有FITC的金黄色葡萄球菌多克隆抗体作为金黄色葡萄球菌属特异性标记探针[31],将其与10株金黄色葡萄球菌菌株和其它39株非金黄色葡萄球菌菌株进行孵育后,经流式分析法检测只有金黄色葡萄球菌被标记上荧光,证明该抗体对于检测金黄色葡萄球菌具有良好的特异性,同时也表明,所建立的流式分析法特异性良好。
在流式分析法检测整个过程中,奶粉样本前处理即金黄色葡萄球菌纯化的时间为15 min,金黄色葡萄球菌与FITC-ab和PI的孵育时间为15 min,流式分析时间约为5 min,总计用时约35 min。而平板计数方法用时20~24 h[27]、PetrifilmTM测试片法用时22~26 h[10],PCR法用时约1.5 h[11](见表5)。
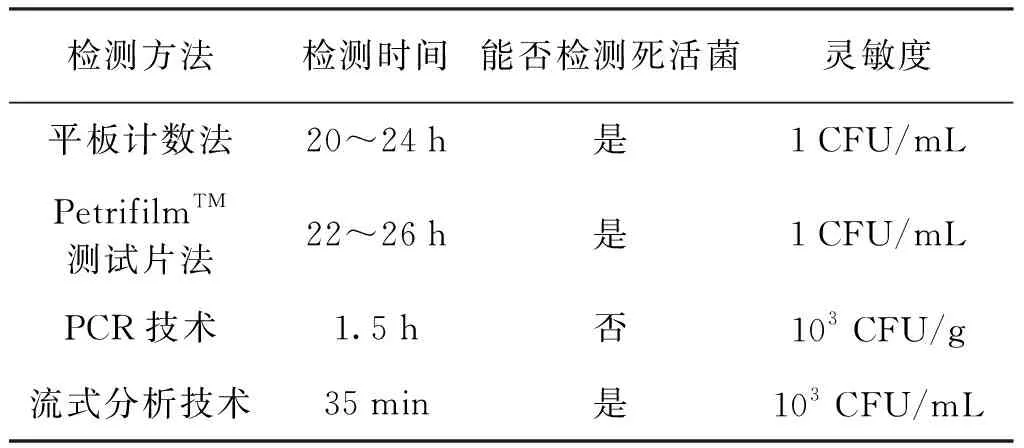
表5 金黄色葡萄球菌不同检测方法的比较Tab.5 Comparison of different detection methods for Staphylococcus aureus
与这些方法相比,流式分析法检测金黄色葡萄球菌的时间明显缩短,可以满足食品中金黄色葡萄球菌快速检测的需求。此外,流式分析法还能够检测VBNC状态的细菌,可以避免平板计数法和PetrifilmTM测试片法的漏检问题[9,10]。PCR法检测的是细菌核酸,无法区分死菌与活菌,会造成一定程度的假阳性[11,12]。通过比较分析,流式分析法更适用于实际奶粉样品中金黄色葡萄球菌活菌的快速准确定量检测。
目前,平板计数法仍然是金黄色葡萄球菌检测的经典方法。本研究通过比较流式分析法与平板计数法,证明在103~108CFU/mL的浓度范围内,两种方法定量检测金黄色葡萄球菌活菌的结果基本一致且线性良好,流式分析法的灵敏度可达到2.72×103CFU/mL。然而,国家标准规定的乳制品中金黄色葡萄球菌的限量值为10 CFU/g(mL),最高安全限量值为100 CFU/g(mL),相对来说,所建立的流式分析法检测下限仍然有些偏高,对于实际奶粉样品的检测需求尚存在一定差距。然而,有研究表明,在流式分析法检测之前,若采用一定的富集方式以增加待检细菌浓度,可以降低流式分析法的检测下限[32]。本研究在奶粉中金黄色葡萄球菌的快速定量检测中做了有益尝试,同时,我们会在今后的工作中不断优化细菌的富集方法,进一步提升该方法的灵敏度,推动该方法在实际奶粉中金黄色葡萄球菌检测的应用。
5 结 论
本研究探索性地建立了一种金黄色葡萄球菌活菌的快速定量检测方法,并可对奶粉中金黄色葡萄球菌活菌进行有效检测。虽然本研究所建立的流式分析法检测目标微生物是金黄色葡萄球菌,但是在未来的研究中可以将该技术平台应用于食品中其他微生物的快速、高效和精准定量检测,具有广阔的应用价值。

