TGF-β3诱导骨髓间充质干细胞膜片成软骨分化*
张展松, 陈 亮, 何少茹△, 刘玉梅, 姚植业, 冯博文
[1广东省心血管病研究所,2广东省人民医院(广东省医学科学院),广东广州510080]
细胞膜片技术[1](cell sheet technology,CST)是近年来组织工程领域与再生研究领域应用的细胞培养新技术,其可作为干细胞应用的载体,并且结合生物材料拥有成骨和血管化能力;完整地保留了细胞自分泌的细胞外基质、细胞-细胞间连接蛋白、细胞表面相关分子受体以及细胞间离子通道,避免了细胞消化酶对细胞活性的影响[2];具备良好的组织相容性,促进组织器官完全修复;具有一定的强度和操作性,其可通过对折、叠加等方式构建出理想的膜片厚度;有良好的各向分化能力,已被广泛应用于血管、心脏组织、皮肤、骨组织以及牙周组织等组织工程研究与再生医学领域。细胞膜片可通过温敏培养皿或抗坏血酸诱导成膜后机械剥离获得,我们前期研究显示,抗坏血酸(ascorbic acid,AA)诱导成膜更简单[3]。研究表明,转化生长因子β3(transforming growth factor-β3,TGF-β3)参与了软骨细胞增殖、分化、肥大和终末分化,能有效促进II 型胶原(collagen type II,Col II)和蛋白聚糖(proteoglycan,PG)等软骨基质形成[4-5]。但目前国内外关于组织工程领域中运用TGF-β3诱导细胞膜片软骨化少有研究。
因此,本研究于体外分离、培养髓间充质干细胞(bone marrow mesenchymal stem cells,BMSMCs),经抗坏血酸诱导后于体外构建干细胞膜片(stem cell sheet,SCS),探索TGF-β3 诱导骨髓间充质干细胞膜片成软骨分化的可行性。
材料和方法
1 动物
出生2 个月的新西兰大白兔,不限雌雄,体重1.5~2.0 kg,选购自南方医科大学实验动物中心,许可证号为SCXK(粤)2011-0015。
2 主要试剂
兔干细胞培养基及软骨诱导培养基、血清和TGF-β3(Cyagen);α-MEM 培养基和澳洲胎牛血清(Gibco);抗坏血酸AA(Sigma);鼠抗兔Col II抗体(Novusbio);苏木素染液、番红染液、伊红染液、Masson丽春红酸性染液、阿利新蓝染液和甲苯胺蓝染液(谷歌生物公司);DAKA II 抗(K5007,Agilent);RNAiso Plus RNA 提取试剂盒、反转录试剂盒(RR036A)和荧光定量试剂盒(DRR420A)购自TaKaRa。
3 主要方法
3.1 抗坏血酸诱导BMMSCs 构建干细胞膜片(SCS) 无菌操作台获取BMMSCs,放到细胞培养箱,取第3 代的BMMSCs,经传代操作后接种到6 孔板中并调整细胞密度为1×109/L;待细胞贴壁后PBS轻轻冲洗2 次,更改为等量的AA 诱导培养基(α-MEM 培养基+10%FBS+20 mg/L AA);每天镜下观察对比细胞形态及培养板中的大体改变,每3 d 换液1次,干预14 d。
3.2 SCS 诱导软骨分化 取培养板中干预14 天后的SCS,弃去AA 诱导培养基,PBS 彻底冲洗;实验组添加等量的TGF-β3 软骨分化培养基,并设置为CSCS 组;对照组继续加入相同量的AA 诱导培养基,并设置为SCS 组;每天镜下观察对比细胞形态及培养板中的大体改变,每3 d换液1次,干预14 d。
3.3 石蜡切片、HE 染色与Masson 染色 将成软骨诱导分化构建的CSCS 与抗坏血酸构的SCS 经固定、脱水、透明、包埋修块、切片摊片、烤片等制备成石蜡切片,行HE染色、Masson染色与阿利新蓝染色。
HE 染色:将制备好的石蜡片,放置到二甲苯中脱蜡,而后于乙醇中浸泡,以去除二甲苯,最后于蒸馏水中洗去乙醇至水,石蜡片滴加苏木素染液染色5 min,1%盐酸乙醇分化30 s,1%碱性氨溶液中返蓝30 s,待着色满意后滴加伊红染液染色1~3 min,再次经过梯度乙醇与二甲苯脱水透明,中性树胶封片,做好相关标记。
Masson 染色:将制备好的石蜡片,放置到二甲苯中脱蜡,而后于乙醇中浸泡,以去除二甲苯,最后于蒸馏水中洗去酒精至水,石蜡片滴加苏木素染液染色5 min,1%盐酸乙醇分化30 s,Masson 丽春红酸性染液染色5 min,2%冰醋酸浸洗30 s,1%磷钼酸分化3~5 min,苯胺蓝染液染色5 min,0.2%冰醋酸浸洗30 s,显微镜下观察染液的染色效果;再次经过梯度乙醇与二甲苯脱水透明,树胶封片,做好相关标记。
阿利新蓝染色:将制备好的石蜡片,放置到二甲苯中脱蜡,而后于乙醇中浸泡,以去除二甲苯,最后于蒸馏水中洗去酒精至水,阿利新蓝酸化液3 min,Alcian 蓝染色液染色30 min ,根据着色效果复染5 min,再次经过梯度乙醇与二甲苯脱水透明,树胶封片,做好相关标记。
联合AA 与TGF-β3 构建CSCS 的Col II 染色:膜片进行包埋后制备成石蜡切片,置于蛋白酶K(20 mg/L),于37℃中进行抗原的修复30 min,PBS 洗涤,滴加50 μL H2O2-甲醇封闭液于组织石蜡片上,滴入适当比例的抗Col II 抗体于组织切片上并完全覆盖组织。湿盒内4℃孵育过夜,组织切片上添加人HRP标注的抗鼠的Ⅱ抗(需完全浸润组织),25℃反应50 min,组织石蜡片上添加即时配好的DAB 反应液(需完全覆盖组织),阳性反应为棕黄色,镜下观察DAB显色效果以把控显色时间,并终DAB液,苏木素染液染色,1% HCl 分化,碱性氨溶液中返蓝,清水冲,脱水透明,标本封片。
3.4 RT-qPCR 检 测CSCS 与SCS 中Col II 与PG 的mRNA 表达 获取实验组和对照组膜片,RNAiso Plus 提取细胞RNA,反转录获得cDNA,RT-qPCR 检测软骨化相关基因的表达。引物序列见表1(由Ta-KaRa 设计)。PCR 由荧光定量PCR 仪自动采集目的基因与内参基因的Ct值。实验组和对照组组间的目的基因相对表达量(即实验组目的基因相对表达量相对于对照组的倍数)用2-ΔΔCt表示。

表1 RT-qPCR引物序列Table 1. The sequences of the primers for RT-qPCR
4 统计学处理
统计软件SPSS 20.0进行分析。数据使用均数±标准差(mean±SD)表示,两组间比较使用两独立样本t检验,当P<0.05为差异有统计学上的意义。
结果
1 BMMSCs 成膜后经成软骨诱导分化的镜下及整体结构改变
BMMSCs 接种培养后,显微镜下可见细胞贴壁生长,呈梭形或不规则形。2 d 时可见细胞生长密集,细胞密度达到90%以上。经抗坏血酸干预14 d后,镜下可见BMMSCs 生长良好,细胞密度进一步增大,细胞间隙难以辨别。成软骨诱导分化14 d后,镜下间充质干细胞生长良好(图1)。大体上,BMMSCs经抗坏血酸干预后行成软骨诱导分化,可用镊子钳夹起“膜片”状结构,可卷缩成团再展开成膜(图2)。

Figure 1. Microscope of bone marrow mesenchymal stem cells chondrogenic differentiation after cell sheet formation(×100). A:the microscopic image showed that the cells were adherent and grew in a spindle or irregular shape;B:cells grew densely at 2 d;C:after 14 d of ascorbic acid intervention,the cell density further increased and the intercellular space was difficult to distinguish;D:after 14 d of cartilage-induced differentiation,the cells grew well under microscope.图1 骨髓间充质干细胞成膜后经成软骨诱导分化的镜下观察
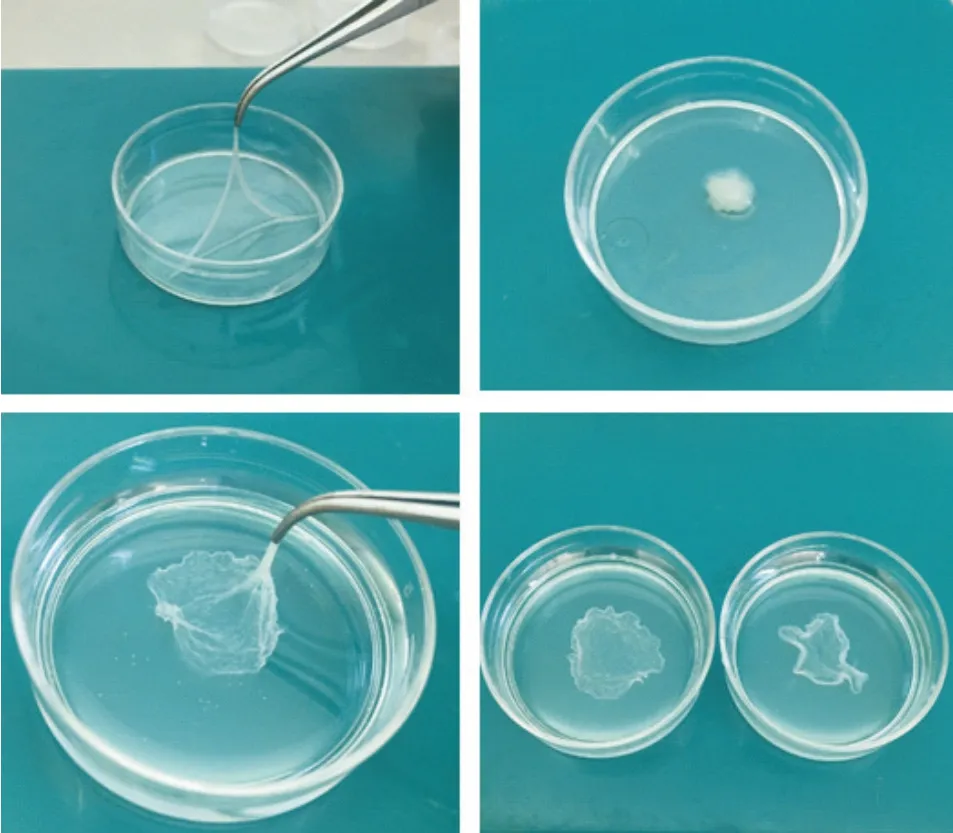
Figure 2. The overall structure of bone marrow mesenchymal stem cell sheet after chondrogenic differentiation. After the bone marrow mesenchymal stem cell sheetwas induced to differentiate into cartilage,the "sheet"structure was clamped with forceps,which could be rolled into a mass and expanded into a sheet.图2 骨髓间充质干细胞膜片成软骨诱导分化后的整体结构
2 HE染色及Masson染色
HE 染色可见CSCS 的细胞质及细胞外基质成分均被染成粉红色,其胞核为蓝色,细胞间呈分层状排列结构(图3A)。Masson染色,CSCS的胞核染成蓝黑色,其细胞质染成粉红色,周围包绕着大量染成蓝色的胶原成分(图3B)。SCS 组的HE 染色及Masson 染色大致同CSCS组(图4)。

Figure 3. The microscopic imagesof chondrogenic SCS under HE and Masson staining(×400). In HE staining,the cytoplasm and extracellular matrix components of CSCS werestained pink and their nuclei wereblue;the cells werearranged hierarchically;in Masson staining,the nucleus of CSCS was stained blue-black,and its cytoplasm was stained pink,surrounded by a large amount of collagen stained blue.图3 CSCS的HE染色及Masson染色结果

Figure 4. The microscopic images of SCS under HE and Masson staining(×400).图4 SCS的HE染色及Masson染色结果
3 CSCS与SCS的阿利新蓝染色观察
CSCS 经成软骨诱导分化14 d 后,在阿利新蓝染色中,胞核呈红色,细胞质及细胞外基质呈蓝色(图5A);SCS 对照组在阿利新蓝染色中,胞核为红色,其余成分被染成浅蓝色或近乎无色(图5B)。
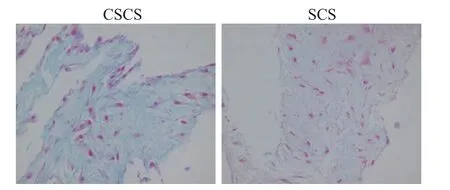
Figure 5. The microscopic imagesof chondrogenic SCS and SCS under Alcian blue staining( ×400). A:after the CSCS was induced to differentiate into cartilage,the nucleus was red,the cytoplasm and extracellular matrix were blue;B:the nucleus of the SCS was red,and the remaining components were stained light blue or almost colorless.图5 CSCS与SCS的阿利新蓝染色结果
4 CSCS 与SCS 的软骨化标志物Col II 的免疫组化染色观察
骨髓间充质干细胞膜片经由成软骨诱导分化培养基诱导14 d 后,对Col II 染色,阳性表达Ⅱ型胶原的CSCS 胞浆为棕黄色,其细胞核呈蓝黑色(图6A);未经诱导的SCS 无表达,胞浆呈无色,细胞核呈蓝黑色(图6B)。

Figure 6. Immunohistochemicalevalation in collagen II of chondrogenic SCS and SCS(×400).A:in the cartilage-related marker collagen II with immunohistochemical staining,the CSCSpositively expressed type II collagen:the cytoplasm of SCSC was brown-yellow and the nuclei were blue-black;B:no expression of collagen II in uninduced SCS group was observed.图6 CSCS与SCS的collagen II的免疫组化染色结果
5 CSCS 与SCS 的软骨化相关基因的RT-qPCR 检测结果
与SCS 组(对照组)相比,CSCS 组(实验组)经成软骨诱导分化后,Col II 和PG 的mRNA 表达均显著升高(P<0.05或P<0.01),见图7。
讨论
细胞膜片技术是近年来组织工程领域的细胞培养新技术,1993 年Okano 等[6]采用温度敏感性材料多聚N-异丙基丙烯酰胺(polyN-isopropylacrylamide,PIPAAm)制备成温度敏感型培养皿,通过温度变化,直接获得细胞膜片。避免了胰蛋白酶的消化,完好保留细胞外基质、细胞-细胞间连接蛋白、细胞表面相关分子受体及细胞间离子通道[2]。目前,细胞膜片的制备方法很多,包括温敏培养系统、光反应系统、电反应系统以及机械方法,但都存在一些缺点,如温敏系统培养的细胞膜片可能会影响细胞的聚合与分化。Guo 等[7]通过添加抗坏血酸来促进细胞外基质分泌,快速稳定地获取骨髓间充质干细胞片。与其他方法相比,此法具有更简便、低廉等特性。Wei等[8]研究发现抗坏血酸能提高端粒酶的活性,促进骨髓间充质干细胞的增殖,于体外很好地构建了骨髓间充质干细胞片,可以为基于细胞的组织再生提供简单且实用的方法。并且,在临床应用中,细胞膜片已经被成功地应用到角膜、心脏等组织的修复中[9-10]。本研究中,在抗坏血酸的作用下,兔骨髓间充质干细胞出现生长活跃现象,镜下可观察到细胞生长致密。在大体上可见骨髓间充质干细胞形成半透明地薄层膜状结构,且无需消化酶的作用,即可将细胞膜片完整地从培养板中取下来,组织学染色中可见细胞外包绕着大量染成蓝色的胶原成分,能获取到有生物活性的外基质成分。

Figure 7. The mRNA expression of chondrogenic differentiation related genes in CSCS and SCS. Mean±SD. n=3. *P<0.05,**P<0.01 vs control group.图7 CSCS与SCS的软骨化相关基因的mRNA表达
转化生长因子β(transforming growth factor-β,TGF-β)是一个广泛的生长因子家族,可调节不同组织中的细胞增殖,分化,凋亡和迁移[11]。TGF-β 可以通过激活细胞外信号Smad2/3 信号通路影响软骨细胞和MSC 增殖和分化,并诱导细胞外基质的表达[4,12]。TGF-β3 在软骨结构分化和代谢中起到重要的作用[5]。软骨组织主要是由细胞外基质和包绕在其中的软骨细胞组成,细胞外基质蛋白的合成及相关基因的表达是正常软骨细胞的一大特征[13]。软骨细胞合成的细胞外基质主要为Col II 和PG,且在固体基质内,50%~75%是胶原和15%~30%是PG[14]。Ravindran 等[15]研 究团 队 将 人 骨髓 来 源 的MSC 和PEG 微球构建3D 共聚集系统,在TGF-β3 诱导后促进BMSCs 中软骨形成基因如Col II 和PG 的表达。Diekman 等[16]在藻酸盐珠或软骨衍生的基质中将TGF-β3 作为软骨诱导因子,发现与前者相同的结论。因此,可以通过鉴定细胞外基质的成分来验证软骨细胞。研究表明,未经诱导的正常BMSCs 表达Col I,几乎没有表达Col II 和PG[17-18]。本研究采用阿利新蓝染色、Col II 免疫组化染色和RT-qPCR 鉴定显示细胞外基质中Col II 和PG 高表达,表明TGF-β3 可成功诱导干细胞膜片向软骨分化。
细胞膜片技术在软骨分化方面的研究亦有报道。由于细胞膜片完好的保留细胞外基质,具备良好的组织相容性和屏障功能,且能够为软骨再生提供生长因子,同时又能在体内免受分解代谢因子的影响,保护再生软骨组织,不少研究者认为软骨细胞膜片能够很好地修复半层软骨缺损[18-19]。Kaneshiro等[19]研究表明将多层软骨细胞膜片叠加在一起修复兔关节软骨半层缺损,术后经PCR 检测层状软骨细胞片能够保持软骨表型,高表达Col II 和PG,经番红染色和甲苯胺蓝染色,提示软骨缺损修复良好。Sekine 等[20]研究团队将人子宫内膜腺体来源的干细胞膜片叠成细胞密集的3D 组织,在高细胞密度和缺氧环境下向软骨方向分化,通过软骨特异性标记物Col II 免疫组织化学染色,组织内PG 含量检测来验证成软骨分化能力,研究结果显示间充质干细胞能够迅速向软骨方向分化。
本研究中,在形成的膜片中添加TGF-β3 诱导干细胞膜片成软骨分化,通过阿利新蓝染色、Col II 免疫组化染色和RT-qPCR 鉴定细胞的Col II和PG 的表达,在mRNA 和蛋白水平验证细胞膜片的成软骨分化能力,结果显示高表达软骨化相关基因Col II 和PG,软骨特异性染色标志物Col II免疫组织化学染色和阿利新蓝染色呈阳性,在基因水平和分子水平上呈现一致,证实体外经TGF-β3 可成功诱导干细胞膜片向软骨分化。
综上所述,在抗坏血酸的作用下,兔骨髓间充质干细胞出现生长活跃现象,分泌了大量的胶原细胞外基质成分,形成了干细胞膜片。在TGF-β3 的作用下,软骨特异性染色标志物Col II免疫组织化学染色和阿利新蓝染色呈阳性,膜片整体高表达软骨化相关基因Col II 和PG,在体外成功地诱导软骨分化构建出软骨细胞膜片,并且能完整地获取软骨诱导后的细胞及包绕其的细胞外基质结构,对组织工程学中的研究具有重大意义。本研究使用抗坏血酸和TGF-β3,两种因子之间是否存在联系并没深入探究,仍有待进一步阐明。

