Xyloketal B通过调控JAK2/STAT3信号通路减轻大鼠癫痫后脑损伤*
潘德锋, 刘剑锋
(南华大学附属第二医院儿科,湖南衡阳421001)
癫痫是一种慢性神经系统疾病,它影响着各个年龄段的人,并给患者家庭及社会带来沉重的经济和精神负担。据估计,全球有1 050万儿童患有癫痫病,80%的癫痫病患者生活在中低收入国家[1]。癫痫的病因复杂多样,包括遗传代谢因素、免疫异常、外伤、感染和系统性疾病等。抗癫痫药可抑制癫痫发作或改善症状,而不能影响疾病的病理过程,并且约有30%的患者为难治性癫痫[2]。因而探讨癫痫的发病机制,寻找新的抗癫痫药物有着重要意义。
Janus激酶(Janus kinase,JAK)/信号转导及转录激活因子(signal transducer and activator of transcription,STAT)信号通路是近年来发现的一条由细胞因子刺激的信号转导通路,参与细胞的增殖、分化、炎症、凋亡以及免疫调节等许多重要的生物学过程[3]。JAK 通过结合受体感受胞外的信号,如干扰素、白细胞介素和生长因子等,并将信息传送到STAT。磷酸化的STAT 能够从胞内转移到细胞核并结合到启动子DNA 序列上,引起DNA 转录与活性水平发生改变,进而影响细胞生长、分化及死亡等基本细胞功能[4]。JAK2 和STAT3 主要表达在脑组织,研究表明脑损伤后激活的JAK/STAT 通路促进了小胶质细胞的活化、增殖,在中枢系统疾病中参与了炎症和凋亡等多种病理过程[5]。目前对JAK2/STAT3 信号通路的研究主要集中在缺氧缺血性脑病,血液肿瘤,免疫功能紊乱和心血管疾病中[6-7],对于在发育期癫痫方面国内外很少有报道。
xyloketal B(Xyl-B)是一种新型的海洋天然产物,是结构新颖的苯并吡喃类化合物,最初从中国南海红树林内生真菌中分离得到。Xyl-B 被证明具有多种生物医学活性,包括抗神经毒性,抗内皮细胞氧化作用,抗神经胶质瘤及动脉粥样硬化斑块形成,可用于神经心血管疾病的治疗[8-9]。研究证实,Xyl-B可通过抑制TLR4/NF-κB 炎症信号通路从而减少缺血引起的脑损伤[10],可以通过防止氧化型低密度脂蛋白(oxidized low-density lipoprotein,oxLDL)诱导的内皮氧化损伤,从而治疗动脉粥样硬化[11]。目前Xyl-B 是否在癫痫中有治疗作用国内外尚未有报道。由于癫痫后脑损伤与炎症反应及氧化应激有关,而JAK2/STAT3 信号通路在炎症及氧化应激反应中扮演着重要的角色,因而我们猜想,Xyl-B 可能通过干预JAK2/STAT3 信号通路并对癫痫后脑损伤有保护作用。
本实验旨在通过建立发育期大鼠癫痫模型,观察癫痫后JAK2/STAT3 信号通路和凋亡相关因子的表达变化、神经元细胞的数量和小胶质细胞活化情况,探讨Xyl-B能够通过调控JAK2/STAT3信号通路,抑制红藻氨酸(kainic acid,KA)诱导的发育期大鼠癫痫,对脑损伤起到保护作用。
材料和方法
1 实验试剂
KA(Sigma);Xyl-B(中山大学);p-JAK2、p-STAT3、TNF-α、IL-1β 和Bax 抗体(Abcam);caspase-3、Bcl-2 和β-actin 抗体(武汉博士德生物工程有限公司);免疫荧光NeuN 和Iba-1 抗体(Sigma);BCA 蛋白定量试剂盒、PVDF 膜和ECL 化学发光剂(上海碧云天公司);cDNA 逆转录及RT-qPCR 试剂盒(Promega);Trizol 试剂(北京柏莱斯特科技发展有限公司);苏木素-伊红染色液(浙江康泰生物科技有限公司)。
2 方法
2.1 大鼠惊厥模型的建立及分组 40 只20 日龄健康SPF 级SD 雄性大鼠,体重60~80 g[南华大学实验动物中心提供,许可证号:SCXK(湘)2020-0002],随机分为4 组,即对照(control)组、KA 组、KA+Xyl-B(10 mg/kg)组及KA+Xyl-B(20 mg/kg)组,每组10只。通过腹腔注射KA(15 mg/kg)制作大鼠癫痫模型。参考Racine 分级标准[12]:0 级,无惊厥;Ⅰ级,呆立不动、眨眼,嘴和面部表现为抽动、咀嚼样动作;Ⅱ级,节律性点头,前肢和/或尾伸展;Ⅲ级:前肢阵挛,后退,刻板运动;Ⅳ级,前肢阵挛、抽搐伴后肢站立;Ⅴ级,四肢抽动、反复跌倒、全身阵挛。出现Ⅳ~Ⅴ级发作为造模成功。参考Pan 等[10]相关研究,KA 诱导癫痫前30 min 腹腔注射Xyl-B 干预治疗。control 组仅注射生理盐水。造模时有2只未出现惊厥发作,2只出现惊厥持续状态而导致死亡,造模成功率为90%。最终每组选取8 只大鼠用于后续实验,大鼠癫痫后24 h断头取脑,收集海马组织。
2.2 免疫荧光观察神经元数量和活化的小胶质细胞 将大鼠用异氟烷麻醉,固定头和四肢,暴露心脏,灌流针插入左心尖,右心耳剪个小口,先予生理盐水后予4%多聚甲醛灌流,直至肝脏变白,取出脑组织于4%多聚甲醛中浸泡24 h,后置于30%蔗糖溶液脱水,予OCT 包埋剂,在冰冻切片机上切成5 μm厚度组织片。组织片置于0.5%Triton X-100 室温通透20 min;用含5%山羊血清室温封闭切片1 h 以消除非特异性染色;分别加入NeuN 抗体和Iba-1 抗体(兔抗大鼠1∶250),4℃孵育过夜。将组织片用PBS洗3 次,加入荧光标记的Ⅱ抗(1∶200),37℃避光孵育2 h,PBS 洗3 次后进行封片,通过荧光显微镜观察结果。镜下对每张切片随机选取5 个面积相同的高倍视野(×400 倍),计数每个视野NeuN 或Iba-1 染色阳性细胞数,取平均值即为成熟神经元细胞数或活化的小胶质细胞。
2.3 Western blot 检测p-JAK2、p-STAT3、TNF-α、IL-1β、caspase-3、Bax 和Bcl-2 蛋白水平 大鼠癫痫后24 h 断头取脑,分离海马组织,用玻璃棒充分匀浆。加入RIPA 裂解液与PMSF 蛋白酶抑制剂,再次匀浆直到组织充分破碎。4℃、8 000×g离心10 min,离心的上清液即是总蛋白。取上清液,BCA 法测定蛋白浓度。按说明书配制分离胶和浓缩胶并放至电泳槽内。样品与5×Loading Buffer 按体积4∶1 混合,98℃煮沸5 min;上样时蛋白总量保持一致。向电泳槽中先加入电泳液,恒压电泳,蛋白从浓缩胶移动到分离胶;电泳结束后取出电泳架,切去多余的分离胶及浓缩胶;在转膜槽中加入转膜液,将蛋白转移到PVDF膜;转膜结束后用PBS浸泡PVDF膜,后用5%脱脂牛奶封闭,室温下水平摇床封闭2 h;弃去封闭液,分别加入Ⅰ抗[兔抗大鼠p-JAK2(1∶5 000)、兔抗大鼠p-STAT3(1∶3 000)、兔抗大鼠TNF-α(1∶1 000)、小鼠抗大鼠IL-1β(1∶1 000)、兔抗大鼠caspase-3(1∶1 000)、兔抗大鼠Bax(1∶1 000)和兔抗大鼠Bcl-2(1∶1 000)抗体],4℃孵育过夜;用PBST洗膜3次;敷Ⅱ抗:辣根过氧化物酶标记的小鼠或兔Ⅱ抗(1∶5 000)在室温下孵2 h,再次用PBST 清洗3 次;将ECL 发光剂中A 液和B 液按1∶1 等体积混合后滴加至PVDF 膜;用ImageQuant™LAS 4000 显影仪扫描条带;用ImageJ软件分析蛋白条带光密度。
2.4 RT-qPCR 检 测JAK2、STAT3、TNF-α、IL-1β、caspase-3、Bax 和Bcl-2 mRNA 表达量 取分离的大脑海马组织,加入Trizol 裂解液和氯仿,样本分离为下层的红色酚氯仿相,中间层以及无色水相上层。将水相上层RNA 转移到无RNA 酶的离心管中。加等体积异丙醇混合以沉淀RNA。每1 mL Trizol 试剂裂解的样品中加入1 mL 的75%乙醇,清洗RNA 沉淀。离心后吸去乙醇溶液,使RNA 沉淀在室温中干燥后得到总RNA。用无RNA 酶的水溶解RNA,紫外吸收法测定RNA 浓度和纯度。按照cDNA 合成试剂盒(Thermo Scientific)的说明,加入样本RNA、逆转录酶、上游引物和下游引物合成模板cDNA。按照RTqPCR 试剂盒的要求,加入cDNA、上游引物和下游引物在PCR 仪上进行DNA 扩增。RT-qPCR 循环扩增条件如下:变性95℃,45 s;退火56℃,45 s;延伸72℃,1 min;30 个循环,循环结束后4℃冷却。所用引物序列见表1。

表1 RT-qPCR引物序列Table 1. The sequences of the primers for RT-qPCR
3 统计学处理
采用SPSS 20.0 软件进行统计学分析。计量资料以均数±标准差(mean±SD)表示。多组间均数比较采用单因素方差分析。以P<0.05 为差异有统计学意义。
结果
1 免疫荧光观察神经元数量和活化的小胶质细胞
发育期大鼠癫痫后24 h,免疫荧光观察海马CA1 区成熟神经元数量和活化的小胶质细胞。结果显示,control 组可见较多的成熟神经元(NeuN 阳性细胞;图1A)和少许活化小胶质细胞(Iba-1 阳性细胞;图2A);KA组神经元数量显著减少(P<0.05),活化的小胶质细胞数量显著增加(P<0.05),胞体肥大,突起增粗或融合,见图1B 和图2B;与KA 组比较,KA+Xyl-B(10 mg/kg)组神经元数量增多(P<0.05),活化小胶质细胞数量减少,见图1C和图2C;与KA组比较,KA+Xyl-B(20 mg/kg)组神经元数量显著增多(P<0.05),而活化小胶质细胞数量显著减少(P<0.05),细胞胞体瘦小,突起纤细,分布稀疏,见图1D和图2D。
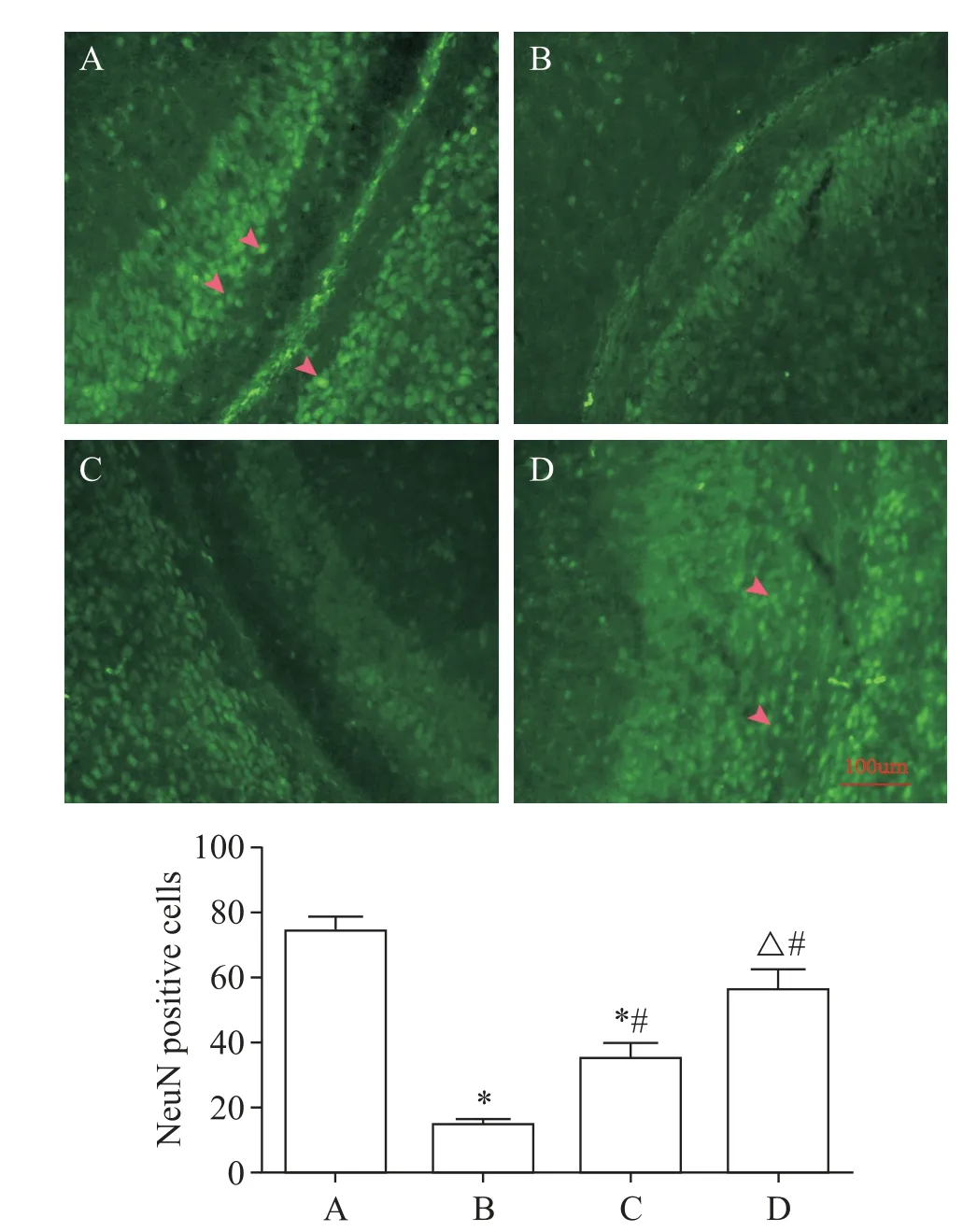
Figure 1. Mature neurons were observed by immunofluorescence for NeuN. The red arrows indicate NeuN positive cells. Scale bar =100 μm. A:control group;B:KA group;C:KA+Xyl-B(10 mg/kg)group;D:KA+Xyl-B(20 mg/kg)group. Mean±SD. n=5. *P<0.05 vs control group;#P<0.05 vs KA group;△P<0.05 vs KA+Xyl-B(10 mg/kg)group.图1 免疫荧光观察成熟的神经元

Figure 2. Activated microglia were observed by immunofluorescence for Iba-1. The blue arrows indicate Iba-1 positive cells,and the area marked by the yellow arrows is a partially enlarged image. Scale bar=100 μm. A:control group;B:KA group;C:KA+Xyl-B(10 mg/kg)group;D:KA+Xyl-B(20 mg/kg)group. Mean±SD. n=5. *P<0.05 vs control group;#P<0.05 vs KA group;△P<0.05 vs KA+Xyl-B(10 mg/kg)group.图2 免疫荧光观察活化的小胶质细胞
2 Xyl-B 减少p-JAK2、p-STAT3、TNF-α 和IL-1β蛋白水平
为了探讨Xyl-B 对JAK2/STAT3 信号通路的影响,我们采用Western blot 测定了大鼠癫痫后24 h 大脑海马p-JAK2、p-STAT3、TNF-α和IL-1β蛋白表达水平。结果如下:(1)癫痫后KA 组p-JAK2、p-STAT3、TNF-α 和IL-1β 蛋白水平较对照组显著升高(P<0.05);(2)Xyl-B 干预组能抑制KA 诱导的蛋白表达增 加,其 中KA+Xyl-B(20 mg/kg)组p-JAK2、p-STAT3、TNF-α 和IL-1β 蛋白水平显著低于KA 组(p<0.05);(3)进一步比较显示,KA+Xyl-B(20 mg/kg)组p-STAT3、TNF-α 和IL-1β 蛋白显著低于KA+Xyl-B(10 mg/kg)组(P<0.05),见图3。
3 Xyl-B 减少JAK2、STAT3、TNF-α 和IL-1β 的mRNA表达量
为了进一步探讨Xyl-B 对JAK2/STAT3信号通路的影响,我们采用RT-qPCR 测定了发育期大鼠癫痫后24 h 海马JAK2、STAT3、TNF-α 和IL-1β 的mRNA表达水平。结果如下:(1)癫痫后KA 组JAK2、STAT3、TNF-α 和IL-1β mRNA 表达较对照组显著增高(P<0.05);(2)Xyl-B 干预治疗能抑制KA 诱导的mRNA 表达增加,其中KA+Xyl-B(10 mg/kg)组JAK2和IL-1β 显著低于KA 组,而KA+Xyl-B(20 mg/kg)组JAK2、STAT3、TNF-α 和IL-1β mRNA 表达均显著低于KA 组(P<0.05);(3)进一步比较显示,KA+Xyl-B(20 mg/kg)组STAT3 和TNF-α mRNA 表达显著低于KA+Xyl-B(10 mg/kg)组(P<0.05),见图4。

Figure 4. The mRNA expression of JAK2,STAT3,TNF-α and IL-1β in the hippocampus after epilepsy was detected by RT-qPCR. Mean±SD. n=8. *P<0.05 vs control group;#P<0.05 vs KA group;△P<0.05 vs KA+Xyl-B(10 mg/kg)group.图4 RT-qPCR检测癫痫后海马区JAK2、STAT3、TNF-α和IL-1β的mRNA表达量
4 Xyl-B对caspase-3、Bax和Bcl-2蛋白表达的影响
为了探讨Xyl-B 对细胞凋亡相关蛋白的影响,我们采用Western blot 测定了caspase-3、Bax 和Bcl2 蛋白表达水平。结果如下:(1)癫痫后KA 组caspase-3和Bax 蛋白表达显著增加(P<0.05),而Xyl-B(10 mg/kg 或20 mg/kg)干预能显著抑制蛋白的增加(P<0.05);(2)癫痫后KA 组Bcl-2 蛋白表达显著减少(P<0.05),而Xyl-B(10 mg/kg 或20 mg/kg)干预能显著增加Bcl-2 蛋白的表达(P<0.05);(3)KA+Xyl-B(20 mg/kg)组caspase-3 蛋白表达显著低于KA+Xyl-B(10 mg/kg)组(P<0.05),见图5。
5 Xyl-B 对caspase-3、Bax 和Bcl2 mRNA 表 达 的影响
为了进一步探讨Xyl-B 对细胞凋亡相关蛋白的影响,我们采用RT-qPCR 测定了caspase-3、Bax 和Bcl-2 的mRNA 表达水平。结果如下:(1)与control组比较,癫痫后KA 组caspase-3 和Bax mRNA 表达显著增加(P<0.05);(2)与KA 组比较,Xyl-B(10 mg/kg)干预组Bax 表达显著降低(P<0.05),而Xyl-B(20 mg/kg)干预组caspase-3、Bax 和Bcl2 表达均显著降低(P<0.05);(3)进一步比较显示,KA+Xyl-B(20 mg/kg)组caspase-3 和Bax mRNA 表达显著低于KA+Xyl-B(10 mg/kg)组(P<0.05),见图6。
讨论
癫痫是常见的神经系统疾病,具有突发性、反复发作和暂时性脑功能紊乱等特征。目前癫痫的发病机制尚不明确,现有的抗癫痫药物主要通过调节神经递质受体(如谷氨酸、γ-氨基丁酸和乙酰胆碱受体)或离子通道从而抑制神经元兴奋性[13-14],而不能从癫痫的发病机制去治愈该病。在本实验中,我们选择了KA 诱导大鼠癫痫模型,因为该模型类似于人类颞叶癫痫模型,重复性好,且该模型与小胶质细胞的活化和炎症通路的激活有关[15],因而其病理过程及干预治疗对临床有指导作用。

Figure 5. The protein expression levels of caspase-3,Bax and Bcl-2 in the hippocampus after epilepsy were detected by Western blot. Mean±SD. n=8. *P<0.05 vs control group;#P<0.05 vs KA group;△P<0.05 vs KA+Xyl-B(10 mg/kg)group.图5 Western blot检测癫痫后海马区caspase-3、Bax和Bcl2蛋白表达量

Figure 6. The mRNA expression of caspase-3,Bax and Bcl-2 in the hippocampus after epilepsy was detected by RTqPCR. Mean±SD. n=8. *P<0.05 vs control group;#P<0.05 vs KA group;△P<0.05 vs KA+Xyl-B(10 mg/kg)group.图6 RT-qPCR 检测癫痫后海马区caspase-3、Bax 和Bcl-2的mRNA表达量
小胶质细胞占神经胶质细胞总数的5%~20%,是中枢神经系统中免疫应答的关键调节因子。在正常情况下,小胶质细胞处于静止状态,受到异常刺激时可被激活,迅速增殖并迁移到受伤的部位,介导神经炎症以及诱导神经元凋亡[16]。因此,抑制小胶质细胞的激活和增殖可能是减轻癫痫后损伤的有效措施。在本实验中,我们用KA 诱导大鼠癫痫模型,免疫荧光结果显示癫痫后活化的小胶质细胞数量明显增多,而成熟的神经元细胞明显减少,证实了小胶质细胞的活化参与了癫痫的病理过程。具体机制考虑激活后的小胶质细胞可以分泌大量的炎症因子和神经毒性化合物,包括一氧化氮、肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)、白细胞介素6(interleukin-6,IL-6)和活性氧簇(reactive oxygen species,ROS),会导致细胞毒性作用,破坏神经细胞和血脑屏障,引起中枢神经系统的局部或广泛损伤[17]。有研究显示,TNF-α转基因小鼠会出现严重的神经炎症并表现出神经退行性疾病症状[18],同时炎症因子的产生可以进一步激活小胶质细胞,促进中枢神经系统疾病的病理过程,可引起癫痫发作并加重癫痫后脑损伤[19]。
JAK2/STAT3 是一条重要的炎症反应相关通路,该通路的激活可进入细胞核内启动基因转录,调控炎性反应和凋亡因子表达。JAK2 是非受体型酪氨酸蛋白激酶家族的一种,STAT3 是一种脱核苷酸结合蛋白,是JAK2 的底物和下游因子[20]。JAK2 和STAT3 广泛分布在整个中枢神经系统,可以被许多细胞因子和生长因子(如白细胞介素、集落刺激因子、生长激素等)所激活,活化后的JAK2 可激活STAT3,通过各种靶蛋白的酪氨酸残基使膜外刺激信号传导入细胞内,导致JAK2 和STAT3 磷酸化,p-STAT3 二聚化并转移到细胞核中,可结合特异性启动子序列并调控基因的转录[21]。本研究Western blot和RT-qPCR结果显示,癫痫后JAK2/STAT3信号通路及凋亡蛋白caspase-3 和Bax 表达显著增高,说明JAK2/STAT3 信号通路参与癫痫的病理过程。具体机制考虑如下:(1)JAK2/STAT3 信号激活可促进下游炎症因子TNF-α 和IL-1β 的表达,同时TNF-α 和IL-1β 的高表达可结合它的受体,反过来进一步激活JAK2 和STAT3 并导致其磷酸化,p-JAK2 和p-STAT3与DNA 的结合增加了细胞因子基因的表达并产生更多的细胞因子,这种恶性循环可以导致难以控制的持续炎症[22]。(2)JAK2/STAT3 调控的下游信号也包括细胞凋亡靶点caspase-3、Bax 和Bcl-2 家族蛋白,因而JAK2/STAT3 的激活可以导致神经元的凋亡,减少神经元数量,并加重脑损伤的病理过程[23]。(3)JAK2/STAT3 信号通路可介导小胶质细胞活化,而活化的小胶质细胞可分泌TNF-α 和IL-1β,导致神经炎症及癫痫后脑损伤。Yang 等[24]的研究表明,在新生鼠的缺氧缺血性脑病中,JAK2/STAT3 信号通路可通过增加IL-1β 的表达从而导致脑损伤和行为异常;Liu 等[25]的研究表明,抑制JAK2/STAT3 信号通路可以减少惊厥性脑损伤。这些研究结果与本研究保持一致。
Xyl-B 是从中国南海红树林真菌Xylariasp. 中分离的天然化合物,具有抗氧化、保护血管内皮、抗炎和抗凋亡能力,如抑制NADPH 氧化酶、上调血红素加氧酶1(heme oxygenase 1,HO-1)、抑制L 型钙离子通道、增加Bcl-1/Bax比值、下调TLR4受体等[26]。目前,对Xyl-B 的研究主要集中在缺血性脑卒中、动脉粥样硬化、新生儿缺氧缺血性脑病等,国内外还没有关于癫痫方面的报道。在本实验中,观察到癫痫后KA 组活化的小胶质细胞显著增多,而神经元数量显著减少;JAK2/STAT3炎症通路、凋亡蛋白caspase-3 和Bax 表达显著增多,抗凋亡蛋白Bcl-2 的表达显著减少;而Xyl-B 能逆转这些病理过程,从而对癫痫后脑损伤起到保护作用。具体作用机制考虑如下:(1)Xyl-B 通过抑制JAK2/STAT3 信号通路来降低炎症因子表达和小胶质细胞的活化;在大鼠缺血模型中,注入了JAK2 磷酸化抑制剂AG490,减少了梗死面积及细胞凋亡细胞,并改善了神经功能[27],这表明阻断JAK2 和下游STAT3 的磷酸化作用具有神经保护作用,与本文的研究一致。(2)通过增加抗凋亡蛋白的合成来抑制线粒体损伤和凋亡程序的启动,从而增加存活神经元的数量[28]。(3)通过抗氧化应激通路径提高抗氧化蛋白酶的表达;Zhou 等[29]的研究表明,Xyl-B 可以通过多种途径抑制活性氧ROS 和活性氮RNS的生成,抑制NADPH 氧化酶和内源性抗氧化剂,从而减少癫痫所致的氧化损伤过程。(4)还有报道指出,Xyl-B可以在发作期间阻断过多的钙离子内流,从而减少癫痫的发作。由于实验的局限性,没有对钙离子通道的作用进行研究。同时从本研究实验结果显示,Xyl-B 在剂量为20 mg/kg 时比10 mg/kg治疗效果更好,说明Xyl-B减轻癫痫后脑损伤的作用可能有剂量依赖性。
总之,Xyl-B 能抑制大鼠癫痫后JAK2/STAT3 炎症通路的激活,抑制小胶质细胞活化和凋亡蛋白的表达,增加抗凋亡蛋白和存活的神经元。本研究揭示了Xyl-B 能抑制KA 诱导的发育期大鼠癫痫,减轻癫痫后脑损伤,也为临床上新的抗癫痫药物的开发提供了参考资料。

