川芎嗪对肌肉骨骼疾患大鼠比目鱼肌钙离子通道及细胞凋亡的影响及机制*
肖 凯, 杨 林, 周江红, 高鑫峰, 赵晶晶, 黄若昆
(1武汉市第四医院,华中科技大学同济医学院附属普爱医院骨外科,湖北武汉430030;2华中科技大学同济医学院附属同济医院过敏反应科,湖北武汉430030)
肌肉骨骼疾患(musculoskeletal disorder,MSD)是指由于长期的受力而引起肌肉或骨骼的损伤,其主要特征包括疼痛和活动受限[1]。MSD 中骨骼肌细胞内Ca2+浓度增高是细胞损害的中心环节,Ca2+浓度的变化被证明在骨骼肌的兴奋-收缩-松弛循环中起关键作用[2]。钙超载是指细胞内钙浓度的异常性升高,会导致线粒体肿胀,功能失调,造成细胞不可逆的损伤甚至死亡[3]。研究显示,钙离子发挥其生理学作用需经离子通道介导,L-型钙离子通道Cav1.3是位于细胞膜的跨膜异源多聚体蛋白质,是目前具有药理学意义的一类钙通道,该通道被激活后,开放时间长,失活慢,是细胞兴奋过程中外钙离子内流的主要途径,其活性程度与钙离子内环境稳态的维持有关[4]。
川芎嗪是中药川芎的有效成分之一,属酰胺类生物碱,已被广泛应用于临床[5]。以往的动物实验表明川芎嗪能保护废用状态下的大鼠骨骼肌细胞,并有效抑制细胞质中的钙超载[6]。在心肌细胞的研究中表明,川芎嗪与细胞膜上未激活的L-型钙离子通道结合,能够减少钙离子内流[7]。但川芎嗪在骨骼肌中是否能通过抑制L-型钙离子通道阻止钙超载目前尚未见相关报道。
本研究以静态姿势负荷构建大鼠MSD 模型,并通过检测不同负荷时间下Ca2+-ATPase的活性反应比目鱼肌细胞内钙超载情况;最终选取负荷10 h 的比目鱼肌,观察细胞凋亡水平,检测凋亡相关蛋白caspase-3、caspase-9 及L-型钙离子通道Cav1.3、兰尼碱受体1(ryanodine receptor type 1,RyR1)的表达情况,明确川芎嗪的作用效果及机制,为MSD 中药治疗方案提供参考资料。
材料和方法
1 主要试剂与仪器
磷酸川芎嗪购自北京燕京药业有限公司(国药准字11021964),研磨后用生理盐水稀释制备成灌胃药液;TUNEL 细胞凋亡检测试剂盒和MaxVisionTMHRP-Polymer anti-Rabbit IHC Kit 购 自Bio-Swamp;RNA 提取试剂盒和反转录试剂盒购自TaKaRa;SYBR Green 染料购自Lumiprobe;Ca2+-ATPase 测定试剂盒、全蛋白提取试剂盒、BCA 法蛋白定量测定试剂盒及DAB显色试剂盒购自南京建成生物技术有限公司;超敏ECL 化学发光试剂盒购于上海碧云天生物技术研究所;兔抗大鼠caspase-3、caspase-9、Cav1.3、RyR1 和GAPDH 抗体(Ⅰ抗)和山羊抗兔IgGⅡ抗(Western blot 和免疫组化共用抗体)购自Abcam;其他常规试剂均为国药产品分析纯。凝胶成像分析系统(ABI);低温冷冻离心机(Eppendorf);酶标仪(BioTek);荧光定量PCR仪(Life Technologies)。
2 实验动物
42只SPF级4周龄、体重60~70 g的雄性SD大鼠(此周龄及体重的大鼠肌肉组织较小,便于物质扩散,利于实验)由华中农业大学实验动物中心提供,饲养于SPF 动物房。动物室内环境温度(21±1)℃,湿度(50±15)%,12 h 明暗交替。动物自由饮去离子水,饲喂经辐照消毒的维持饲料(北京华阜康公司提供),暂养1周后开始实验。
3 实验方法
3.1 动物分组及静态姿势负荷构建大鼠MSD 模型[8]42 只SD 大鼠被随机分成3 组:对照(control)组、MSD 模型组及川芎嗪组,每组14 只。根据负荷时间(2、5、8 和10 h)的不同,每组大鼠又分为4 个小组,负荷2、5、8 h 组每组3 只,负荷10 h 组每组5 只。实验开始前0.5 h,对照组和MSD 模型组每只大鼠灌胃2 mL生理盐水,川芎嗪组每只大鼠按6 g/L 剂量灌胃川芎嗪2 mL[8]。实验开始后,对照组每只大鼠不施加任何负荷,MSD 模型组和川芎嗪组每只大鼠以夹板固定四肢持续施加持续性静态姿势负荷2 h、5 h、8 h和10 h。
3.2 实验取材及Ca2+-ATPase 活性测定 分别于负荷2 h、5 h、8 h 和10 h 时颈部脱臼处死大鼠,轻柔游离并取下各小组大鼠两侧完整比目鱼肌,取部分样本充分匀浆,检测匀浆样本中总蛋白含量,后根据超微量Ca2+-ATP 酶测试盒说明书操作,依次经过酶促反应、定磷和公式换算:组织中ATPase 活性=(测定A值-对照A值)/(标准A值-空白A值)×标准品浓度×6×2.8/待测样本蛋白浓度,获得比目鱼肌中Ca2+-ATPase 活性(U/mg prot)。将剩余一部分负荷10 h后的游离比目鱼肌保存于4%甲醛中固定,另一部分于-80℃冷冻保存待检。
3.3 TUNEL染色 取固定48 h的比目鱼肌组织块,用流水冲洗,去除残留的固定液和杂质;用梯度浓度的乙醇逐级脱水;采用二甲苯溶液对组织块进行透明处理;在恒温箱中对组织块进行浸蜡;采用石蜡对浸透蜡的组织块进行包裹;切片机上切片,切片厚度为4~5 μm;将切片依次进行TUNEL 染色处理:烤片和脱蜡后水化,用蛋白酶K 工作液常温孵育15~30 min,加50 μL TUNEL 反应混合液于样品上,在湿盒、暗室中避光37℃孵育60 min,用PBS 冲洗3 次,加入50 μL 转化剂-POD,在湿盒中避光37℃孵育30 min,用PBS 冲洗3 次,加入100 μL DAB 底物,于15~25℃孵育10 min,用PBS 冲洗3 次,苏木素复染、脱水、透明,封片,光镜下检查凋亡细胞。
3.4 RT-qPCR 检测比目鱼肌caspase-3、caspase-9、Cav1.3及RyR1的mRNA 表达 根据NCBI上公布的大鼠caspase-3、caspase-9、Cav1.3、RyR1 及内参照GAPDH 的序列分别设计RT-qPCR用引物:caspase-3的上游引物序列为5"-CATGGAGATGAAGGAGTA-3",下游引物序列为5"-CCTGAATGATGAAGAGTT-3";caspase-9 的上游引物序列为5"-GTGTCCTACTCCACCTTC-3",下游引物序列为5"-TCTGCTTATAAACCCCTT-3";Cav1.3 的上游引物序列为5"-ATTTACATCCCGTTCCCT-3",下游引物序列为5"-AAGTTCCATCCGTTCCTA-3";RyR1 的上游引物序列为5"-TTTCATCCGTCACTCACA-3",下游引物序列为5"-CAGGCTCGTCTTCATCTT-3";GAPDH 的 上游引物序列为5"-CAAGTTCAACGGCACAG-3",下游引物序列为5"-CCAGTAGACTCCACGACAT-3"。所有引物由上海生物工程有限公司代为合成。取-80℃冻存的各组大鼠比目鱼肌样本,分别提取组织RNA,反转录成cDNA 单链作为模板,采用20 μL 反应体系:上下游引物各0.5 μL,SYBR Green Mix 10 μL,cDNA 模板1.0 μL,灭菌双蒸水8 μL。反应程序:95℃3 min;95℃5 s,60℃30 s,72℃25 s,35 个循环;65℃5 min;95℃50 s。采用2-ΔΔCt法计算基因的相对表达量。
3.5 Western blot 检测比目鱼肌caspase-3、caspase-9、Cav1.3及RyR1蛋白的表达 取-80℃冻存的各组大鼠比目鱼肌样本,采用组织全蛋白提取试剂盒分别进行蛋白提取;用BCA 蛋白浓度检测试剂盒进行浓度检测;后取20 μg 蛋白和4 μL 2×SDS 上样缓冲液混合均匀,100℃变性10 min后上样,SDS-PAGE分离后转至PVDF 膜上,用5%脱脂牛奶封闭1 h,PBS洗膜后分别加入Ⅰ抗[caspase-3(1∶1 000),caspase-9(1∶1 000),Cav1.3(1∶2 000),RyR1(1∶2 000),GAPDH(1∶1 000)],4℃孵育过夜;PBS 洗膜,加入HRP 标记的Ⅱ抗羊抗兔IgG 室温孵育0.5 h;PBS 洗膜,用ECL 化学发光进行显色。以GAPDH 作为内参蛋白,采用Quantity One 图像处理软件进行半定量分析。
3.6 免疫组化检测比目鱼肌caspase-3、caspase-9、Cav1.3 及RyR1 蛋白的表达 参照TUNEL 染色前期操作制作比目鱼肌石蜡切片,切片厚度为3~5 μm;将切好的片子依次进行免疫组化染色处理:烤片和脱蜡;水化;采用0.01 mol/L 柠檬酸钠缓冲溶液中高压(125℃,103 kPa)修复15 min,自然冷却后,PBS 洗3 min×3 次;将玻片置于3% H2O2中,湿盒孵育10 min,以消除内源性过氧化物酶的活性;PBS 冲洗3 min×3 次;封闭,将玻片置于0.5%BSA 中,湿盒孵育30 min,PBS 冲洗3 min×3 次;滴加Ⅰ抗[caspase-3(1∶300),caspase-9(1∶300),Cav1.3(1∶500),RyR1(1∶500)],4℃湿盒中孵育过夜,PBS 冲洗3 min×3次;将切片从4℃冰箱中取出,放置室温下30 min 复温,PBS 冲洗5 min×3 次,滴加MaxVision Ⅱ抗,湿盒中孵育,室温下放置30 min,PBS 冲洗3 min×3 次;加入100 μL DAB 底物,于15~25℃孵育10 min;用PBS冲洗3 次;苏木素复染、脱水、透明;封片,光镜下观察各指标阳性染色情况。
4 统计学处理
所有数据均采用统计软件SPSS 19.0 进行分析处理。计量资料以均值±标准差(mean±SD)表示。同组不同时间点比较采用t检验,多组间数据比较选择单因素方差分析,进一步两两比较采用Tukey 检验。以P<0.05为差异有统计学意义。
结果
1 川芎嗪提升MSD 大鼠比目鱼肌Ca2+-ATPase活性
Ca2+-ATPase 活性检测结果显示,对照组各时点比目鱼肌Ca2+-ATPase 活性正常平稳,差异无统计学显著性(P>0.05);与对照组各时点比较,MSD 模型组大鼠各时点比目鱼肌细胞Ca2+-ATPase活性均显著降低(P<0.01);与MSD 模型2 h 亚组比较,MSD 模型5、8、10 h亚组大鼠比目鱼肌Ca2+-ATPase 活性显著降低(P<0.01);川芎嗪组大鼠各时点比目鱼肌细胞的Ca2+-ATPase 活性均较MSD 模型组相应时点升高(P<0.05)。川芎嗪组大鼠随施压时间延长其比目鱼肌细胞Ca2+-ATPase 活性逐渐升高(P<0.01),施压10 h后达到高峰。见表1。
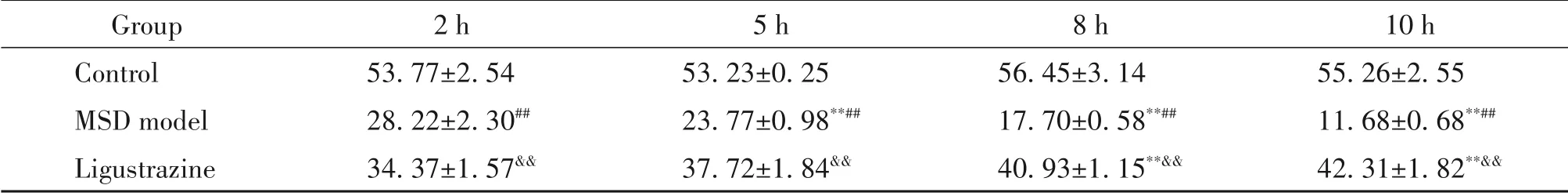
表1 三组大鼠不同时期比目鱼肌Ca2+-ATPase活性变化情况Table 1. Changes of Ca2+-ATPase activity in soleus muscle of the 3 groups in different periods(×103 U/g. Mean±SD. n=3)
2 川芎嗪抑制MSD大鼠比目鱼肌细胞凋亡
TUNEL 染色结果显示,与对照组比较,MSD 模型组大鼠比目鱼肌凋亡细胞(棕黄色)增多,而与MSD 模型组比较,川芎嗪组大鼠比目鱼肌凋亡细胞减少,见图1。

Figure 1. Apoptosis of soleus muscle cells in control,MSD model,and ligustrazine groups was detected by TUNEL staining. The brown yellow granules indicate apoptotic cells,and the number of apoptotic cells was increased in MSD model group. The scale bar=50 μm.图1 TUNEL染色检测比目鱼肌细胞凋亡
3 川芎嗪对细胞凋亡及钙离子通道相关基因表达的影响
RT-qPCR 检测结果显示,与对照组比较,MSD 模型组大鼠比目鱼肌中caspase-3、caspase-9 及Cav1.3的mRNA 表达显著增加(P<0.01),RyR1 的mRNA 表达水平显著降低(P<0.01);而与MSD 模型组比较,川芎嗪组大鼠比目鱼肌caspase-3、caspase-9 及Cav1.3 的mRNA 表达显著降低(P<0.01),而RyR1的mRNA表达水平显著增加(P<0.01),见图2。
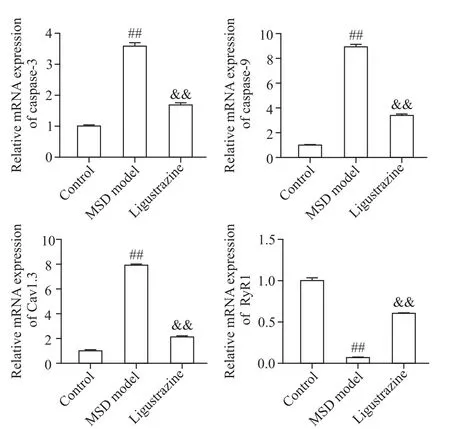
Figure 2. The mRNA expression of caspase-3,caspase-9,Cav1.3,and RyR1 was detected by RT-qPCR.Mean±SD. n=5. ##P<0.01 vs control group;&&P<0.01 vs MSD model group.图2 RT-qPCR 检测caspase-3、caspase-9、Cav1.3 及RyR1的mRNA表达水平
4 川芎嗪对细胞凋亡及钙离子通道相关蛋白表达的影响
Western blot检测结果显示,与对照组比较,MSD模型组大鼠比目鱼肌中caspase-3、caspase-9 及Cav1.3蛋白表达量显著增加(P<0.01),RyR1蛋白表达量显著降低(P<0.01);而与MSD 模型组比较,川芎嗪组大鼠比目鱼肌caspase-3、caspase-9 及Cav1.3蛋白表达量显著降低(P<0.01),而RyR1蛋白表达量显著增加(P<0.01),见图3。
此外,我们还通过免疫组化检测了比目鱼肌组织各蛋白的表达情况,与对照组比较,MSD 模型组caspase-3、caspase-9及Cav1.3蛋白的阳性染色(棕黄色)增加,而RyR1蛋白的阳性染色减少;相较于MSD模型组,川芎嗪组caspase-3、caspase-9 及Cav1.3 蛋白的阳性表达降低,RyR1 蛋白的阳性表达增加,见图4。
讨论
MSD 能够引起肌肉组织结构、功能、代谢发生改变,主要累及骨骼肌细胞,造成细胞膜通透性增加、膜损伤加剧以及膜内外环境稳态发生变化[9]。比目鱼肌是腿部骨骼肌重要结构之一,起自膝关节胫骨后端与腓骨头、下方汇入跟腱止于足底,起旋转脚面、提足作用[10]。Ca2+-ATPase 是骨骼肌维系肌浆网膜钙离子稳态的重要蛋白,正常情况下Ca2+储存在肌浆网中。肌细胞兴奋时,诱发肌浆网释放大量Ca2+,引起肌肉收缩[11]。Ca2+-ATPase 水解ATP 提供能量,通过不对称地分布于膜内外丰富的Ca2+泵逆浓度梯度摄取胞浆Ca2+重新转运回肌浆网内腔,解离肌原纤维结合的Ca2+,触发肌肉舒张[12]。研究发现,大鼠在进行力竭运动后,心肌组织肌浆网Ca2+-ATPase 活性显著降低[13]。本研究结果显示,静态姿势负荷会导致大鼠比目鱼肌中Ca2+-ATPase 活性下降,且呈时间依赖性;而川芎嗪干预逆转了这一现象,显著提升了Ca2+-ATPase 的活性,并趋于正常水平。此外,肌细胞L-型钙离子通道Cav1.3 及RyR1 在Ca2+环境稳态的调节中扮演着重要作用[14]。L-型钙离子通道(Cav1.2 和Cav1.3)在相对较低的膜电位下容易打开,使Ca2+进入细胞[15]。RyR 为钙离子释放通道,RyR1 为亚型之一[16]。本研究显示川芎嗪干预能显著调控MSD 大鼠比目鱼肌中Cav1.3 的高表达及RyR1 的低表达状态,推测川芎嗪可抑制肌细胞钙离子进入通道,促进钙离子释放通道蛋白的表达,进而发挥钙超载的拮抗作用。
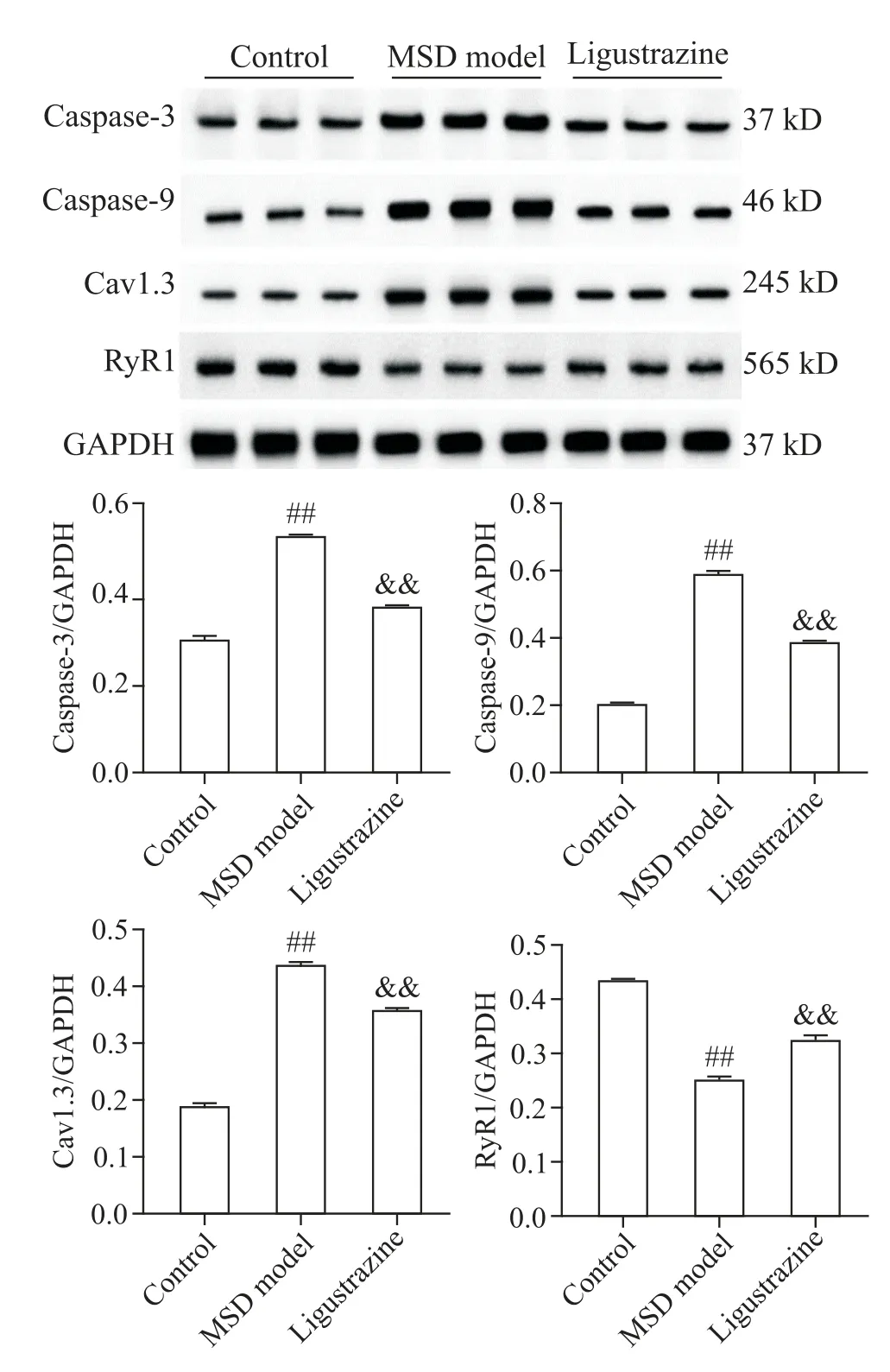
Figure 3. The protein expressions of caspase-3,caspase-9,Cav1.3 and RyR1 was detected by Western blot.Mean±SD. n=5. ##P<0.01 vs control group;&&P<0.01 vs MSD model group.图3 Western blot 检 测caspase-3、caspase-9、Cav1.3 及RyR1蛋白的表达水平
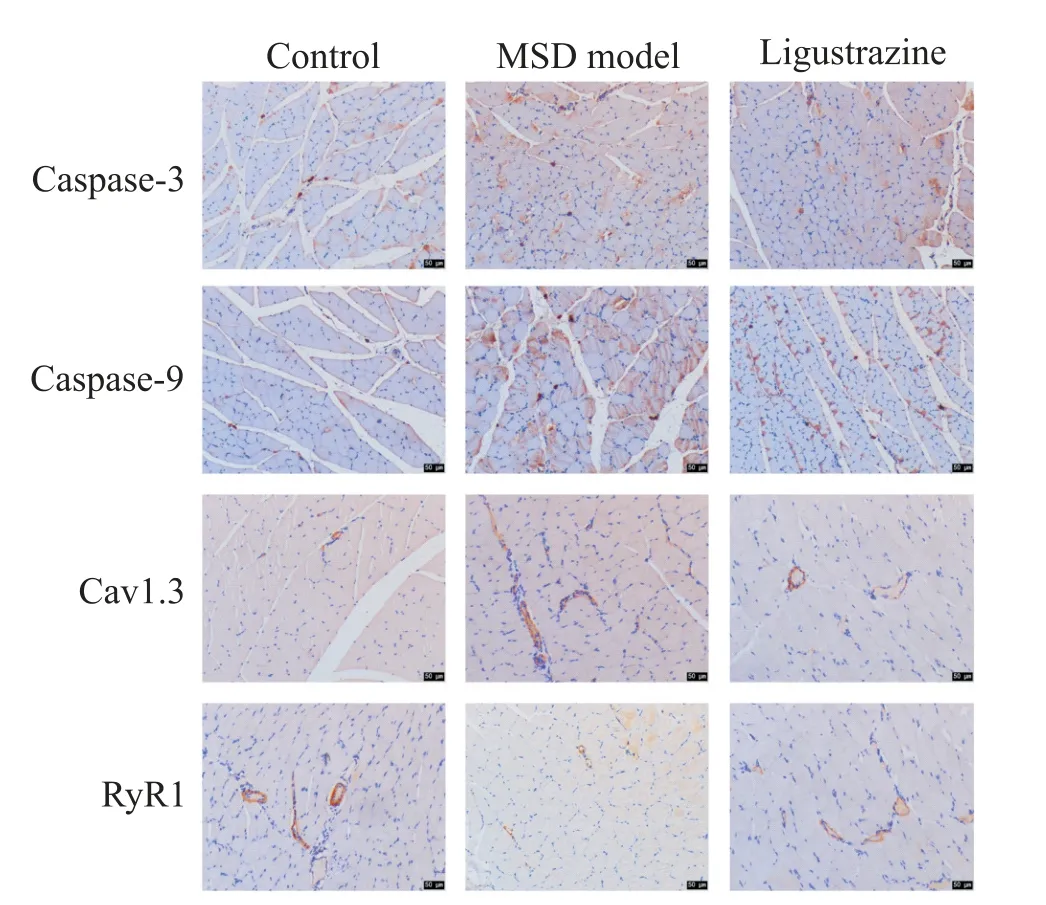
Figure 4. The expression of caspase-3,caspase-9,Cav1.3 and RyR1 was detected by immunohistochemistry. The positive expression of caspase-3,caspase-9,Cav1.3 and RYR1 protein was found in the brown yellow region. The scale bar=50 μm.图4 免疫组化检测caspase-3、caspase-9、Cav1.3及RyR1蛋白的表达
钙超载被认为是造成细胞不可逆损伤的主要原因,持续性钙超载可诱发细胞凋亡的发生[17]。已有研究表明,川芎嗪可通过抑制谷氨酸、KCl 诱导的神经细胞内钙超载促进体外培养的大脑皮层神经细胞存活[18]。此外,川芎嗪的衍生物-川芎嗪硝酮也能显著提高视网膜节细胞的存活率,并显著增强大鼠视觉电生理的光反应幅度,其机制可能与降低由NMDA 受体所提高的cleaved caspase-3/caspase-3、Bax/Bcl-2的比值有关[19]。上述研究提示川芎嗪可拮抗钙超载,缓解细胞凋亡,本研究结果与之相一致,川芎嗪能显著抑制钙超载介导的MSD大鼠比目鱼肌细胞的凋亡,其机制可能与抑制caspase-3/-9 介导的凋亡信号通路有关。
综上所述,川芎嗪能显著提升静态姿势负荷后MSD 大鼠比目鱼肌中Ca2+-ATPase 的活性,抑制Cav1.3 表达,促进RyR1 表达,进而拮抗负荷状态下的钙超载现象,并通过抑制凋亡信号通路缓解由钙超载介导的细胞凋亡,但川芎嗪更详尽的作用机制还需进一步研究。

