枸橼酸钠对高磷诱导小鼠血管平滑肌细胞钙化的抑制作用及机制
陈辉 余辉
咸宁市中心医院湖北科技学院附属第一医院 437000
目前,虽然维持性血液透析能显著提高慢性肾脏病(CKD)患者的长期生存率和生活质量,但血液透析的远期并发症尤其是心血管疾病(CVD)仍是威胁患者生命和影响其预后的重要因素[1]。研究表明,40%~70%透析患者存在明显的冠状动脉疾病,而其中血管钙化(vascular calcification,VC)是导致血液透析患者CVD 发生及死亡的主要原因[2]。
CKD患者VC的发生并非简单的钙磷被动沉积,而是一个包含平滑肌细胞(VSMCs)凋亡,向成骨样细胞表型转换的类似骨形成的生理过程。细胞外的钙和磷酸盐浓度增加后,会导致VSMCs由收缩型过渡到骨软骨细胞表型,形成一个亲钙化基质,并释放大量的基质囊泡,从而为羟基磷灰石形成提供结核位点。这个过程中钙化抑制因子[如基质Gla蛋白(MGP)、焦磷酸盐(PPi)、胎球蛋白A(Fetuin-A)等]表达下调,而钙化促进因子[如碱性磷酸酶(ALP)、骨形态发生蛋白2(BMP-2)、核结合因子α 亚单位1(Cbfa1)等]表达上调[3]。
枸橼酸钠(Na3Cit)是血液透析过程中常用的抗凝剂,Köse 等[4]的体内研究发现透析患者注射枸橼酸钠(Na3Cit)一段时间后,心脏瓣膜的钙化明显减轻,瓣膜组织内的钙磷水平发生降低,钙化周围的胶原纤维也明显减少。Ou 等[5]研究发现Na3Cit 能够减轻患有慢性肾功能衰竭的大鼠的VC,而Meng 等[6]发现作为抗凝剂的肝素对CKD 大鼠的VC的进程没有影响。Na3Cit 中的羧基也能通过螯合羟基磷灰石(HAp)表面的钙离子,从而阻止HAp 进一步生长并减小晶体的厚度。虽然上述大量的研究表明Na3Cit 能够抑制VC,但其具体的抑制机制尚不清楚。
本文使用3 mmol/L 的高磷(Pi)(相当于晚期CKD 患者血清磷的浓度)诱导小鼠主动脉血管平滑肌细胞(MOVAS)钙化,同时加入不同浓度的Na3Cit 来研究其抗VC 效果及可能的机制,期望为降低血液透析患者后期VC发病率及治疗提供新的启示,并寻找既能抗凝又能抗VC的药物。
1 试验部分
1.1 试剂与仪器(1)材料:原代小鼠主动脉血管平滑肌细胞(MOVAS)购自广州吉赛生物科技股份有限公司,DMEM 培养液[Hyclone,海克隆生物化学制品(北京)有限公司],胎牛血清和胰酶(Gibco,美国Gibco 公司),青霉素、链霉素(北京普博生物技术有限公司),细胞增殖毒性检测试剂盒(Cell Counting Kit-8,CCK-8)(日本同仁化学研究所),茜素红染液、BCA 蛋白定量试剂盒、碱性磷酸酶试剂盒、碱性磷酸酶染色试剂盒、Na3Cit 均购自上海碧云天生物技术有限公司,钙测定试剂盒购自北京中生北控生物科技股份有限公司,Trizol 试剂盒(Invitrogen 公司),Annexin V-FITC/PI 细胞凋亡双染试剂盒(美国BD 公司);其他化学试剂均为分析纯并购自广州化学试剂公司。细胞培养板[NEST,耐思生物科技(无锡)有限公司]。(2)仪器:酶标仪(Thermo Multiskan MK3,美国),倒置荧光显微镜(Leica DMRA2,德国),光学显微镜(CKX41,OLYMPUS,日本),流式细胞仪(FACS Aria,BD,美国),荧光定量PCR 仪(ABI7500型,美国ABI公司)。
1.2 细胞培养 原代MOVAS 细胞用含10%胎牛血清的DMEM 培养液在37℃、5%CO2和饱和湿度下培养。细胞传代采用胰蛋白酶消化法。当细胞达80%~90%融合后用PBS 缓冲液洗涤两次,加入0.25%胰酶-EDTA 消化液,置37℃培养箱3~5 min,在倒置显微镜下观察消化程度,消化适度后,加入10%胎牛血清的DMEM培养液终止消化,充分吹打分散细胞,形成单细胞悬液。
1.3 细胞活力检测 把1.2 中制得的单细胞悬液按浓度为5.0×104cells/ml、100 μl/孔接种于96 孔培养板中孵育24 h 后,改用无血清的DMEM 培养液孵育12 h,使细胞同步化。吸除培养液,用PBS 洗涤细胞两次。将试验模型分为2 组:(A)对照组,只加入无血清培养液;(B)Na3Cit 处理组,分别加入浓度为0.5、1、2、4、8、10、16 mmol/L(用无血清培养液配制)的Na3Cit。每个浓度设6 个复孔,同时设细胞对照(抑制剂浓度为0),每孔补加100 μl 细胞培养液,孵育24 h后,每孔加入10 μl 的CCK-8 试剂,避光孵育1.5 h。用酶标仪在450 nm 处测量吸光度(A),求得3 个复孔A 值的平均值。细胞活力%=A(试验组)/A(对照组)×100%。
1.4 茜素红钙化染色 原代MOVAS 按浓度为1.5×104cells/well接种于24孔培养板;吸除培养液,用PBS洗涤细胞两次。试验模型分为4 组:(A)正常对照组:加入含1%FBS的DMEM 培养液(0.9 mmol/L Pi);(B)高磷诱导组:加入含1% FBS 和3 mmol/L Pi 的DMEM 培养液;(C)低浓度Na3Cit处理组:分别加入含1 mmol/L Na3Cit的1%FBS,3 mmol/L Pi DMEM 培养液;(D)高浓度Na3Cit 处理组:分别加入含4 mmol/L Na3Cit 的1%FBS,3 mmol/L Pi DMEM 培养液。各组细胞每隔两天换一次液,孵育14 d。孵育14 d 后弃去上清,用PBS 冲洗3 遍,4%多聚甲醛室温固定20~30 min,再用PBS 冲洗2 遍,茜素红染色,37℃温箱中孵育30 min,吸去茜素红染料,再用PBS冲洗2遍,最后用倒置显微镜下观察。
1.5 细胞钙沉积定量检测 采用邻甲酚酞络合酮法检测细胞钙沉积量。其原理是钙与邻甲酚酞络合酮在pH为10~12 时形成红色复合物,在575 nm 紫外光处产生最大吸收值,光的吸收值与钙含量成正比。细胞种板密度和试验分组参照1.4 进行。培养14 d 后将培养的细胞弃去培养液,PBS液冲洗细胞3次,每孔板内加入0.6 mol/L盐酸,放置在室温下脱钙24 h,吸取上清液参照说明书进行钙离子含量测定。细胞脱钙后,加入细胞裂解液裂解细胞,参照BCA蛋白定量试剂盒的方法检测蛋白的含量。通过蛋白含量来标化钙沉积含量。
1.6 实时荧光定量PCR 检测平滑肌特异性基因表达细胞种板密度和试验分组参照1.4 进行。培养14 d 后弃去培养液,PBS液冲洗细胞3次,采用Trizol试剂并按照试剂盒的方法提取总RNA,然后用上标III 逆转录试剂参照试剂盒方法反转录为cDNA。SM22-α引物序列由武汉金开瑞生物工程有限公司设计并合成,同时参照Liao 等[7]的方法检测和计算SM22-α mRNA表达情况。
1.7 碱性磷酸酶(ALP)活性检测 细胞种板密度和试验分组参照1.4 进行。培养14 d 后将培养的细胞弃去培养液,PBS 液冲洗细胞3 次,每孔加入500 μl 0.1% Triton X-100(用PBS 配制),4℃过夜,反复吹打使细胞破碎,收集在离心管中,1 200 rpm 离心3 min,收集上清,ALP 活性通过对硝基苯酚及碱性磷酸酶检测试剂盒来测定,并用总蛋白来修正[7],每组试验重复3次,取平均值。
1.8 ALP活性定性观察 细胞种板密度和试验分组参照1.4进行。孵育14 d后弃去上清,用PBS冲洗3遍,参照碱性磷酸酶染色试剂盒方法加入染料,室温孵育30 min,再用PBS冲洗2遍,最后用倒置显微镜下观察。
1.9 细胞凋亡检测 细胞种板以1×105cells/ml、2 ml/孔接种于6 孔板,试验分组参照1.4 进行。细胞培养14 d 后吸除上清液,PBS 洗涤2 次,用0.25%胰酶消化,消化适度后加入10%胎牛血清的DMEM 培养液终止消化。吹打细胞,使细胞悬浮,然后1 000 r/min 离心5 min,弃上清,用PBS 洗涤一次,重新离心,得到细胞沉淀。加入200 μl Binding Buffer,混匀,再加入5 μl Annexin V-FITC,室温避光孵育10 min。离心,去上清。加入200 μl Binding Buffer,混匀,再加入5 μl PI,直接上机检测。
2 试验结果
2.1 Na3Cit 对细胞活力的影响 图1 为采用CCK-8 法检测的不同浓度Na3Cit 与MOVAS 细胞作用24 h 后的细胞活力变化。可以看出,Na3Cit对MOVAS具有一定的毒性,且毒性存在浓度效应。随着抑制剂浓度从0.5 mmol/L 逐渐增加到16 mmol/L,Na3Cit 引起的细胞的活力从98.4%减少至43.5%。由于浓度大于4 mmol/L 时,Na3Cit 对细胞有较大的毒性,因此本文后期试验选择抑制剂浓度1~4 mmol/L 作为研究对象,在此浓度范围内,抑制剂自身毒性带来的影响相对较小,可以反映出Na3Cit 在浓度差异较大时抗VC 的效果。
2.2 Na3Cit 抑制高磷诱导的MOVAS 钙化 茜素红能与钙盐螯合形成橘红色的钙沉积物。图2 为高磷条件下,不同浓度Na3Cit 与MOVAS 孵育14 d 后茜素红钙化染色结果。可以看出:(1)对照组细胞无明显的钙沉积出现(图2A),而高磷诱导组(图2B)出现大量的钙沉积;(2)与高磷诱导组相比,加入不同浓度Na3Cit后,MOVAS钙化斑块明显减少(图2C 和2D),说明Na3Cit 能抑制VC,并且其抑制效果随着浓度的增加而更加明显。

图1 不同浓度Na3Cit与MOVAS作用24 h后的细胞活力变化

图2 MOVAS在高磷及不同浓度Na3Cit条件下作用14 d后经茜素红染色后倒置显微镜下观察的细胞钙化情况(200×)
2.3 定量检测Na3Cit 抑制钙化效果 图3 为采用甲酚酞络合酮法来检测不同浓度Na3Cit 与细胞作用14 d 后的细胞钙沉积量。与高磷诱导组相比,加入Na3Cit 的处理组中细胞钙沉积量均有不同浓度的降低,表明它们均能抑制平滑肌细胞钙化,且高浓度的Na3Cit 抑制效果更好,这与茜素红染色观察的结果(图2)一致。
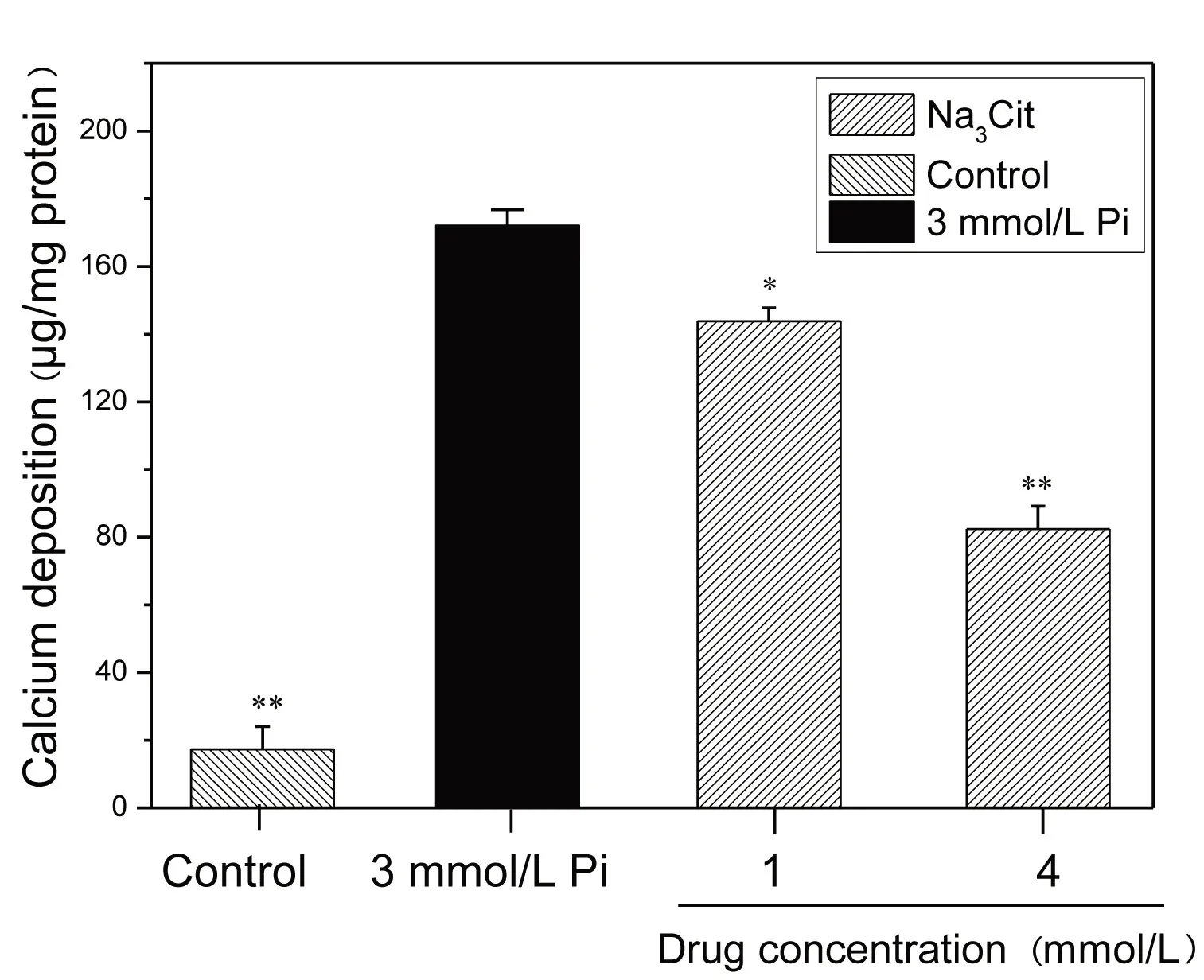
图3 MOVAS在高磷及不同浓度Na3Cit作用14 d后的钙沉积量
2.4 Na3Cit对SM22-α表达的影响 SM22-α作为收缩型VSMCs 的标示物,在VSMCs 向成骨样细胞表型转化过程中其表达下调[7]。如图4 所示,与正常组细胞相比,高磷诱导组细胞中SM22-α mRNA 表达明显下调。而不同浓度Na3Cit 处理组中SM22-α mRNA 表达明显高于高磷诱导组,说明Na3Cit 能够通过抑制平滑肌细胞向成骨样细胞转化来抗钙化。且随着浓度增加,SM22-α mRNA 表达更强,表明在高磷条件下Na3Cit抑制VSMCs 向成骨样细胞转化具有浓度依赖性。
2.5 Na3Cit抑制ALP的活性 如图5所示,不同浓度的Na3Cit 处理组细胞中ALP 的含量均比高磷诱导组小,表明Na3Cit 能通过抑制平滑肌细胞向成骨样细胞表型转化从而抑制钙化,且这种抑制作用具有浓度依赖性。
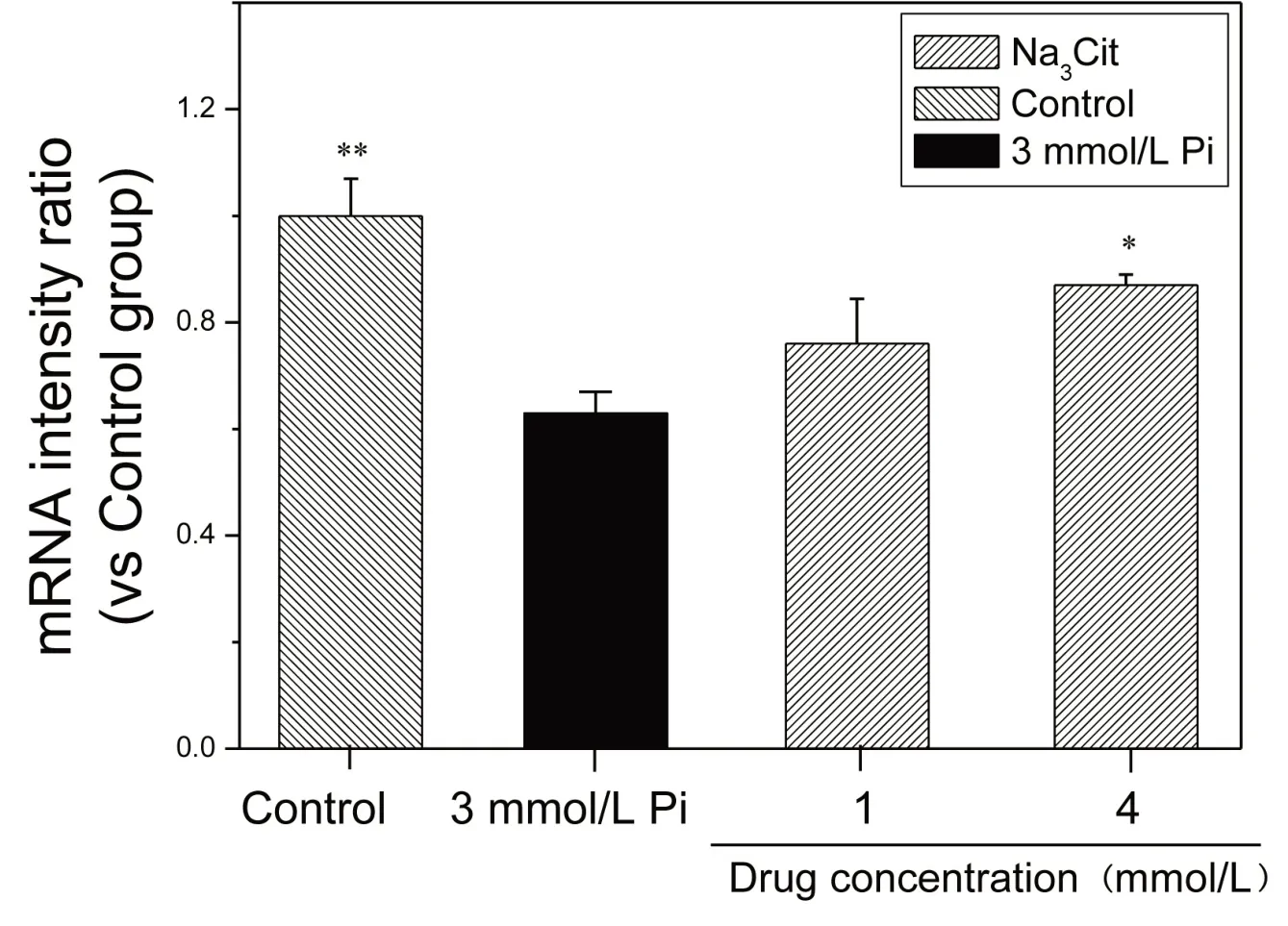
图4 MOVAS在高磷及不同浓度Na3Cit作用14 d后细胞内SM22-α mRNA表达情况

图5 MOVAS在高磷及不同浓度Na3Cit作用14 d后细胞内ALP的活性
2.6 定性观察ALP 活性 为了进一步观察了ALP 在细胞内的表达来观察细胞表型,采用ALP 染色试剂盒对细胞进行染色,其结果如图6 所示。结果表明,不同浓度的Na3Cit呈浓度依赖性方式来抑制高磷诱导的ALP的表达,从而抑制平滑肌细胞向成骨样细胞表型转化。这一结果与图5相一致。
2.7 Na3Cit抑制高磷诱导的MOVAS凋亡 图7为不同浓度的Na3Cit 与MOVAS 孵育14 d 后通过Annexin V 法检测的细胞总凋亡率(Q2+Q3)结果。高磷诱导组(Pi)细胞的凋亡率(16.39%)明显高于对照组(6.33%)(图7B)。与高磷诱导组相比,Na3Cit 处理组浓度从1 mmol/L 增加到4 mmol/L,细胞凋亡率从12.73%减小10.08%,表明Na3Cit 能通过抑制细胞凋亡来抑制钙化,且抑制效果具有浓度依赖性。
3 讨论
3.1 Na3Cit 通过抑制钙磷的沉积从而抑制钙化 钙化过程中凋亡小体释放的Ca2+离子和离子均聚集在基质小泡膜内或接近膜处。一旦钙离子和磷酸盐积累至足够量,首先形成非晶体的无定形磷酸钙,再转变为磷酸八钙,最后形成高度难溶的羟基磷灰石(HAp)。之后,HAp 通过相同方式重复成核、结晶,并扩大沉积区域[6]。图2 和图3 结果表明,不同浓度的Na3Cit 均能抑制高磷诱导的MOVAS 钙化,并且高浓度的Na3Cit 抑制效果更好。大量研究表明钙化患者服用螯合剂乙二胺四乙酸(EDTA)、枸橼酸和N,N,N,N-四-(2-吡啶基甲基)-乙二胺(TPEN)后,其动脉粥样硬化斑块明显减少[8]。并且Hu等[9]体外实验表明富含羧基的蛋白质如骨钙素和骨桥蛋白能够抑制羟基磷灰石晶体的形成和生长。因此我们推测Na3Cit 能够直接抑制HAp 的形成从而抑制VC,这与Villa-Bellosta 和Sorribas[10]的研究结果相一致。ALP 是成骨样细胞形成的早期标志物。VC 过程中,ALP 被分泌到细胞外基质中,形成局部高浓度的ALP,促使磷酸盐升高,形成不可溶解的磷酸盐结晶,导致矿化形成。ALP在正常VSMCs中的浓度较低,在钙化的血管和心脏瓣膜组织中的浓度明显增高。
3.2 Na3Cit能通过抑制VSMCs向成骨样表型转化抑制VC VSMCs 向成骨样细胞转化在VC 过程中起着关键的作用。正常血磷条件下,VSMCs表达为收缩型平滑肌细胞,其标志物SM22-α 等表达较多[11]。高磷条件下,VSMCs 向成骨细胞表型转换,成骨特异性转录因子(如Cbfa1、ALP、SOX9 以及MSX2 等)表达上调,而VSMCs 收缩特异性基因(如SM-MHC、SM22-α 和α-SMA 等)表达下调[12]。ALP 是成骨细胞的一个功能性表型标记物,其活性经常被视为血管钙化的晴雨表。上调的ALP 可降解VC 的抑制因子(如PPi),从而促进钙化的发展[13]。Liu 等[14]和Zavaczki 等[15]发现抑制VSMCs 向成骨细胞表型转化能减轻VC。我们发现不同浓度的Na3Cit 均能在高磷条件下抑制ALP 的活性(图5),并上调SM22-α的表达(图4),说明Na3Cit能抑制VSMCs向成骨样细胞表型转化来抗VC,但其具体的信号通路还需要进一步研究。
3.3 Na3Cit 能通过抑制MOVAS 凋亡抑制VC 细胞凋亡出现在VC的起始阶段,并在钙化过程中也起着重要的作用[16]。高磷能促进VSMCs 凋亡以及释放具有矿化能力的基质囊泡(MV),而MV 能下调钙化抑制因子如基质蛋白(MGP)的表达,活化基质金属蛋白酶2(MMP-2),加速弹力蛋白降解,进而促使钙化的形成[17]。并且MV 与细胞凋亡产生的凋亡小体一同为钙磷结晶在主动脉上的沉积及向HAP 的转化提供成核位点,而且凋亡小体还富含Ca2+和,凋亡性细胞死亡后比原来释放更多的钙,这反过来又可以驱动进一步凋亡,从而加速钙化的进程[18]。而抑制细胞凋亡能够明显抑制VC[19]。图4 结果表明,不同浓度的Na3Cit 均可以明显减少高磷诱导MOVSA 的凋亡,并且高浓度的Na3Cit抑制效果更好,这一结果与Ciceri 等[20]的研究相一致。

图6 MOVAS在高磷及不同浓度Na3Cit作用14 d后细胞内ALP表达情况(400×)

图7 MOVAS在高磷及不同浓度Na3Cit作用14 d后经Annexin V法定量检测细胞的凋亡率(A);细胞凋亡率(Q2+Q3)柱状图(B)
不同浓度的Na3Cit 均能减少高磷诱导的MOVAS 细胞的钙化,且高浓度的Na3Cit抑制效果更好。Na3Cit主要通过抑制钙磷沉积、减小高磷条件下细胞凋亡以及抑制平滑肌细胞向成骨样细胞表型转化来抑制钙化。作为血液抗凝剂的Na3Cit 有可能在临床中同时发挥抗VC 的作用,从而为CKD 患者VC 的防治提供理论基础。由于体外钙化模型与CKD 患者体内钙化有很大的差异[21],因此Na3Cit 抗钙化的具体机制还需进一步深入探讨。
利益冲突:作者已申明文章无相关利益冲突。

